基因轉錄爆發的信號轉導機制
戚家銘,王耀來,唐旭清
(江南大學 理學院,江蘇 無錫 214122)
1958年,Crick提出了分子生物學的中心法則:DNA自我復制,DNA轉錄生成RNA,RNA翻譯生成蛋白質。轉錄是基因表達的第一環節,它把遺傳信息和生理功能的主要執行者蛋白質聯系到了一起。轉錄調控,決定著基因的表達量,從而決定了它對于生物體的發育、形態結構、以及各類生理功能的基礎性地位。近年來,隨著生化檢測技術水平的不斷提高,學術界發現了一個新現象——轉錄爆發(Transcriptional bursting)。基因會從沉默的狀態突然切換為激活態,啟動轉錄、并在短時間內(通常不超過2~3 min)急劇生成產生大量信使RNA;然后再次進入沉默的狀態[1-4]。轉錄爆發的發現,意味著已有的轉錄調控知識需要重新審視;也因為如此,轉錄爆發迅速成為當前生命科學的熱點問題,成為后基因組時代的研究重點[5-6]。轉錄爆發,從簡單的原核生物到高等哺乳動物細胞,普遍存在[1-4]。本文綜述真核生物的轉錄爆發及其調控。
新現象的發現,使得科學家們開始不斷尋找合適的數學模型對此現象進行定量解釋。傳統上認為,基因轉錄是一個泊松過程[7]。但是,在很多情況下,泊松模型并不能與數據吻合。為了對這些數據進行解釋,學術界提出了兩態模型。兩態模型結構簡明,應用廣泛,與數據擬合較好[8-9]。本文首先介紹轉錄爆發的現象和模型。
基因轉錄表現為爆發式,帶來一個富有挑戰性而又有趣的難題。先前認為,轉錄水平與基因接受的調控信號的強度正相關——通常用希爾函數表示[10-11]。具體來講,激活子(也全稱為基因特異性轉錄因子)的濃度越高,基因轉錄水平越高。轉錄爆發現象的發現,意味著傳統觀點不再成立。過去的幾年來,多種信號調控機制如雨后春筍般不斷涌現,比如轉錄爆發頻率調制[8,12]、轉錄爆發尺度調制[9,13],以及它們的組合調制等[14]。但是,學術界尚未達成共識,并且都沒有拿出壓倒性的證據。本文將介紹轉錄爆發現象轉導細胞調控信號的可能機制及其重要的生物學意義,并指出轉錄爆發領域待解決的問題。
1 轉錄爆發現象
轉錄爆發現象的最初發現可追溯到1979年。Mcknight和Miller使用電子顯微鏡在對果蠅胚胎的檢測中發現一個現象:轉錄時,染色體片段因被無轉錄發生的區域隔開而形成許多的新生RNA集群(RNA cluster)。這個新生RNA的集群現象就是最早的轉錄爆發。他們認為這種現象是由于轉錄起始的漲落引起的[15]。但是,這一發現并沒有引起足夠的重視。轉錄過程被認為是一個平穩過程,即轉錄產物的生成速率(單位時間內生成的RNA數量)不隨時間變化。考慮到分子間相互作用的隨機性,基因的轉錄速率在其均值的上下輕微波動[10]。因此,基因被認為以常數概率進行轉錄,信使RNA的生成是一個泊松過程[7]。
因為傳統生化技術是從細胞群體水平上進行檢測的,所以最終得到的是平均信息,丟失了單細胞的動態信息。1990年,Ko等首先使用一種報告基因(Reporter gene)的方法[16]。報告基因被定義為表達產物既易于檢測又易于與內源性蛋白的背景區分的外源性基因。報告基因技術是指將報告基因剪接到目標基因啟動子之后,再通過質粒轉染到細胞內,在特定條件下培養,最終表達出用于產生信號的報告蛋白(如β-半乳糖苷酶、GFP等)。該技術使得科研人員不再受傳統生化技術的阻礙,可以在單細胞水平下觀察基因的表達。20世紀90年代,許多研究都陸續運用了reporter gene的方法,這些研究使用的實驗技術就是最早的單細胞水平的生化技術[17-19]。
直到21世紀初,隨著生物化學技術的不斷進步,單細胞水平甚至單分子水平的檢測技術成為目前研究轉錄爆發現象的主要手段[20-21]。單分子熒光原位雜交技術(Single-molecule Fluorescence in situ hybridization),其基本原理是將特定的信使RNA序列與熒光探針結合,從而可在高分辨率顯微鏡下直接觀測到單個RNA分子。MS2標記技術是此類技術的代表,利用了MS2結合位點(MBS)與名為MS2外殼蛋白(MCP)之間的高度親和性。實驗前,MS2序列被插入到了目標基因的起始位點之后;隨著轉錄的進行,MS2被轉錄出來以后形成莖環結構,該莖環與結合有綠色熒光蛋白的MCP特異性結合。因此,新生成的信使RNA序列可以被跟蹤觀測[2,22]。結果表明,基因轉錄是一個斷斷續續的爆發式過程[2,4](見圖1)。在0秒時,基因處于非激活態,不轉錄;在0到60 s之間,基因突然被激活,轉錄產生大量信使RNA;在120 s時,基因停止轉錄,回到非激活態。生成的信使RNA由于降解而逐漸減少。在接下來的時間內,基因不再進行轉錄,一直處于非激活態;之前轉錄產生的信使RNA逐漸降解,在視野中漸漸消失。

圖1 顯微鏡下轉錄爆發現象的示意圖Fig.1 Schematic diagram of transcriptional bursting under the microscope
隨著單細胞檢測技術的發展,越來越多的學者在研究中觀察到了轉錄爆發現象。無論是酵母菌、盤基網柄菌、果蠅還是哺乳動物,轉錄爆發普遍存在[1-4]。這說明轉錄爆發并非偶然現象,而是基因表達的一種基本性質[2]。這些單細胞和單基因水平的測量結果顯示,轉錄并非傳統上認為的穩恒泊松過程[10-11],而是間歇性的爆發式的。轉錄過程中,基因會從一個無轉錄活性的沉默態突然轉換到一個激活態。在激活態,大量信使RNA被急速生成;激活態的壽命一般不超過2~3 min,基因繼而再次進入沉默態。圖2示意了細胞內信使RNA的數量隨時間的變化。圖2中展示了6次爆發,并示意了第五次爆發的持續時間(兩條藍色直線之間的時間間隔)。
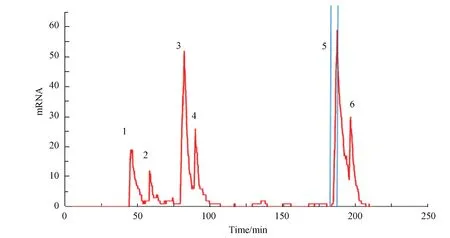
圖2 細胞內信使RNA數量隨時間變化的關系圖Fig.2 Variation of the amount of messenger RNA with time
2 轉錄爆發的兩態模型
傳統的泊松模型,本質上基因只維持在一個狀態;基因在以常數速率一直進行著轉錄。該模型對早期的實驗數據有不錯的解釋[23]。但隨著單細胞實驗技術的不斷進步,這種單態模型無法解釋單細胞數據,兩態模型應運而生。兩態模型是目前學術界研究轉錄爆發使用最廣泛的唯象模型[24]。兩態模型,在研究信使RNA和蛋白質分子的數量變化、單個基因的狀態切換、激活態基因的穩恒轉錄、以及信使RNA的指數降解等方面有很好的效果[4,8-9,25]。
在兩態模型中,基因啟動子只有兩個狀態:轉錄激活態(ON)和非轉錄態(OFF)。兩態模型由四個參數描述,分別是kON,kOFF,km,γ(見圖3)。kON表示從OFF態到ON態的轉換速率;koff表示從ON態到OFF態的轉換速率。只有啟動子處于ON態時,基因才進行轉錄,轉錄速率用km表示,km>0;啟動子處于OFF態時,不轉錄,轉錄速率km=0。信使RNA的降解速率為γ。其中,kON,kOFF,km,γ都為常數[26]。所以,啟動子處于ON態的持續時間服從指數分布[26]。當考慮基因只有ON態而沒有OFF態時,轉錄出的信使RNA數量分布服從泊松分布[25]。

圖3 兩態模型Fig.3 Two-state model
單態模型和兩態模型通常用Gillespie算法和主方程方法進行計算機模擬[25,27-28]。兩態模型的動力學參數與爆發頻率、爆發尺度直接相關。為了方便對爆發調控機制的理解,利用圖2進行名詞進行解釋。圖2展示了6次轉錄爆發,一次爆發的持續時間對應于信使RNA數量上升對應的時間間隔。第5次轉錄爆發上兩條藍色直線之間的時間間隔即為第5次爆發的持續時間,其它爆發依次類推。爆發幅度(Burst magnitude)被定義為一次轉錄爆發產生的信使RNA分子數量。爆發的持續時間和爆發幅度合稱爆發尺度(Burst size)。爆發頻率(Burst frequency)即單位時間內轉錄爆發發生的次數。
3 轉錄爆發信號轉導機制
目前,基因轉錄爆發現象的普遍性已得到公認。隨之而來的問題是,轉錄爆發現象背后的分子調控機制和信號轉導機制是什么?2006年,在諾貝爾化學獎的獲獎演說中,Kornberg歸納了真核生物轉錄機器的基本架構[29]。轉錄機器的基本架構包括通用轉錄因子(General transcription factor)、RNA聚合酶II、媒介子(Mediator)和激活子(Activator)等。其中,通用轉錄因子包括TFIIA、TFIIB、TFIID、TFIIE、TFIIF和TFIIH[29-30]。激活子攜帶來自細胞信號轉導通路的信號,激活子與增強子相互結合并以某種方式編碼了上游信號。媒介子與結合在增強子上的激活子相互結合,并將激活子帶來的上游信號向后傳遞;最后,媒介子與RNA聚合酶II相互作用,轉錄機器開始起始轉錄(見圖4)。而其中的編碼方式則是學術界研究的轉錄爆發的信號轉導機制[22]。目前學術界出現了多種信號轉導機制的猜想與假設,如轉錄的頻率調制[8,12]、轉錄爆發的尺度調制[9,13]、以及這些調制的組合調制[14]。這些調控機制會在下文進行詳細介紹。
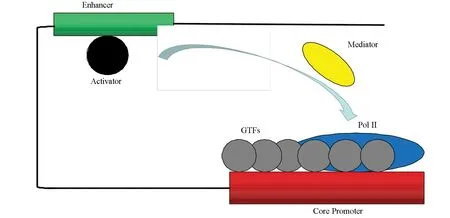
圖4 RNA聚合酶II的轉錄機制Fig.4 Transcription mechanism of RNA polymerase II
為便于理解,本文以兩態模型為基礎對爆發調控機制進行解釋(見圖5)。圖中,基因啟動子處于爆發的ON態和OFF態的時間分別標注為τon和τoff,虛線表示在某類調制模式下增加的部分。轉錄爆發的頻率調制(Burst frequency)是指在不改變τon和轉錄速率km的前提下,基因啟動子通過縮短時間τoff來增加爆發的次數,從而增加基因表達。轉錄爆發的幅度調制(Burst magnitude)是指在不改變τon和τoff的前提下,基因啟動子通過增加轉錄速率km來增加基因表達。轉錄爆發的持續時間調制(Burst duration)是指在不改變轉錄速率km和τoff的前提下,通過延長時間τon來增加基因表達。轉錄爆發的幅度(Burst magnitude)調制和時間(Burst duration)調制統一稱為轉錄爆發的尺度(Burst size)調制。
Senecal的研究發現轉錄爆發中主要的調控機制是頻率調制[8]。該文章使用兩種不同的誘導手段激活MAPK途徑研究了早期響應基因c-Fos的轉錄響應,并調查了不同激活子(血清誘導主要是ERK,鋅誘導主要是p38)對c-Fos基因的轉錄爆發的影響。該研究表明在MAPK誘導期間,轉錄因子濃度調節c-Fos的爆發頻率,而其他爆發參數基本保持不變。具體表現為,在轉錄響應時,隨著誘導物濃度的變化,細胞的激活子濃度和轉錄爆發頻率發生相似的變化。所以該文認為細胞通過調整激活子濃度來控制爆發頻率,進一步控制整體信使RNA的水平。當轉錄因子濃度較高時,細胞更有可能進行激活和進行信使RNA的高水平表達;當轉錄因子濃度低時,情況則相反。這種頻率調制雖然簡單,但對c-Fos基因的轉錄響應是一種通用的機制。
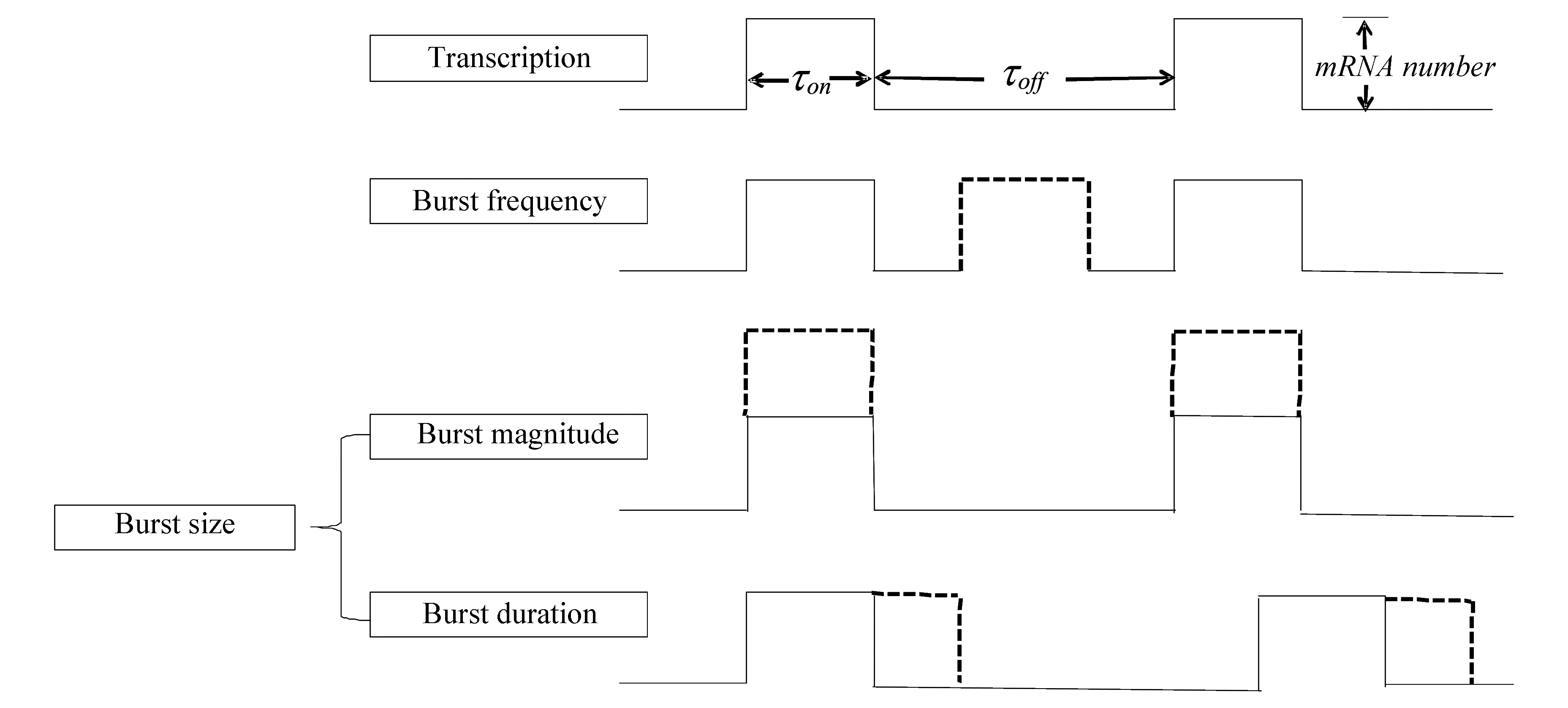
圖5 轉錄爆發調制模式Fig.5 Modulation mode of transcriptional bursting
Molina的研究表明轉錄爆發中主要的調控機制是爆發尺度調制模式[9]。該文針對哺乳動物單細胞單個等位基因ctgf進行血清誘導和TGF-β1誘導,研究二者引起的不同的轉錄響應。二者的誘導都引起了基因的轉錄響應,形成了轉錄爆發現象。血清誘導引起的是瞬時的轉錄響應,之后會產生一個約為3小時的不應期。而TGF-β1誘導引起的則是持續的轉錄響應。該研究表明血清誘導引起的轉錄爆發的原因是轉錄爆發的持續時間τon的延長、轉錄速率km的增加,由于是瞬時的轉錄響應,所以這是一個相應的動力學參數的增長是一個短期的效應。TGF-β1誘導引起的轉錄爆發原因是轉錄爆發的持續時間τon的延長、轉錄速率km的增加,而轉錄速率km長時間保持在較高速率,暗示了某些誘導物會通過持續地增加轉錄速率km來誘導一系列的轉錄爆發。時間τoff的幾乎不變也說明TGF-β1誘導引起的轉錄爆發幾乎不受頻率調制的影響。該研究表明這二種誘導引起的精確的轉錄響應的主要原因是轉錄速率km的增加和爆發持續時間τon的增加,即這兩種誘導引起的轉錄響應是轉錄爆發尺度調制。
Dar的研究顯示,因基因表達水平的不同,爆發頻率與爆發尺度都可以是調制的對象[14]。該文利用noise space[31]作為提取基因表達波動的研究框架,研究了兩個問題,分別是人類基因組中占主導地位的表達模式是什么類型的表達、影響占主導地位的表達模式的主要因素是什么。實驗發現,轉錄爆發模式是轉錄過程的主導形式,爆發頻率與爆發尺度在人類基因組都受到了調制。當基因表達水平較低的時候,轉錄以爆發頻率調制為主,即基因啟動子會通過增加爆發頻率來增加基因的表達。但當爆發頻率達到一個閾值之后,轉錄以爆發尺度調制為主,此時只能通過增加爆發期的轉錄速率或持續時間來繼續增加基因的表達。在人類基因組中,爆發頻率和爆發尺度隨染色體位置的不同而不同。雖然這種二者的變化與啟動子序列無關,但極強地取決于基因座的表達水平。
4 轉錄爆發的生物學意義
在轉錄爆發現象發現的早期,學術界普遍認為這是一種噪音(Noise)。噪音,即圍繞平均值的隨機漲落。隨著研究的深入,越來越多的學者驚嘆,基因轉錄的噪音水平遠遠超出了預期。學術界開始思考噪音對細胞信號轉導的影響,探索噪音水平是如何被控制削弱的[10]。
隨著單細胞單分子測量技術的不斷進步,越來越多的證據表明,轉錄爆發是一種普遍現象。轉錄爆發存在于從簡單的原核細胞到高等真核生物細胞內。學術界不得不承認,轉錄爆發并非是簡單的噪音,而是傳遞細胞調控信號的方式[1-4]。
轉錄爆發是如何攜帶調控信號的?如前所述,目前尚無定論。轉錄爆發傳遞信號的可能方式包括頻率調制和尺度調制,也可能二者兼有。如果是前者,就意味著轉錄調控過程中,信號轉換是數字式的。另一方面,不同基因的爆發動力學也不相同,這種不同背后又蘊含了什么樣的生物學意義?基因轉錄是爆發式的,意味著基于高通量測量方式的數據需要重新審視。爆發式的轉錄,客觀上要求單分子標記技術和計算機模擬技術的進步。
5 總結
本文詳細闡述了轉錄爆發現象和轉錄爆發的兩態模型,并介紹了轉錄調控領域中的信號轉導機制以及轉錄爆發的生物學意義。下面總結該領域內的難點和疑問。首先,學術界認為最有可能的兩種信號調制機制是爆發頻率調制機制和爆發尺度調制機制。轉錄爆發的尺度,是由爆發的持續時間和爆發產生的信使RNA分子的數量決定的。轉錄爆發的頻率是由單位時間內爆發的發生次數決定的。承載信號的究竟是尺度還是頻率,抑或二者兼有?關于轉錄爆發的信息編碼機制,學術界仍在積極地探索中。其次,由于實驗技術的限制,兩次相鄰發生的轉錄爆發的邊界難以區分。另外,轉錄涉及到的許多物質與形態結構也會對轉錄過程產生影響,比如增強子[3]、局部啟動子結構[4]、轉錄因子[8]、核小體構型[32]等。最后,越來越多的研究發現兩態模型并不能對所有爆發現象的實驗數據給出滿意的解釋[33];目前,學術界中已出現了一些更為新穎的轉錄模型,如連續性模型[28]和多尺度模型[34]等。在研究轉錄爆發的動力學和分子機制方面,還有許多工作需要做。

