模塊化合成化學在制備系列鉬酸銨工藝中的應用
徐志昌, 張 萍
(清華大學核能與新能源技術研究院,北京 102201)
0 引 言
近40年來,系列鉬酸銨的國內產量突飛猛進,早已突破萬噸大關。但是,生產工藝的先進性、晶體結構的標準性和均勻性、環境保護的友好性等皆不盡人意。目前,中國鉬業正面臨著提質增效和環境保護,面臨著由鉬業大國向鉬業強國轉變的重要關頭。因此,創新工藝方法,高效優質地生成系列鉬酸銨產品,已經成為許多研究者關注的焦點[1-20]。立足當前,放眼未來,我們要從現有生產工藝出發,找出問題,尋求工藝理論,開辟新的發展之道。目前,系列鉬酸銨產品的生產現狀如何?亟待改變的短板是晶體結構、組成及性能等的失控狀態,從自然王國變成自由王國。
本文深受模塊化理論、模塊化設計、合成化學及自由基化學理論的啟迪,從戰略高度提出“模塊化合成工藝”及“模塊化拆分工藝”的理論框架。這可能是鉬酸銨合成化學領域未來的發展趨勢及前進方向。實踐表明,采用模塊化合成工藝或者模塊化拆分工藝所得鉬酸銨產品具有的特色是棱角分明的晶體結構、靚麗的晶面、均勻分布的粒度、出類拔萃的純度等。
站在模塊化理論的高度來看,目前文獻報道的典型案例,大致分成模塊化合成工藝與模塊化拆分工藝等兩類。例如,一類是以二鉬酸銨為原料,合成七鉬酸銨;另一類是以十鉬酸銨為原料,拆分成七鉬酸銨或二鉬酸銨。結果表明,模塊化合成工藝與模塊化拆分工藝所得產品的各項指標,與傳統的蒸發法及酸化法相比,優勢之突出,無與倫比。
系列鉬酸銨,按照它們的縮合數增加或減少所發生的組成變化,模塊化合成工藝制備的鉬酸銨產品表現為:鉬原子含量上升,氧原子及水合銨的含量下降。模塊化拆分工藝制備的產品表現為:鉬原子含量下降,氧原子及水合銨的含量上升。因此,無論是酸化過程(化學合成)或者是蒸發(物理化學合成)過程,無疑承擔著調節晶體組成的功能。在酸化過程中,氫自由基使得氧原子含量下降;在氨化過程中,氧自由基使得氧原子含量增加。模塊化合成工藝與模塊化拆分工藝涉及許多基礎理論,其中包括模塊化理論、量子物理、自由基化學、結構化學等。
當今,人們普遍認為,模塊化工藝的效率及產品質量,潛力無限。本文依據邏輯思維的方法,在比較、分析、歸納典型案例的基礎上,一方面,人們可以選擇下級的鉬酸銨,制備上級鉬酸銨。另一方面,也可以用上級模塊制備下級鉬酸銨。從精細化工的角度看,廣受青睞的十鉬酸銨的制備,應當擺脫傳統的鉬酸銨酸化工藝,采取以七鉬酸銨為前驅體,經由氫自由基的合成作用,或者采用十二鉬酸銨為前驅體,經由氧自由基的拆分作用,異曲同工地實現合成十鉬酸銨的最終目標。
1 模塊化組合工藝及模塊化拆分工藝的發現
1.1 氫自由基指數、氧自由基指數及水合氨指數的含義

1.2 模塊化及模塊化設計的定義
模塊化定義:對于系列鉬酸銨的合成化學而言,可以定義為:一組具有相同功能和接合要素,但是,結構與性能不同,卻能夠相互轉換的單元,被稱為鉬酸銨模塊。模塊化設計包括,系列鉬酸銨,其中包括二鉬酸銨、七鉬酸銨、八鉬酸銨、十鉬酸銨、十二鉬酸銨等通用模塊,根據市場要求,對模塊進行選擇及組合,設計出功能各異的新產品。
1.3 若干案例的理論詮釋
在若干研究報告里[7-12,14,16],出現過兩類案例,一類是以二鉬酸銨為前驅體,制備七鉬酸銨,另一類是以十鉬酸銨為前驅體,制備七鉬酸銨,或者二鉬酸銨。根據它們的縮合數的變化,一是從下級到上級;另一個是,從上級到下級。兩類案例,看似支離破碎,不得其解,卻蘊含著普遍性邏輯思維。
毫無疑問,模塊化合成工藝及模塊化拆分工藝的產生,源于應用化學理論對典型案例的比較、分析及歸納。顯然,制備七鉬酸銨的兩種工藝,存在兩種不同的反應機理。其中包括氫自由基及氧自由基的介入。氫自由基與酸化過程的氫離子之間及氧自由基與水合氨之間,勢必有著分子間的電子轉移的必然聯系。
量子物理理論表明,在熱能輻射量子激發下,氫離子接受單電子轉移,生成化學活性很高的氫自由基,就位以極性鍵形式參與合成反應;同樣在熱能輻射量子激發下,水合氨分子,發生電子轉移,最終生成化學活性很高的氧自由基,就位以非極性鍵形式參與拆分反應。這可能是系列鉬酸銨在酸性條件下縮合、在堿性條件下拆分的化學原理。
圖1是文獻中給出的七鉬酸銨及八鉬酸銨的分子結構示意圖。依據結構化學理論,七鉬酸根結構的最可能幾率是平面,而八鉬酸銨結構的最大幾率卻是立體、有序結構。圖1表明,每一個鉬酸根,它可視為一個八面體。鉬原子位于八面體的中心,八個頂角均排布了電負性不同的氧原子。因此,系列鉬酸根的結構取決于結構單元的縮合數。縮合數越高,結構的異構體越多。反之,縮合數越少,異構體越少。例如,七鉬酸銨與八鉬酸銨的結構差異是,后者的異構體更加豐富,有α、β、γ、δ等。
自由基化學的理論表明,氫自由基以及氧自由基是化學、生物學及生命科學中最常見、種類繁多、也是最重要的物質。它們不僅能夠參與合成鉬酸銨新物種,即加成作用,而且能夠拆分鉬酸銨生成新物種,即拆分作用。與此同時,在合成工藝中,氫自由基降低了組裝物的氧含量;在拆分工藝中,氧自由基增加了新物種的氧含量。加成與拆分的量子能量,最有可能是來源于熱物理量子的電子轉移作用。因此,無論是合成工藝或者是拆分工藝,都必須在熱溶液條件下而不是在常溫下完成。

圖1 七鉬酸根與八鉬酸根的結構
1.4 模塊化合成工藝的典型案例
馬素娟等人[8-12]采用二鉬酸銨模塊,借助氫自由基的接口作用,合成七鉬酸銨,效果良好。推而廣之,我們可以七鉬酸銨合成八鉬酸銨、以八鉬酸銨合成十鉬酸銨及以十鉬酸銨合成十二鉬酸銨。化學反應方程式:(1)、(2)、(3)、(4)反映了模塊化合成工藝制備系列鉬酸銨的反應機制。表1是模塊化合成四種鉬酸銨所耗用的氫自由基指數。可不難看出,采用模塊化合成法,由下級鉬酸銨合成為上級鉬酸銨,所耗用的氫自由基指數微不足道。它具有傳統的酸化法所無可比擬的節能與環保優勢。
(1)
(2)
(3)
(4)

表1 模塊化合成工藝制備系列鉬酸銨所消耗的氫自由基指數

1.5 模塊化拆分工藝的典型案例
張金蓮等[7,13-14,17,19],以十鉬酸銨為上級合成前驅體,經由氧自由基的拆分作用,制備了化學性能、物理性能優異的下級鉬酸銨。其中包括:二鉬酸銨、七鉬酸銨模塊。以此類推,把十二鉬酸銨拆分成十鉬酸銨、十鉬酸銨拆分成八鉬酸銨、八鉬酸銨拆分成七鉬酸銨、七鉬酸銨拆分成二鉬酸銨,接二連三,皆有可能。化學反應方程式(5)、(6)、(7)、(8)反映了4種模塊化拆分工藝的反應機制。表2 列舉了模塊化拆分工藝所耗用的氧自由基指數。數據表明,模塊拆分工藝所耗用的氧自由基指數,依舊微不足道。
(5)
(6)
(7)
(8)

表2 模塊化拆分工藝所耗用的氧自由基指數

圖2是文獻[19]報道的采用十鉬酸銨模塊化拆分工藝制備七鉬酸銨的工藝流程框圖。圖3是文獻[17]報道的七鉬酸銨拆分為單晶二鉬酸銨的SEM照片及X-衍射譜圖。
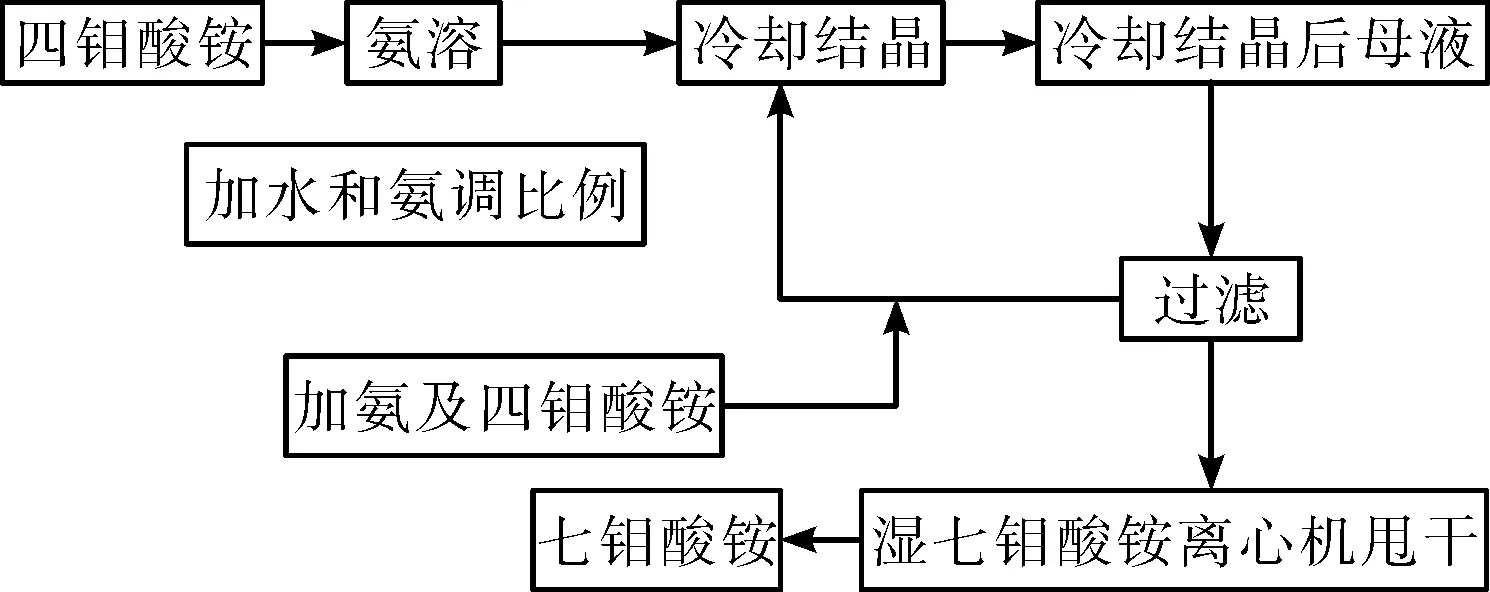
圖2 十鉬酸銨模塊化拆分工藝制備 七鉬酸銨的工藝流程框圖

圖3 七鉬酸銨模塊化拆分生產二鉬酸銨的 SEM照片及X-衍射譜圖
1.6 鉬酸銨氨化過程的化學機理
眾所周知,水合氨分子(NH3‥H‥O‥H‥NH3)對于模塊化合成反應與模塊化拆分反應做出了不可或缺的貢獻。水合氨分子,在酸性溶液中以及堿性溶液中,它們的共價鍵極性是不同的。酸性溶液表現為極性共價鍵;堿性溶液則表現為非極性共價鍵。因此,在酸性溶液里,水合氨分子是以極性共價鍵形式參與鉬酸銨分子的合成反應;在堿性溶液則以非極性共價鍵方式參與鉬酸銨分子的拆分反應。
反應式(9)、(10)、(11)、(12)反映了系列鉬酸銨與水合銨分子之間的反應方程式。表3是系列鉬酸銨轉化所耗用的水合銨指數。結果表明,諸拆分反應所耗用的水合銨指數,與表2的氧自由基指數,毫無二致。而且表明,諸拆分工藝所耗用的水合銨指數,也是微不足道的。
10(NH4)2Mo12O37+2(NH4)2O=12(NH4)2Mo10O31
(9)
8(NH4)2Mo10O31+12(NH4)2O =10(NH4)4Mo8O26
(10)
7(NH4)4Mo8O26+10(NH4)2O =8(NH4)6Mo7O24
(11)
2(NH4)6Mo7O24+(NH4)2O =7(NH4)2Mo2O7
(12)

表3 系列鉬酸銨模塊化拆分工藝所耗用的氧化氨指數
注:μ(NH4)2O*=e(NH4)2O/fMO3代表氧化銨(NH4)2O)與三氧化鉬(MO3)之間的克分子數比值,即各反應所耗用的氧化銨指數。
2 模塊化合成工藝及模塊化拆分工藝制備系列鉬酸銨的技術路線
2.1 模塊化合成工藝制備系列鉬酸銨的技術路線圖
路線圖最鮮明的特點是能體現制備活動的過程節點和方向。例如,系列鉬酸銨制備活動的路線圖,可以分3個階段實施,過程、措施、目標等非常明確。圖4、圖5分別是模塊化合成工藝制備系列鉬酸銨路線圖的不同表達形式。它適用于從戰略層面規劃我國的系列鉬酸銨的研發與應用。技術路線圖表明,系列鉬酸銨產品,都應當也能夠由下級鉬酸銨的模塊組件在氫自由基的作用下合成上級的鉬酸銨產品。

圖4 下級鉬酸銨模塊化合成上級鉬酸銨的技術路線圖(a)
應當指出,結構化學是系列鉬酸銨模塊化學領域中的最新學科。它專門研究分子與晶體的結構及其與物質性能的關系。X-射線衍射方法的生命力一直很旺盛,利用這一方法和儀器,以查明氫自由基及氧自由基在合成與拆分中的結構作用,有待深入研究。
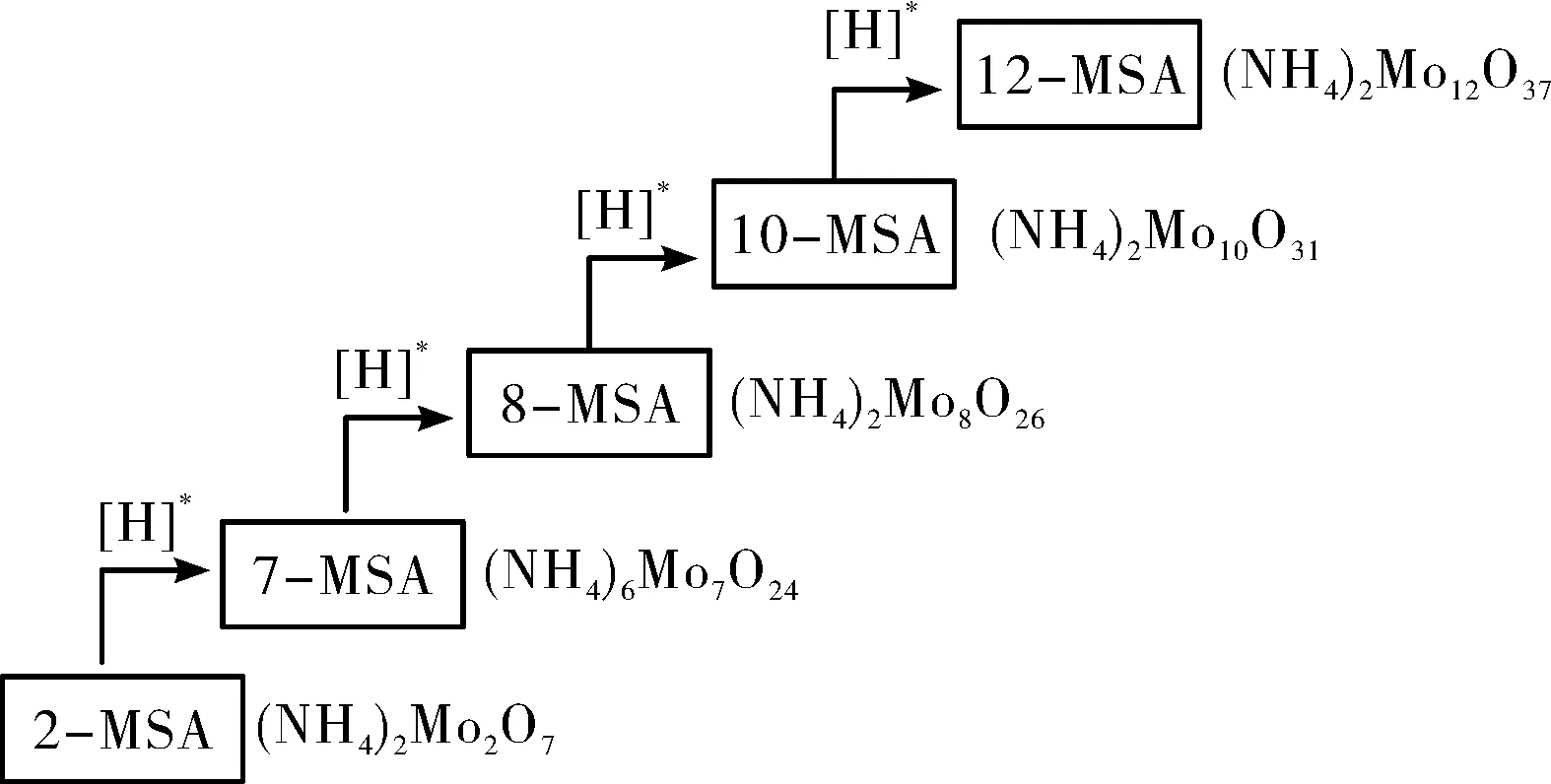
圖5 下級鉬酸銨模塊化合成上級鉬酸銨的技術路線圖(b)
2.2 模塊化拆分工藝制備系列鉬酸銨的技術路線圖
圖6、圖7是由上級鉬酸銨,逐級經由氧自由基的拆分作用,生產下級鉬酸銨的技術路線圖的不同表達形式。 對于圖6、圖7中的工藝條件,值得注意的是,熱能的物理輻射量子的作用。就像我們在模塊化合成工藝看到的那樣,模塊化拆分工藝同樣離不開加熱這一重要環節。

圖6 模塊化拆分工藝由上級拆分為下級鉬酸銨的技術路線圖(a)

圖7 模塊化拆分工藝由上級轉換為下級鉬酸銨的技術路線圖(b)
3 模塊化合成工藝及模塊化拆分工藝流程圖
3.1 模塊化合成工藝由下級轉換為上級鉬酸銨的工藝流程圖
通常,人們采用蒸發法,合成二鉬酸銨與七鉬酸銨。過程中的酸耗為零,生產成本較低,受到人們的青睞,但是,晶體結構的失效模式與分析,無計可施,束手無策。這是因為蒸發工藝的可控性失效所致,模塊化合成工藝卻截然不同。其反應物的配比精確可控。 其中包括模塊用量、酸耗用量、溫度等參數的控制,纖毫不爽。圖8給出了二鉬酸銨模塊轉換成七鉬酸銨以及十鉬酸銨模塊轉換成十二鉬酸銨的模塊化設計流程圖。表4對比了酸化工藝與模塊化合成工藝由下級轉為上級鉬酸銨的氫自由基指數、溶液pH值、鉬酸銨分子量、鉬含量等數據。由表4可見,在模塊化合成工藝中,其氫自由基指數與酸化法相比微乎其微。

圖8 模塊化合成工藝生產七鉬酸銨及十二鉬酸銨的工藝流程圖
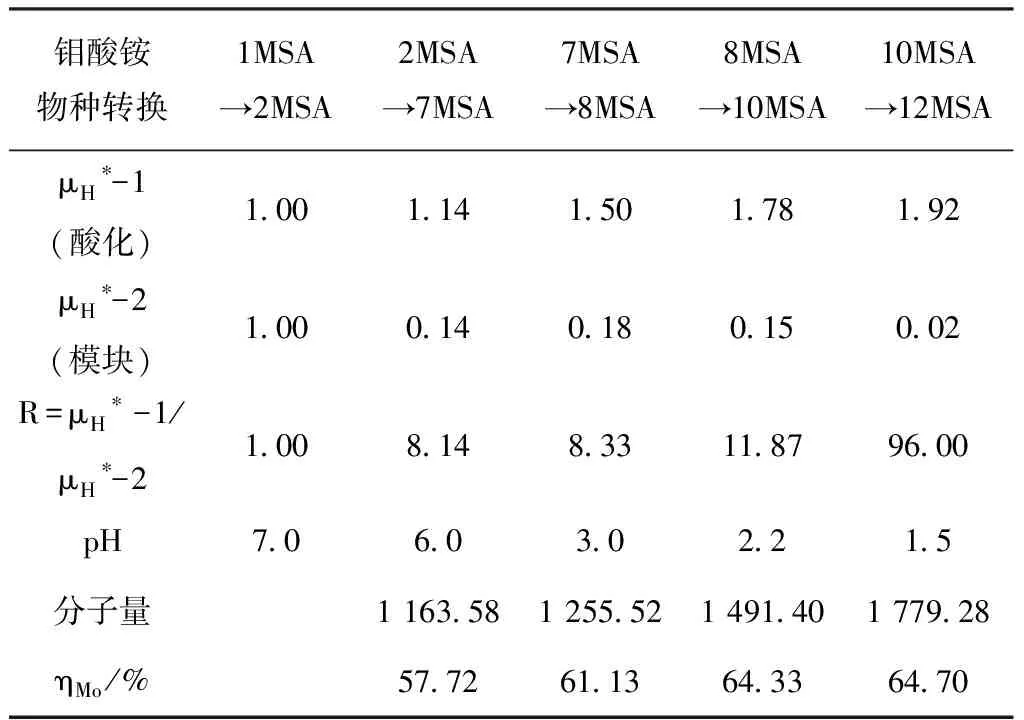
表4 模塊化合成工藝生產系列鉬酸銨的氫自由基指數
3.2 模塊化拆分工藝由上級轉換為下級鉬酸銨的工藝流程圖
圖9是模塊化拆分工藝由上級轉換為下級鉬酸銨的兩種舉例流程圖。模塊化拆分法工藝始于原料,嚴格按照溶解反應式的化學量進行精準加溫溶解。同時,要兼顧結晶工序飽和溶液的體積質量(1.50 g/cm3)控制以及緩慢攪拌、晶體表面的母液清洗與控溫干燥等作業。表5是模塊化拆分工藝控制的氧自由基指數與水合氨指數。數據表明,水合氨指數與氧自由基指數完全一致。同時表明,鉬酸銨分子式的正確表達式是XMoO3*Y(NH4)2O。

表5 模塊化拆分工藝的計量指數

圖9 模塊化拆分工藝由上級轉換為下級鉬酸銨的舉例
3.3 十鉬酸銨是鉬粉末冶金的最佳原料
文獻[8,16,20]曾經系統地研究了β型十鉬酸銨的粉末冶金性能。結果表明,β型十鉬酸銨是鉬粉末冶金的最佳原料。在系列鉬酸銨產品中,它的焙燒、還原等化學活性及所得鉬粉的燒結、壓制、拉伸等物理性能優異。因此,就粉末冶金而言,β型十鉬酸銨的模塊化組裝工藝應是研究者關注的重點之一。
采用模塊化合成工藝制備β型十鉬酸銨,可以推薦的模塊物種包括八鉬酸銨和七鉬酸銨。反應方程式(13)、(14)分別表達了模塊化合成工藝所耗用的氫自由基指數。很顯然,反應式(13)的氫自由基指數與反應式(14)比較,前者近似后者的一半(0.30/0.66=45.46%)。
(13)
(14)
4 結 論
為了實現我國鉬業強國目標,本文依據模塊化合成化學及游離基化學的原理,給出了系列鉬酸銨制備的技術路線圖及工藝流程圖,探討了模塊化合成工藝與模塊化拆分工藝中的合成反應機理。
(1)模塊化合成工藝與模塊化拆分工藝,其中包括由下級鉬酸銨、經由氫自由基的接口作用,生產上級鉬酸銨以及由上級鉬酸銨,經由氧自由基的拆分作用,生產下級鉬酸銨。兩種工藝路線圖,使鉬酸銨合成化學發生從深度到廣度、從概念到方法的深刻變化 。
(2)兩種工藝流程圖, 其中包括由下級到高級,以及由上級到下級的兩種工藝流程圖。合成工藝的備料與加熱,起步于模塊的氣態氨分子的逸出,其中涉及氫自由基化學與氧自由基化學、單電子轉移化學。因此,嚴格控制原料的化學配比至關重要。其中包括添加氫離子與添加水合氨氣等。借助酸化,酸度降低、產生氫自由基;添加水合銨,以提高堿度及供應氧自由基。
(3)本文受自由基化學理論的啟發,采用氫自由基與同多鉬酸根之間的加成作用,合成為上級鉬酸銨;采用氧自由基與同多鉬酸根之間的拆分作用,拆分成為下級鉬酸銨。這一自由基理論的假設,較好地詮釋了系列鉬酸銨制備的模塊化合成化學過程。
(4)采用模塊化合成工藝制備的β十鉬酸銨,為鉬粉末冶金的最佳鉬酸銨原料。與傳統的酸化法比較,以七鉬酸銨為前驅體的模塊化合成工藝,更加符合節能、環保、優質高效等循環經濟的要求。

