芬頓法處理含酚廢水的實驗研究
苗秀榮,李同發
(太原工業學院 環境與安全工程系,山西 太原 030008)
伴隨我國社會經濟的日益發展,各個行業都在這一過程中獲得了一定進步,但是,自古以來,發展和環境破壞就處于一個矛盾的狀態,因此,在各行各業欣欣向榮的背景下,每年所產生的廢水也越來越多,而水作為人類不可或缺的重要資源,若是受到污染,則會給人們的日常生活形成巨大影響,可以說是災難性的。特別是含酚廢水來源廣泛,且危害性大,很多工廠的日常生產工作中,都會有含酚廢水產生,進而影響到人們的日常生活,更是給植物、動物及人類的生命健康帶去威脅。所以,關于水中的含酚濃度,我國進行了明確規定。當前,對于含酚廢水中的酚類物質降解,主要采用的方法有生物法、化學法以及物理法。
H.J.H.Fenton[1]在一次蘋果酸的研究實驗中,因實驗條件的pH為酸性,在過氧化氫的存在下,將亞鐵離子加入進去后,發現會明顯加快蘋果酸的氧化速度,遂得出,在兩者存在的前提下,會有一種促進氧化的物質產生,因此,他展開了深入研究,對芬頓試劑的發明形成了促進,在后續的相關研究中,芬頓試劑運用愈加廣泛,被用來治理多種廢水,如硝基苯廢水、甘醇廢水、除草劑廢水、農藥廢水以及苯酚廢水等,所收獲的處理效率均較理想,應用前景十分廣闊。
在本次研究中,重點改變了四種影響因素,即反應時間、pH值、Fe2+、H2O2投加量,對含酚廢水模擬展開處理。然后在含酚廢水經過各種影響因素處理后對吸光度進行測定,將相應的COD去除率和含量求出,確定出反應的最佳條件。
1 實驗部分
1.1 實驗藥品
本次實驗所采用的藥品主要有如下:氯化銨(分析純)、鐵氰化鉀(分析純)、硫酸汞(分析純)、重鉻酸鉀(分析純)、硫酸銀(分析純)、4-氨基安替比林、鄰苯二甲酸氫鉀(分析純)、FeSO4·7H2O(分析純)、30% H2O2溶液、苯酚(分析純)、硫酸溶液等。
1.2 實驗儀器
本次實驗所采用的儀器主要有752型紫外可見分光光度計、YHCOD-100型COD自動消解回流儀、pH計以及78-1型磁力加熱攪拌器等。
1.3 實驗方法
將一定濃度的苯酚溶液配好之后,在250 mL錐形瓶中倒入50 mL廢水樣,加入NaOH溶液或是稀硫酸將pH調節到指定值,后將30%的H2O2和一定質量的硫酸亞鐵加入進去,在磁力加熱攪拌器上放好,經過約20 min的反應時間后,將之取下來,用消解儀進行消解,消解時間為30 min,當結束消解后,要等待消解管冷卻,溫度降到60℃為宜,這時候就需要從裝置上取下三角瓶,靜置,冷卻至室溫,取上清液在600 nm處用分光光度計測其吸光度,將COD值求出,也就是反應完后水溶液中COD的濃度,COD的去除效率采用公式計算η為:
η=(C0﹣Ce)/C0×100%
式中,η:廢水中COD的去除率,%;
C0: 廢水 COD的初始濃度,mg/L;
Ce: 處理之后的COD濃度,mg/L。
2 結果與討論
2.1 H2O2投加量對COD去除率的影響
分別取五份100 mL的含酚廢水放到250 mL的錐形瓶內,初始濃度為100 mg/L,COD為2492 mg/L,采用鹽酸將pH值調節為4,將FeSO4·7H2O 2.5 g加入后,進行不同體積的過氧化氫投加,反應1 h后,取上清液對其吸光度進行測定,結果見圖1。
從圖1中,我們能夠看出,在氧化氫投加量較低的時候,COD的去除率也不高,這便說明一定范圍內和投加量是呈正相關,去除率達到頂峰的時候為92.34%,這時候加入的氧化氫為4 mL,若仍進行投入量的加大,則不會使去除率出現變化,甚至還會有減少的情況出現。之所以如此,是由于羥基已經完全氧化分解了這時候廢水中的有機物,形成了有著穩定化學性質的溶液,因此,就算投入更多的H2O2,也不能給芬頓試劑與廢水中有機物的反應產生促進作用,并且,會因為H2O2的過量影響到COD的測量,而若投入較少的過氧化氫,這時候也不能把FeSO4·7H2O中的Fe2+完全氧化為Fe3+,產生的羥基自由基不足,也會給去除水中有機物產生影響,導致測出的吸光度偏大[2]。因此,H2O2的最佳投加量為4 mL。
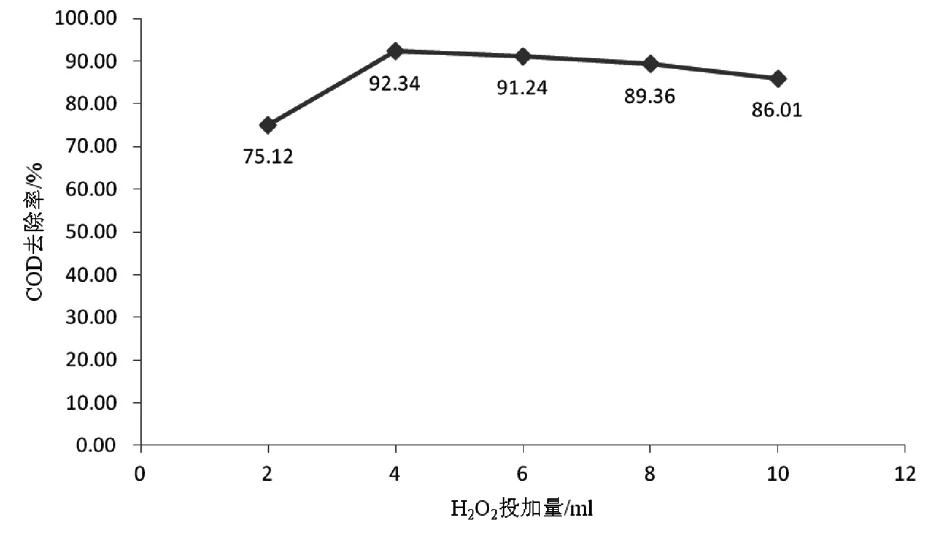
圖1 H2O2投加量對COD去除率的影響
2.2 FeSO4·7H2O投加量對COD去除率的影響
分別取五份100 mL的含酚廢水放到250 mL的錐形瓶內,初始濃度為100 mg/L,COD為2492 mg/L,使用鹽酸對pH值進行調節使之為4,將4 mL H2O2加入進去,并加入質量不同的硫酸亞鐵,反應1 h后,靜置,取上清液測其吸光度,結果見圖2。
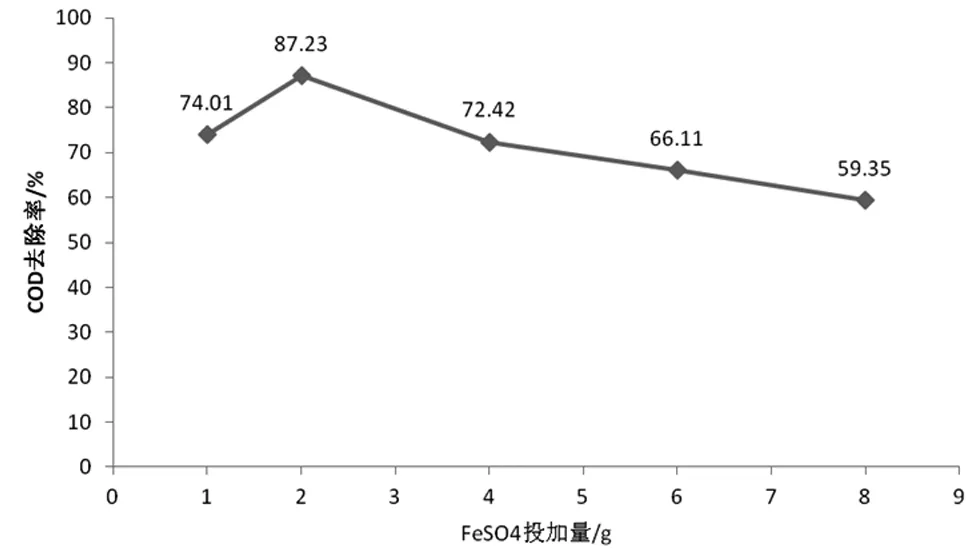
圖2 FeSO4·7H2O投加量對COD去除率的影響
從圖2中我們能夠不難發現,COD去除率達到頂峰的時候為87.23%,投加量為2 g,隨著不斷加入,持續降低著去除率,之所以如此,是因為芬頓試劑中,FeSO4·7H2O中的亞鐵離子是作為催化劑的,過多的投加量,會導致溶液中催化劑有著較高的含量,進而出現過多的·OH,但這時候水中的有機物基本已經反應完了,剩下的·OH不但無法起到任何的作用,還會出現·OH大量聚集的情況,同時,互相反應釋放出氧氣與水,給去除率形成直接影響;然而,若是投加量較少,伴隨投加量的不斷加大,COD去除率呈持續上升趨勢,這是因為開始的時候,Fe2+比較少,不會產生較多的羥基,因而去除率也就不高,隨著投加量的加大,羥基產生更多,也就提高了COD的去除率。所以,FeSO4·7H2O最佳投加量為2 g。
2.3 pH值對COD去除率的影響
分別取五份100 mL的含酚廢水放到250 mL的錐形瓶內,初始濃度為100 mg/L,COD為2492 mg/L,采用NaOH或是鹽酸對溶液進行調節,使之在2~10,然后分別加入FeSO4·7H2O 2 g,4 mL H2O2,反應1 h,取上清液對其吸光度進行測定,結果見圖3。
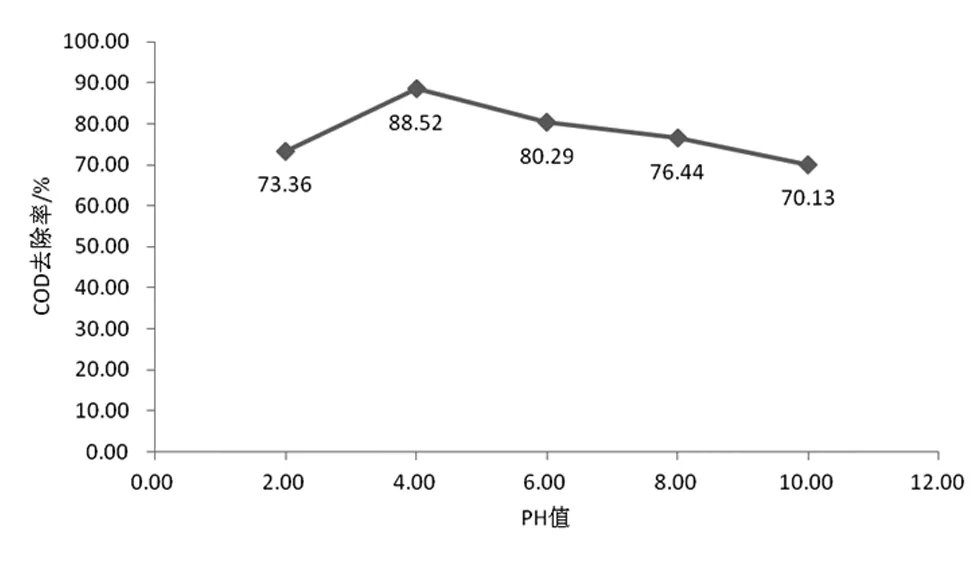
圖3 pH值對COD去除率的影響
通過分析上圖我們能夠得知,COD去除率最高的時候,pH值調節為4,在pH過低的時候(強酸性),Fe3+不易被還原為二價鐵離子,導致溶液中Fe2+不足,并且與過氧化氫所反應生產的羥基量也不夠,這就使得不能完全將水中有機物進行氧化分解,使之成為水與二氧化碳,增大了吸光度,也相應降低了COD的去除率。在一定的范圍內,去除率的增加是隨pH增大一同變化的;但是,若pH值大于4的時候,不僅不能增加去除率,還會由于過高的pH,降低H2O2的活性,給其自身的分解形成抑制,由于無法產生足夠的羥基自由基量,造成水中有較多的剩余有機物,進而增大了所測吸光度,也會相應降低COD去除率。總而言之,這項實驗的最佳pH值初步確定為4[3]。
2.4 反應時間對COD去除率的影響
分別取五份100 mL的含酚廢水放到250 mL的錐形瓶內,初始濃度為100 mg/L,COD為2492 mg/L,使用鹽酸對pH值進行調節使之為4,然后分別將FeSO4·7H2O 2 g,4 mL H2O2,加入進去,不同反應時間,取上清液測其吸光度,結果見圖4。
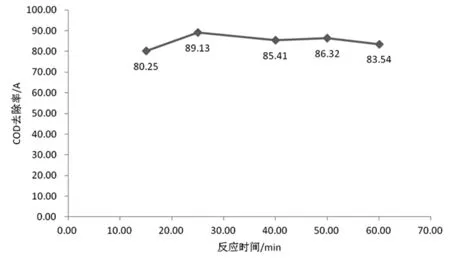
圖4 反應時間對COD去除率的影響
通過分析上圖,我們能夠發現25 min的反應時間,去除率達到峰值為89.3%,去除率伴隨時間的延長,不會減少反而會增加,但是變化范圍不大,且均比89.13%小。之所以如此,是由于去除率在剛開始的時候會跟時間的推移呈正比關系,但反應到一定程度之后,基本去除完了有機物,這時候形成的溶液有著較為穩定的性質,因此,不會再較大受時間的影響,所以,25 min為最佳的反應時間。
3 結論
通過系統實驗研究芬頓法處理含酚廢水,得出的結論有如下:
(1)25 min的反應時間,溫度為常溫,pH值為4,H2O2投加量為4 mL,FeSO4·7H2O投加量為2 g,這時候COD去除率為峰值。因此,這是芬頓法處理苯酚溶液的最佳條件。
(2)在處理含酚廢水的過程中,芬頓法的效果較為良好,并且反應條件相對簡單,經濟性較強,很容易就能夠備齊藥品。伴隨人們對環境問題的愈加重視,芬頓法將會獲得更為廣泛的運用[4]。

