海水脅迫下藜麥根系形態(tài)發(fā)育及生理響應(yīng)
梁曉艷 顧寅鈺 李萌 付嬈 張海洋 郭新兵 王向譽(yù) 郭洪恩
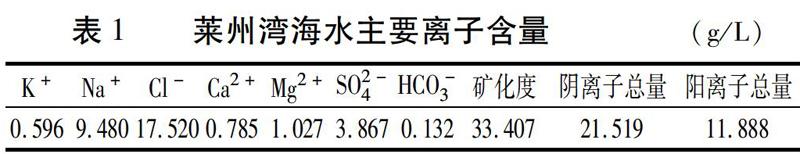
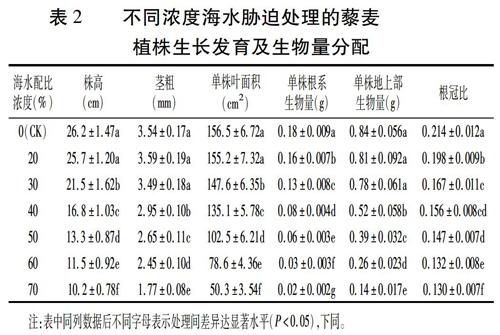

摘要:篩選和培育耐鹽植物是開(kāi)發(fā)利用濱海鹽漬土的重要途徑。本試驗(yàn)在砂培條件下,研究不同稀釋配比的海水(0、20%、30%、40%、50%、60%和70%)對(duì)藜麥植株生長(zhǎng)、根系形態(tài)結(jié)構(gòu)及生理特性的影響。結(jié)果表明:低于30%海水脅迫下,藜麥地上部生長(zhǎng)受影響較小,株高和葉面積有所降低,莖粗和地上部生物量并沒(méi)有受到顯著影響,而根系總根長(zhǎng)、最大根長(zhǎng)、根表面積、根體積、根系平均直徑及根尖數(shù)均表現(xiàn)出降低趨勢(shì);隨著海水濃度的進(jìn)一步增加,地上部和地下部生長(zhǎng)均受到不同程度的抑制,其中對(duì)地下部的抑制作用大于地上部,根冠比逐漸降低。與根系形態(tài)發(fā)育相比,藜麥根系生理活性的變化在耐鹽過(guò)程中起著更為重要的作用,根系活力隨海水濃度的增加依次升高,尤其在高濃度海水脅迫下,表現(xiàn)出較強(qiáng)的根系活力。根系超氧化物歧化酶(SOD)和過(guò)氧化物酶(POD)活性隨著海水濃度的增加先升高后降低,分別在30%和40%濃度下達(dá)到最大值;過(guò)氧化氫酶(CAT)活性呈逐漸升高的趨勢(shì);丙二醛(MDA)含量在0~40%海水濃度下較為穩(wěn)定,大于50%時(shí)顯著上升。鹽脅迫下藜麥根系滲透調(diào)節(jié)物質(zhì)含量發(fā)生顯著變化,可溶性蛋白含量隨海水濃度的增加呈先升后降趨勢(shì),40%海水濃度下達(dá)到最大值;根系脯氨酸含量呈逐漸升高的趨勢(shì)。
關(guān)鍵詞:海水脅迫;藜麥;根系形態(tài);根系生理;生理響應(yīng)
中圖分類(lèi)號(hào):S512.9 文獻(xiàn)標(biāo)識(shí)號(hào):A 文章編號(hào):1001-4942(2019)11-0028-07
Morphological Development and Physiological
Response of Quinoa Roots under Seawater Stress
Liang Xiaoyan, Gu Yinyu, Li Meng, Fu Rao, Zhang Haiyang, Guo Xinbing, Wang Xiangyu, Guo Hongen
(Sericultural Research Institute of Shandong Province, Yantai 264002, China)
Abstract Selection and cultivation of salt-tolerant plants is an important way to develop and utilize coastal saline soil. In this study, the effects of different dilution ratio of seawater (0, 20%, 30%, 40%, 50%, 60%, 70%) on the growth, morphological structure and physiological characteristics of the root system of quinoa were studied under the condition of sand culture. The results showed that under seawater stress of less than 30%, the above-ground growth of quinoa was less affected, plant height and leaf area decreased, stem diameter and above-ground biomass were not significantly affected, while the total root length, maximum root length, root surface area, root volume, average root diameter and root tip numbers showed a decreasing trend. With the further increase of seawater concentration, the growth of above-ground and under-ground parts were inhibited to varying degrees, among which,the inhibition to under-ground parts was greater than that of above-ground parts, and the root-shoot ratio decreased gradually. Compared with the development of root morphology, the change of physiological activity of quinoa root system played a more important role in salt tolerance. The root activity increased with the increase of seawater concentration, especially under high seawater stress. The activity of superoxide dismutase (SOD) and peroxidase (POD) in roots first increased and then decreased with the increase of seawater concentration, reaching the maximum value at 30% and 40% concentration, respectively. The activity of catalase (CAT) increased gradually, and the content of malondialdehyde (MDA) in roots was stable at 0 ~ 40% seawater concentration, but increased significantly when it was higher than 50%. The content of osmoregulation substance in quinoa root system changed significantly under salt stress. The content of soluble protein increased firstly and then decreased with the increase of seawater concentration and reached the maximum value under 40% seawater concentration. The content of proline in root system increased gradually.
Keywords Seawater stress; Quinoa; Root morphology; Root physiology; Physiological response
鹽漬土是地球上廣泛分布的一種土壤類(lèi)型,約占陸地總面積的25%,總計(jì)約10×108 hm2,分布在世界各大洲,主要集中在歐亞大陸、非洲和北美西部。……

