靶向藥物赫賽汀聯合化療治療晚期乳腺癌的臨床療效
董延琥 羅代平
乳腺癌是因乳房腺上皮細胞遭受致癌因子侵襲而引發的基因突變,進而造成細胞無限增殖[1]。臨床結果統計顯示,每年乳腺癌的死亡率呈逐年增加的態勢,高達45萬人[2]。近年來,研究發現,乳腺癌若能早期及時接受治療,則可以獲得相對穩定的預后;但是,大多數患者就診時已屬于癌癥晚期,失去了手術治療的時機,因此化療成為患者的首選治療方案[3]。由于化療沒有特異性,在殺死腫瘤細胞的同時會殺死機體正常細胞。分子靶向治療技術的發展彌補了化療的缺點,其通過選擇性的殺死癌細胞并減少對正常細胞的損傷。臨床上常用的靶向藥物是赫賽汀。赫賽汀屬于人源化重組DNA單克隆抗體,通過對HER2選擇性,提高HER2的附著性,進而抑制表皮因子附著HER2,達到抑制癌細胞增殖生長的目的。聯合用藥方案的提出擴展了用藥思維,研究發現赫賽汀聯合化療能提高對晚期乳腺癌患者的治療效果[4]。我院為了驗證靶向藥物赫賽汀聯合化療的治療效果進行了相關研究,現報告如下。
1 資料與方法
1.1 一般資料
選取2014年6月至2017年12月收治的62例晚期乳腺癌患者,并按隨機數字法均分為對照組(31例)和觀察組(31例)。對照組年齡46~70歲,平均年齡(58.26±7.18)歲;病程3個月~4年,平均病程(2.16±0.37)年;其中Ⅲ期20例,Ⅳ期11例。觀察組年齡45~70歲,平均年齡(58.16±7.23)歲;病程3個月~4年,平均病程(2.23±0.35)年;其中Ⅲ期19例,Ⅳ期12例。2組患者的一般資料無明顯差異(P>0.05),具有可比性。
入選標準:患者均經細胞病理學或組織學確診為晚期乳腺癌;無既往化療史,預計生存期>3個月;患者有明確的病灶評價標準;患者的心、肝、腎功能均正常。
排除標準:合并血栓史的患者;年齡>70歲的患者;不能積極配合治療的患者;卡氏評分<60分的患者;臨床資料不完整的患者。
1.2 治療方法
對照組采用化療方案治療;觀察組采用靶向藥物赫賽汀聯合化療方案治療。
化療方案:取0.1 g卡鉑與5%葡萄糖注射液混合配制成10 mg/ml的混合液,然后加入500 ml 5%的葡萄糖注射液混合均勻,300 mg/m2靜脈滴注;多西他賽注射液靜脈注射(75 mg/m2)。3周為1個療程,堅持治療4個療程。
觀察組在采用化療方案治療的基礎上聯合靶向藥物赫賽汀,首次負荷劑量為4 mg/kg,第2次和以后的劑量維持在2 mg/kg,加入250 ml 0.9%的生理鹽水中,立即進行靜脈滴注,3周靜脈滴注1次,連續滴注4次。
1.3 觀察指標
療效評價標準[5]:顯效,病灶完全消失,且不出現病灶反應;有效,病灶縮小幅度>30%,毒副作用不明顯;穩定,病灶減少不大于30%或病灶增幅<20%,毒副作用不明顯;進展,病灶惡化不小于20%,有明顯的毒副作用。有效率=顯效率+有效率。
血清炎癥因子測定:采集患者空腹血液5 ml,離心分離的上層血清備用,采用酶聯免疫吸附法檢測乳腺癌患者治療前、治療后(4個療程)血清炎癥因子白介素-2(IL-2)、白介素-6(IL-6)、白介素-10(IL-10)、腫瘤壞死因子(TNF-α)及C反應蛋白(CRP)水平,操作步驟嚴格按照試劑盒說明書,取待測標準樣品梯度稀釋,加樣,在37 ℃下培養30 min,配液稀釋20倍,洗滌,加酶,在37 ℃下培養,加入顯色劑顯色,然后測定。
采用流式細胞儀分析乳腺癌患者的T淋巴細胞表達情況,統計患者的不良反應發生率。
1.4 統計學方法
2 結果
2.1 對比2組患者的臨床療效
觀察組的臨床有效率為90.32%(28/31),明顯高于對照組臨床有效率77.42%(24/31),差異有統計學意義(χ2=2.731,P<0.05)。見表1。

表1 對比2組患者的臨床療效(例,%)
2.2 對比2組患者治療前后血清炎癥因子水平
治療前,2組患者的血清炎癥因子IL-2、IL-6、IL-10、TNF-α及CRP無明顯差異(P>0.05);治療后,2組患者的血清炎癥因子水平較治療前均明顯改善,差異有統計學意義(P<0.05)。治療后對照組和觀察組IL-2、IL-6、IL-10、TNF-α及CRP水平相比,差異均有統計學意義(P<0.05)。見表2。
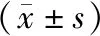
表2 對比2組患者治療前后血清炎癥因子水平
注:a為與同組治療前對比,P<0.05;b為與對照組比較,P<0.05。
2.3 對比2組患者T淋巴細胞水平
治療前,2組患者的T淋巴細胞CD3+、CD4+、CD8+及CD4+/CD8+無明顯差別(P>0.05)。治療后,對照組的CD8+及CD4+/CD8+無明顯變化;觀察組的CD3+、CD4+、CD8+及CD4+/CD8+淋巴細胞水平均明顯改善;組間對比,2組患者的CD8+及CD4+/CD8+淋巴細胞水平有明顯差異,差異有統計學意義(P<0.05)。見表3。
注:a為與同組治療前對比,P<0.05;b為與對照組比較,P<0.05。
2.4 對比2組患者治療的安全性
治療期間,觀察組出現惡心嘔吐2例,神經毒性1例,白細胞減少1例,肝功能異常1例;對照組出現白細胞減少3例,肝功能異常3例,神經毒性1例,惡心嘔吐1例。觀察組和對照組不良反應總發生率分別為16.13%(5/31)和25.81%(8/31),差異有統計學意義(χ2=1.37,P<0.05)。
3 討論
乳腺癌是女性發病率較高的惡性腫瘤,近年來,腫瘤的發病群體呈年輕化態勢,嚴重危害女性健康。晚期乳腺癌細胞擴散和遠處轉移,導致致死風險明顯提高[5-6]。腫瘤的發生發展與機體的免疫功能有密切關系,尤其是T淋巴細胞的表達狀況。T淋巴細胞有很多亞型,CD8+淋巴細胞(又稱殺手T細胞),可以殺死產生特殊抗原反應的目標細胞;CD4+淋巴細胞(又稱T輔助細胞),它可以增生擴散來激活其它類型的產生直接免疫反應的免疫細胞;CD3+淋巴細胞,它可以調節機體免疫反應。當機體遇到腫瘤細胞襲擊時,破壞免疫系統,同時影響患者炎癥因子水平[7]。炎癥因子的參與能誘導基因突變、加快腫瘤細胞增殖等,其中IL-2能有效調節機體免疫功能;IL-6含量與腫瘤血管的生成及腫瘤活性呈正相關。TNF-α是一種可以促進T細胞產生炎癥因子,進而促進炎癥反應的發生。CRP是白細胞介素6的調節下由肝臟產生并分泌的一種蛋白質[8]。
臨床上,治療晚期乳腺癌的常用方法是化療,但化療是全身性用藥,在殺死癌癥細胞的同時也會傷及正常細胞,引發對肝腎臟損傷及導致抵抗力下降等,影響患者治療的信心[9]。研究表明,在治療乳腺癌的過程中,聯合靶向藥物用藥,能有效提高患者的治療效果,如常用的靶向藥物赫賽汀,常被應用于HER2過量表達的乳腺癌的輔助治療[10]。HER2為一種原癌基因,能發揮酪氨酸激酶活性。HER2基因的無限增殖促進腫瘤細胞表面的HER2蛋白過量表達,激活腫瘤細胞下游通道活性。赫賽汀為人源化的重組抗HER2抗體,其能夠選擇性地作用于HER2的細胞外部分,阻斷HER2的信號通路,減弱細胞膜HER2蛋白濃度,加速蛋白質分解,進而抑制癌細胞的增長及誘導癌細胞凋亡,達到抗癌的效果[11]。
靶向藥物赫賽汀聯合化療,能減少對正常細胞的傷害,減輕炎癥反應,保護機體免疫能力免受化療的損傷[12]。免疫細胞能夠幫助清除隱匿的癌細胞,進一步降低患者治療后的炎性反應。炎癥反應主要與自由基的生成有關,靶向藥物的引入可減弱氧化應激反應,進一步調節炎性因子IL-2、IL-6、IL-10、TNF-α及CRP的合成,從而提高治療效果[13]。
本研究證明,觀察組的臨床療效90.32%(28/31),明顯高于對照組臨床療效77.42%(24/31)。這說明,單一的化療難以達到穩定的治療效果,且易發生轉移[14]。治療后,2組患者的血清因子均明顯改善。治療后對照組和觀察組IL-2分別為(22.19±1.79)和(26.48±1.81)ng/ml,IL-6分別為(52.18±4.7)和(37.19±4.37)μg/ml,IL-10分別為(7.47±0.82)和(11.43±1.09)ng/ml,TNF-α分別為(146.39±6.27)和(69.52±4.16)μg/ml,CRP分別為(59.23±5.19)和(26.52±3.18)mg/l。治療后,對照組的CD8+及CD4+/CD8+淋巴細胞水平無明顯變化;觀察組的CD3+、CD4+、CD8+及CD4+/CD8+淋巴細胞水平均明顯改善;組間對比,2組患者的CD8+及CD4+/CD8+淋巴細胞水平有明顯差異,這表明赫賽汀能有效控制腫瘤進展,有效減輕化療對機體的自身免疫功能的損傷,抑制炎性因子。觀察組和對照組不良反應總發生率分別為16.13%(5/31)和25.81%(8/31),差異有統計學意義(P<0.05)。
綜上所述,靶向藥物赫賽汀聯合化療治療晚期乳腺癌,能明顯提高乳腺癌的治療效果,保護患者機體免疫功能,調節患者炎性反應,值得臨床借鑒推廣。

