乳腺癌術后組織cox-2表達與其微血管生成及預后的關系
趙曉燕 謝 競 付 倩 張 蘭 霍彥平
乳腺癌是發生在女性乳腺腺上皮組織的惡性腫瘤,其發病機制復雜,無明顯表現癥狀,且隨著病情的發展進一步出現淋巴轉移等惡化癥狀,導致預后效果不佳,嚴重影響患者的健康生活[1]。目前,臨床可通過外科手術給予腫瘤組織切除,可有效控制腫瘤發展,改善患者病情,但仍有部分患者因病情惡化而出現復發轉移,其機制可能與腫瘤的血管生成有關[2]。有研究顯示,環氧合酶2(cox-2)是1種誘導基因,與腫瘤的發生發展密切相關,但有關cox-2與腫瘤的血管關系還有待進一步深入研究[3-4]。對此,本研究通過給予檢測乳腺癌術后組織cox-2表達,探討其與微血管生成及預后的關系,現報告如下。
1 資料與方法
1.1 一般資料
選取2016年3月至2017年3月本院乳腺癌術后組織及其癌旁正常乳腺組織各160例,納入標準:①經臨床癥狀、實驗室、影像學等檢查證實為乳腺癌術后[5],②就診前1個月無免疫、放化療、抗感染等治療史,③無精神病病史,④簽署知情同意書;排除標準:①妊娠及哺乳特殊人群,②血液性疾病,③有心、肝、腎等嚴重性疾病,④拒絕或終止本次研究者。其中年齡26~72歲,平均年齡(48.21±20.57)歲,體質量指數(BMI)(19.06~30.40)kg/m2,平均BMI (24.21±4.06)kg/m2,臨床分期:Ⅰ期39例,Ⅱ期51例,Ⅲ期38例,Ⅳ期32例,癌癥類型:導管癌61例,小葉癌58例,腺癌伴粉刺樣癌41例,本次研究已經我院倫理委員會審批且通過,所有數據來源真實可靠。
1.2 方法
所有患者經乳腺癌手術切除3 d后,利用常規手術切除乳腺癌術后組織及其癌旁正常乳腺組織作為新鮮標本,采用免疫組化SP法檢測組織中cox-2、微血管密度(MVD)表達;所有標本經10%甲醛固定和石蠟,包埋后,連續切片進行脫蠟,切片厚度均為4 μm,同時給予3%H2O2孵育滅活內源性過氧化物酶、封閉非特異性抗原位點等預處理,加入實驗鼠抗人cox-2作為一抗,4 ℃孵育過夜,漂洗、復溫37 ℃,加生物素標記二抗工作液37 ℃孵育30 min,PBS緩沖液漂洗、DAB顯色后用蘇木精復染3 min,進行脫水待切片透明后用中性樹膠封固,高倍顯微鏡下鏡檢,PBS替代一抗作陰性對照。
1.3 指標觀察和標準
高倍視野(×400倍)在病灶隨機選擇5個視野,應使所選視野分布于病灶各部位,cox-2陽性細胞表達及MVD表達為胞質內呈棕黃色顆粒狀,主要彌漫性分布于整個細胞胞質。根據SP法染色以細胞質中出現變異性染色的深淺進行評分,陽性強度以無色為0分;淡黃色為1分;黃色為2分;棕黃色為3分。根據組織染色細胞所占總細胞數百分比評分:陽性細胞數<5%為陰性(0分);5%~25%(1分);26%~50%(2分);51%~75%(3分);>75%(4分)。兩者評分相乘,0分為陰性(-),1~4分為弱陽性(+),5~8分為陽性(++),9~12分為強陽性(+++),方便試驗操作和分析,用(-)代表陰性,(+)(++)(+++)代表陽性,陽性代表高表達[5]。
1.4 統計學方法
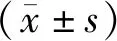
2 結果
2.1 乳腺癌術后組織及癌旁正常組織中cox-2、MVD表達比較
乳腺癌組織cox-2、MVD表達明顯高于正常乳腺組織,差異有統計學意義(P<0.05),見表1。
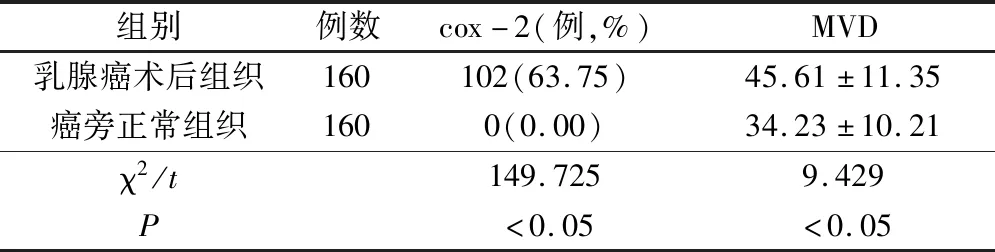
表1 乳腺癌術后組織及癌旁正常組織的cox-2、MVD表達比較
2.2 乳腺癌術后組織cox-2表達與其微血管生成及預后關系的單因素分析
單因素分析結果顯示,cox-2表達與MVD表達、臨床分期、淋巴結轉移、遠處轉移、病理分級等有關(P<0.05),見表2。
2.3 有無cox-2表達患者的生存預后比較
cox-2表達患者1年無進展生存率70.63%(113/160),明顯低于無cox-2表達患者的90.63%(145/160),差異有統計學意義(χ2=20.485,P<0.05),見圖1。
3 討論
乳腺癌是女性三大惡性腫瘤之一,隨著近年來生活節奏的加快和醫學知識的匱乏導致該發病率有明顯上升的趨勢,已成為當前社會的重大公共衛生問題。目前,乳腺癌通過手術切除術可有效切除腫瘤組織,控制癌細胞擴散,但仍有部分患者的病情復發轉移,故如何針對性確保患者術后預后轉歸具有重要的臨床意義[6-7]。
有研究顯示,乳腺癌是1種典型的血管依賴性病變,乳腺癌的發生與血管的生成密切相關,其機制可能腫瘤的存在打破血管生成促進因子上調和血管生成抑制因子下調的平衡,繼而使血管異常增生[8]。其中MVD是特定腫瘤區域的微血管計數,是臨床上腫瘤侵襲轉移潛能的預測指標[9]。同時也有研究顯示,cox-2是催化花生四烯酸轉化為前列腺素類物質過程中的一個關鍵限速酶,其應答基因迅速,當細胞受到刺激后開始合成;同時具有促進新生血管生成的作用,增加腫瘤細胞的侵襲性,其高度表達可提高腫瘤發生及轉移的潛能及增加腫瘤細胞的浸襲力[10]。
對此,本研究通過采用免疫組化SP法檢測組織中cox-2、MVD表達,結果發現乳腺癌組織cox-2、MVD表達明顯高于正常乳腺組織,而鄭玲玲等[11]的研究中也提示乳腺癌的發展與新生血管有關,進一步提示乳腺癌的發生發展與cox-2、MVD表達密切相關。這可能由于機體遭受腫瘤侵襲時,癌細胞會破壞血管的正常生成機制,從而使血管內皮細胞增殖,誘導腫瘤血管生成,繼而使MVD、cox-2高度表達。同時單因素分析結果顯示,cox-2表達與MVD表達、臨床分期、淋巴結轉移、遠處轉移、病理分級等有關,表明cox-2的表達受多種因素的影響。這有可能由于MVD的計數越高,提示機體的腫瘤新生血管增多,而cox-2則是新生血管生成的重要因素之一,故隨著腫瘤新生血管的增多,其表達越高,而姚紅等[12]的研究提示癌組織的發生發展與cox-2、MVD協同變化有關,為上述結論提供了重要的依據。而臨床分期越高的患者表明其病情越發嚴重,癌細胞快速生長且向外擴散,導致細胞質內產生缺氧環境而增加缺氧誘導因子α的合成,進一步影響腫瘤血管的生成。同時患者發生淋巴結轉移則意味著腫瘤的發育可能進入晚期,腫瘤細胞侵入血管,通過靜脈與淋巴管吻合處進入淋巴管,從而誘導新生淋巴管的形成,使cox-2高度表達。而腫瘤發生遠處轉移則提示腫瘤細胞具備向正常細胞侵襲的能力,且已新生腫瘤血管,繼而導致腫瘤增大發生轉移,從而使cox-2快速合成;而腫瘤的病理分級程度越高,其惡化程度越嚴重,繼而加劇腫瘤細胞發生轉移,腫瘤血管的大量異常增生[13-14]。從上述因素分析得出cox-2的高度表達與腫瘤的病情嚴重程度密切相關。此外,cox-2表達患者1年無進展生存率明顯低于無cox-2表達患者,表明cox-2的表達可作為乳腺癌患者的預后生存指標,這有可能由于cox-2的高度表達會加劇腫瘤細胞的增殖與分化,抑制腫瘤細胞凋亡,提高腫瘤血管的生成,加劇腫瘤發生轉移,而李鴻濤等[15]的研究結論也明確cox-2是乳腺癌組織中的預后重要因素之一,進一步提示醫師應定期檢測乳腺癌術后患者的cox-2表達,把控患者的病情發展,同時應制定對cox-2表達的患者的相關治療方案,提高患者的預后生存。
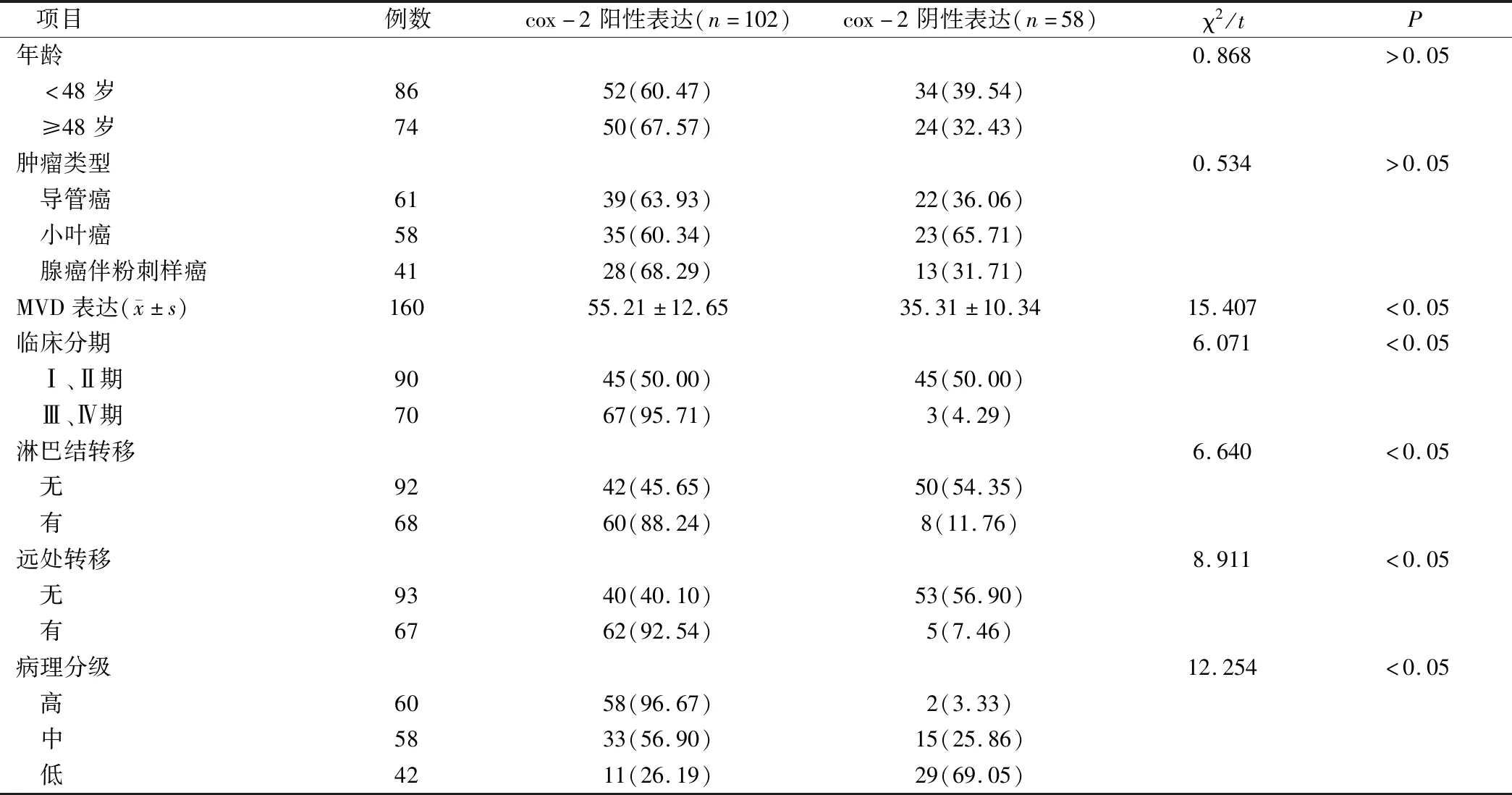
表2 乳腺癌術后組織cox-2表達與其微血管生成及預后關系的單因素分析(例,%)
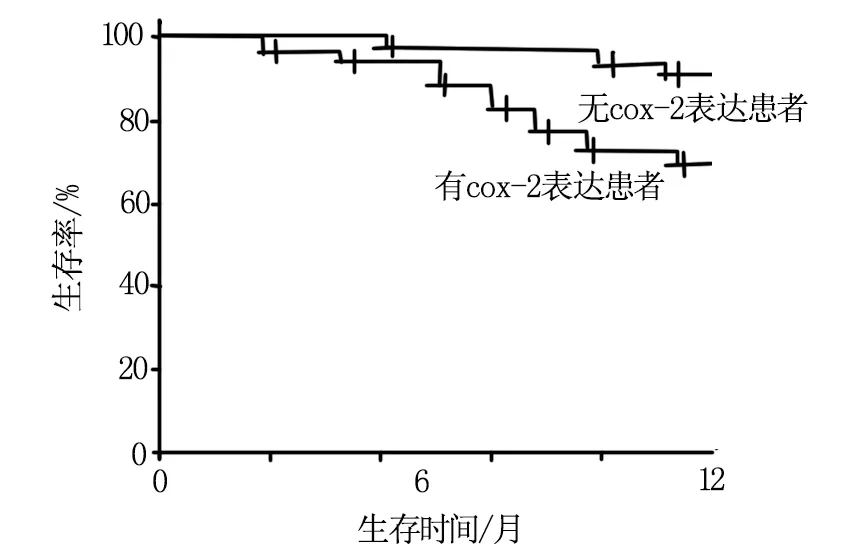
圖1 有無cox-2表達患者的生存曲線
本研究仍存在一定不足,如樣本量較少不足以代表所有案例,但乳腺癌術后組織cox-2表達與其微血管生成及預后有關,有望成為乳腺癌抗血管形成治療的重要生物靶點,同時檢測cox-2表達對評估患者微血管生成及預后具有重要的價值。

