耐熱蛋白酶產生菌的篩選鑒定及其酶學性質研究
桑 鵬, 王肇衿, 陳貴元, 楊力權
(1.大理大學農學與生物科學學院,云南大理671003;2.大理大學基礎醫學院,云南大理671000;3.云南省昆蟲生物醫藥研發重點實驗室,云南大理671000)
蛋白酶在科學研究和工業生產等方面應用廣泛(唐兵等,2000),其主要產自微生物,但在高溫、強酸、強堿、多金屬離子等條件下酶的催化活性并不好,常有失活情況發生(林影等,2000)。 高溫蛋白酶的應用前景十分廣闊(廉立慧等,2011),但國內對高溫蛋白酶產生菌的研究相對較晚, 對高溫蛋白酶催化活性方面的研究還鮮有報道。 本研究以云南大理彌渡縣熱泉土樣為材料, 篩選出產高溫蛋白酶的菌株, 對其分類鑒定并對其酶學性質進行研究, 旨在為發酵工業新備選產蛋白酶菌株的開發應用提供資源, 為進一步開發利用該菌株提供基礎, 也為進一步獲得產蛋白酶基因的研究奠定基礎。
1 材料和方法
1.1 試驗材料
1.1.1 土壤樣品 土壤樣品來自大理彌渡縣白總旗熱泉的底泥,熱泉水溫55 ℃。
1.1.2 主要儀器 顯微鏡(奧林巴斯);紫外可見光分光光度計(上海菁華儀器公司);高速冷凍離心機(上海安亭科學儀器公司);恒溫培養箱(上海一恒科學儀器有限公司);水浴恒溫搖床(常州國華電器有限公司);高壓蒸汽滅菌鍋(上海博迅醫療生物儀器股份有限公司);超凈工作臺(蘇州凈化設備有限公司);PCR 擴增儀(美國ABI);電泳儀(北京六一生物科技有限公司)。
1.1.3 試劑 酵母抽提物、蛋白胨為英國進口;瓊脂粉為西班牙進口分裝;脫脂奶粉、三氯乙酸、folin試劑、濃鹽酸、干酪素、氯化鈉、結晶紫、碘、乙醇、孔雀綠、番紅等均為國產分析純試劑。DNA 抽提試劑盒、PCR 擴增試劑盒、 膠回收試劑盒和DNA 分子量標準品均購自北京天根生物技術有限公司。
1.1.4 培養基 脫脂奶粉培養基:脫脂奶粉50 g,水500 mL,瓊脂粉10 g,100 ℃滅菌20 min。
LB 液體培養基:胰蛋白胨10 g,酵母浸出物5 g,NaCl 10 g, 超純水1000 mL, 調pH 至7.2,121 ℃滅菌20 min。
發酵產酶培養基:豆粕20 g,葡萄糖1 g,蒸餾水200 mL,121 ℃滅菌20 min。
1.2 試驗方法
1.2.1 菌株富集 稱取白總旗熱泉底泥2 g 于45 mL 的無菌蒸餾水中,150 r/min,振蕩15 min。在無菌條件下, 用移液槍吸取5 mL 懸液于50 mL 的富集培養基中,將接種好的富集培養基置于55 ℃,轉速為150 r/min 的水浴恒溫振蕩培養箱中振蕩培養24 h。
1.2.2 菌株初篩 將富集好的菌液稀釋至10-3、10-6、10-9倍, 用移液槍分別吸取稀釋的菌液150 μL接種在篩選培養基平板上,涂布均勻。 于37 ℃倒置培養24 h。 觀察菌落周圍若有水解圈出現,說明該菌株能產生蛋白酶。
1.2.3 菌株復篩 將初篩得到的菌株取少量接種于種子瓶(LB 液體培養基),55 ℃培養24 h 后,將種子液按2%的接種量接入到發酵培養基,55 ℃、150 r/min 水浴搖床培養一周。 離心取上清測酶活。
酶活測定:采用福林法(Folin)進行酶活測定(高英等,2004)。 在一定的pH 和溫度下,蛋白酶液和底物酪蛋白反應,經一定時間后,加入三氯乙酸終止酶反應, 并使多余的酪蛋白發生沉淀而與水解產物分開。 過濾后,取濾液(含蛋白水解產物的三氯乙酸液)用Na2CO3堿化,再加入Folin 試劑使之發色, 藍色強度與蛋白質水解產物的量成正比, 在一定濃度范圍內符合朗白-比爾定律,因此,可推測蛋白酶活性。
酶活力定義:在酶最適反應溫度條件下,每分鐘水解酪蛋白產生1 μg 酪氨酸為一個酶活單位。
酶活力/(μg/mL)= K×OD×N×4/10;
式中:K 為標準曲線斜率的倒數;N 為酶的稀釋倍數。
1.2.4 菌株鑒定
1.2.4.1 形態學、 生理生化特征 產酶菌株的形態觀察及生理生化實驗參照黃秀梨等(2008)的方法進行。
1.2.4.2 16S rRNA 基因序列測序和分析 根據北京天根生化科技有限公司提供的試劑盒以及說明書進行DNA 的提取。 使用通用引物27F:5,-AGAGTTTGATCCTGGCTCAG-3, 和1492R:5,-GGTTACCTTGTTACGACTT-3, 擴增細菌16S rD NA。擴增條件為:預變性94 ℃,5 min;變性94 ℃,30 s;退火50 ℃,45 s;延伸72 ℃,100 s,最后延伸72 ℃,5 min,循環30 次,將PCR 產物加入預先制備好的0.8%的瓊脂糖凝膠中,140V,電泳1 h,瓊脂糖凝膠回收根據北京天根生化科技有限公司提供的試劑盒以及說明書進行PCR 產物回收。 將PCR 回收產物送廣州英濰捷基(上海)貿易有限公司測序,將獲得的序列提交GenBank (http: / /www. ncbi. nlm. nih. gov), 根據BLAST 數據庫中細菌16S rRNA 基因序列進行相似性比較分析,利用MEGA 5.0 軟件進行系統進化分析。
1.2.5 菌株最適生長溫度 按接種量為1%的菌種于LB 液體培養基中,置于不同的溫度(25、31、37、43、49、55 ℃) 下搖床培養24 h, 然后在波長600 nm 處測定各個溫度下菌株生長的吸光值,以確定菌株的最適生長溫度。
1.2.6 酶學性質
1.2.6.1 溫度對酶活的影響 將酶液分別在4 ~75 ℃條件下測定蛋白酶的活力。
1.2.6.2 pH 對酶活的影響 在最適酶活溫度下,配制不同pH 的反應緩沖液,檢測不同的pH 對蛋白酶活力的影響。
1.2.6.3 酶的熱穩定性 將1 mL 酶液分別置于不同的溫度(4、37、55、60、75 ℃)下保溫,在保溫15、30、60、90 min 時測定酶活。以保溫0 min 溫度下所測得的酶活為對照組, 其余溫度下所測得的酶活與其相比,并計算相對酶活,用相對酶活繪制出酶的熱穩定性曲線。
1.2.6.4 金屬離子對酶活的影響 將1 mL 的酶液和10 μL 濃度為0.1 mol/L 的金屬離子(Ca2+、Fe2+、Mn2+、Cu2+、Zn2+、Mg2+、K+)混勻,將其放置到4 ℃冰箱過夜,第二天測定各組酶活力。以未加入金屬離子的酶液反應體系作為對照組, 測定和觀察金屬離子對酶活力的影響。
2 結果與分析
2.1 產酶菌株的篩選 根據水解圈直徑與菌落直徑比值的大小。篩選到3 株產高溫蛋白酶菌株。其中1 號菌株水解圈直徑與菌落直徑比值(R1/R2)最大。 經復篩發現3 株菌均為分泌型蛋白酶產生菌,且1 號菌株酶活最高,為49.99 U/mL,與初篩的結果相符。因此,選擇1 號菌株作為后續試驗研究菌株,命名為Pro-55。
2.2 菌種鑒定
2.2.1 形態學、 生理生化特征 Pro-55 在LB 培養基上37 ℃培養72 h 后, 菌落形態呈圓形,黃色,不透明,黏稠,光滑,表面濕潤,中間隆起,邊緣整齊, 菌落整體較小未產菌絲。 革蘭氏染色呈陽性,端生芽孢,鞭毛染色后未觀察到鞭毛。
對Pro-55 的生理生化特性進行研究發現,V-P 試驗、甲基紅試驗、蔗糖發酵試驗結果均為弱陽性。明膠試驗、吲哚試驗、乳糖發酵試驗、葡萄糖發酵試驗結果均為陰性。
2.2.2 16S rRNA 基因序列及系統發育分析 16S rRNA 基因測序, 所獲得的序列長度為1438 bp,將Pro-55 的16S rRNA 基因序列與GenBank 數據庫中的序列進行同源性比對,發現Pro-55 與短芽孢桿菌屬的16S rRNA 基因序列自然聚類,Pro-55 的16S rRNA 基因序列與16 條相似性較高的序列構建系統發育樹見圖1, 從圖中可以看出 Pro -55 與 Brevibacillus sp. FJAT -21992(KP728965.1)菌株聚為一群,相似性也最高,表明Pro-55 與Brevibacillus sp.的菌株親緣關系最近。
根據Pro-55 的形態及生理生化特征, 結合《伯杰氏細菌鑒定手冊》(第八版)(布坎南,1984),以及Pro-55 16S rRNA 基因序列及系統發育樹,將Pro-55 初步鑒定為短芽孢桿菌屬(Brevibacillus sp.) 的一株菌, 命名為Brevibacillus sp.Pro-55。
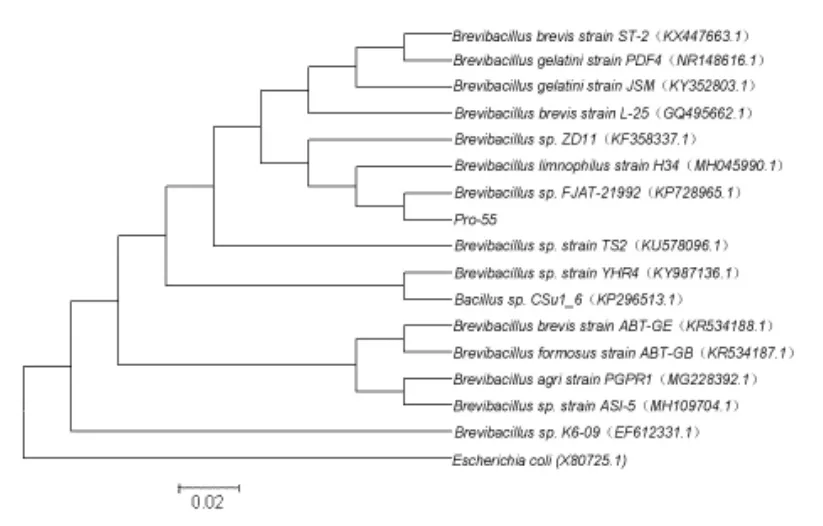
圖1 基于16S rRNA 基因序列相似性的菌株Pro-55 與16 株細菌的系統進化樹
2.3 菌種的最適生長溫度 按照試驗方法,在波長600 nm 處測定不同溫度培養下LB 培養基的吸光值,以600 nm 處的吸光值為縱坐標,溫度為橫坐標作溫度—吸光值關系曲線,結果如圖2。
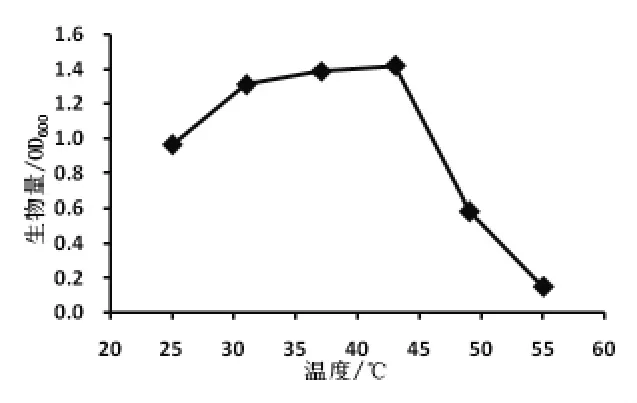
圖2 Pro-55 菌株生長曲線
從圖2 可知,25 ~43 ℃菌株的生長量隨著溫度的升高而增加,43 ℃時,LB 培養基在600 nm下的吸光值最高,表明43 ℃是菌株的最適生長溫度。 45 ℃以后,菌株生長量隨著溫度的升高而下降,菌株在55 ℃下仍能生長,表明菌株屬于典型的耐高溫菌。
2.4 菌株Pro-55 的蛋白酶性質
2.4.1 對硝基苯酚標準曲線 根據制作對硝基苯酚標準曲線的方法, 得出對硝基苯酚標準曲線線性回歸方程為y=0.6743x-0.0634, 線性相關系數R2=0.9924,表明線性比較好。
2.4.2 溫度對酶活的影響 按照試驗方法, 在不同溫度下測定酶的活性,以酶活力為縱坐標,溫度為橫坐標作溫度—酶活關系曲線(圖3)。

圖3 溫度對Pro-55 蛋白酶活性的影響
從圖3 可以看出,低溫能抑制酶的活性,但不能使酶失活, 在4 ℃的條件下, 蛋白酶仍具有活性,但活性較低,4 ~40 ℃,隨著溫度升高,酶活力增加,在40 ℃時,酶活力達到最大值,為50 U/mL。在40 ℃之后,隨著溫度升高,蛋白酶活力反而降低,部分酶失去活性。 40 ℃是蛋白酶的最適反應溫度,該菌株產生的蛋白酶屬于典型的耐熱蛋白酶。
2.4.3 蛋白酶的最適反應pH 從圖4 可以看出,pH 6.0 之前,蛋白酶活力隨著pH 的增加而升高,在pH 6.0 之后, 蛋白酶活力下降速度較快。 pH 6.0 是該蛋白酶的最適反應pH,表明菌株Pro-55產生的蛋白酶屬于酸性蛋白酶。

圖4 pH 對Pro-55 蛋白酶活性的影響
2.4.4 蛋白酶熱穩定性 按照試驗方法, 測定其各個溫度下不同時間點蛋白酶的酶活,以保溫0 min測得的酶活為對照組, 其余溫度下所測得的酶活與其相比并計算相對酶活, 用相對酶活繪制出酶的熱穩定性曲線,結果如圖5 所示。
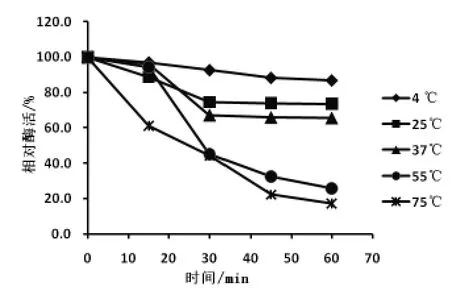
圖5 Pro-55 蛋白酶的熱穩定性
從圖5 可以看出,在37 ℃以下,Pro-55 蛋白酶能夠在長時間內保持相對穩定的酶活。在75 ℃保溫60 min,相對酶活損失近83%。 菌株產生的酶雖然是高溫蛋白酶,但酶在較高的溫度下,酶活性隨著保溫的時間增加而降低, 酶的熱穩定性較差,溫度耐受性質符合一般酶的性質。
2.4.5 金屬離子對酶活力的影響 將加有金屬離子的稀釋酶液在4 ℃中保溫過夜, 以未加入金屬離子的酶液作為對照組, 測定各種金屬離子對酶活力的影響,結果見表1。

表1 金屬離子對Pro-55 蛋白酶活的影響%
從表1 可知,Cu2+對酶活性有較大促進作用,Mg2+、Ca2+有較弱促進效果,而Fe2+、K+和Mn2+則有抑制效果,推斷可能不是單一的酶類,有輔酶;說明酶液有較強的離子耐受能力。
3 結論
高溫蛋白酶是一類廣泛應用于醫藥、食品、日用化工等方面且有著巨大開發潛力的酶, 在微生物體內廣泛存在 (徐輝艷等,2009; 胡青平等,2005)。 本次試驗得到的菌株經分子鑒定為短芽孢桿菌;其最適生長溫度為43 ℃,酶反應最適溫度40 ℃,酶反應最適pH 為6.0,在最適反應溫度下酶活力為36.74 μg/mL; 在37 ℃以下酶具有較好的熱穩定性。 Ca2+、Zn+、Mg2+、Cu2+等離子對酶液的酶活性均有促進作用, 同時酶液具有很強的離子耐受力。本文所篩選菌株在55 ℃高溫下依然具有較強的酶活力,且溫度耐受性較強。 綜上所述,此次試驗得到的酶在重金屬高溫環境下的應用前景非常廣闊, 且在其他的科研與工業生產中的應用也有待研究。

