堅果殼色素的提取和抗氧化作用研究
李利紅 , 李 凱, 李先芳, 趙建平, 趙月
(1.河南牧業經濟學院制藥工程學院,河南鄭州450046;2.河南省畜牧總站,河南鄭州450011)
堅果殼如板栗殼、 核桃殼等來源于農產品和食品廢棄物,價格低廉,堅果殼提取物以天然色素為主,大都屬于多酚類化合物,性質穩定,具有較好的清除自由基和維護心血管系統健康的能力,同時還有抑菌活性。因此,深入研究開發堅果殼提取物作為新型綠色飼料添加劑, 在畜牧養殖中具有廣闊的發展前景。
本試驗旨在通過比較研究不同提取工藝下核桃殼和板栗殼提取物的得率、主要成分含量、清除DPPH 自由基的能力,選取較優者,研究其對酒精造成的小鼠肝損傷的保護作用, 以期為后期開發具有促生長和應激保護作用的堅果殼提取物飼料添加劑提供借鑒。
1 材料與方法
1.1 材料 核桃和板栗均購自農貿市場,剝肉取殼備用。
1.2 儀器與試劑
1.2.1 儀器 超聲波清洗儀(KQ3200E 型,昆山市超聲儀器有限公司); 旋轉蒸發儀 (R-1001-VN, 鄭州長城科工貿有限公司); 臺式離心機(X1R,Thermo);紫外分光光度計(Y1702,上海菁華科技儀器有限公司); 萬分之一天平(BT125D,賽多利斯);電子天平(BSA224S-CW,賽多利斯科學儀器有限公司);立式高壓滅菌鍋(LDZM-60K,上海審安醫療器械廠);超凈工作臺(JH-SCB,上海鴻都電子科技有限公司); 生化培養箱 (SPX-300BSH-, 上海新苗醫療器械制造有限公司);臺式冷凍恒溫振蕩器(THZ-Q,太倉市華美生化儀器廠);Varioskan 多功能酶標儀 (Thermo);H.H.S 電熱恒溫水浴鍋(上海醫療器械五廠);快速混勻器(XK96-B,姜堰市新康醫療器械有限公司)等。
1.2.2 試劑 乙醇、氫氧化鈉、沒食子酸(薩恩化學技術(上海)有限公司)、冰乙酸和無水乙醇等均為分析純。 蘆丁標準品(中國食品藥品檢定研究所,純度98%)。DPPH 自由基粉末(SIGMA);維生素C 片(華中藥業股份有限公司)。 谷胱甘肽過氧化物酶(GSH-Px)測試盒(20180309,南京建成生物工程研究所,其他同);過氧化氫酶(CAT)測試盒(20180312);總超氧化物歧化酶(T-SOD)測試盒(20180425); 丙 二 醛 (MDA) 測 試 盒(20180426);蛋白質定量測試盒(20180421);雙蒸水等。
1.2.3 試驗動物 無特定病原體的雄性老年KM小鼠,體重為20 ~35 g,由河南牧業經濟學院藥理實驗室提供。
1.3 方法
1.3.1 殼色素提取 通過超聲輔助堿法工藝條件(10 倍量pH 9 的堿水,35 ℃超聲提取30 min) 和超聲輔助乙醇法提取工藝(8 倍量30%乙醇,25 ℃超聲提取40 min) 進行殼色素的提取。 提取物干燥,稱重(m,g)。

1.3.2 提取物主要成分含量測定 總酚含量根據2010 版《藥典》中福林-酚法測定;總黃酮含量用NaNO2-Al(NO3)3比色法測定(汪秀妹,2013)。
1.3.3 體外抗氧化活性的測定
1.3.3.1 DPPH 自由基溶液的配制 根據余蘭斌(2016) 方法進行體外抗氧化活性的測定。 稱取DPPH 自由基粉末, 用無水乙醇溶解配制成濃度為0.2 mmol/L,避光保存,作為母液。 將母液稀釋為0.05 mmol/L,將此濃度作為DPPH 自由基溶液的初始濃度。
1.3.3.2 樣品母液的配制 稱取0.5 g 殼提取物,置于250 mL 錐形瓶中, 量取200 mL 蒸餾水加入,使其溶解并作為樣品母液。
1.3.3.3 樣品溶液的配制 取DPPH 溶液2.0 mL,緩慢加入少量樣品母液,邊加邊搖勻,觀察溶液顏色的變化,當顏色基本褪去時,記下樣品的用量,即為樣品的最大用量。在不超過此最大量的基礎上,設置不同的稀釋濃度梯度,最少5 個梯度,即為樣品溶液。
1.3.3.4 DPPH 自由基清除試驗 2.0 mL 不同濃度的樣品及2.0 mL DPPH 自由基 (初始濃度)的混合液作為樣品組,加入5 mL 離心管中,搖勻,室溫下密閉靜置20 min, 于517 nm 波長下用多功能酶標儀測定吸光值,記為A 樣品,以2.0 mL溶劑和2.0 mL 自由基混合液作為對照組,測得吸光度值為A對照,以2 mL 樣品和2 mL 無水乙醇混合液作空白組,測得吸光值為A空白。以Vc 為陽性對照。

按照袁亞男(2009)方法,計算IC50(即自由基清除率為50%時的濃度)。
1.3.4 體內抗氧化活性測定
1.3.4.1 試驗動物及飼養管理 選取100 只無特定病原體的雄性老年小鼠,按照體重均衡將其隨機分成5 組(蒸餾水組,Vc 組, 三個提取物添加組),每組20 只。 參考李曉明(2012)方法,其中提取物添加組按照低劑量(4.0 mg/mL),中劑量(8.0 mg/mL),高劑量(16.0 mg/mL)灌胃,Vc 組參照提取物的中濃度劑量灌胃,各組均飼喂基礎飼料,讓其自由飲水,所有組每天定時經口灌胃1 次。灌胃劑量為0.1 mL/10 g。 連續灌胃21 d。
1.3.4.2 小鼠急性酒精性肝損傷模型的建立 將每組小鼠再分成兩部分(酒精組和對照組),酒精組按照體重以0.1 mL/10 g 的量灌服62.5%的酒精(儲蘭蘭,2017),對照組不灌服酒精,照常喂養。灌胃后禁食不禁水6 h。
1.3.4.3 肝勻漿的制備及蛋白質含量的測定 灌服酒精6 h 后,處死小鼠并迅速取出肝臟,按照總超氧化物歧化酶測試盒說明書上的方法操作,制備10%的肝組織勻漿,并按照說明書上操作用酶標儀測定吸光度值。 被測樣品的蛋白質濃度計算公式如下:
待測樣本蛋白質濃度/(g prot/L)=(測定OD值-空白OD 值)/(標準OD 值-空白OD 值)×標準品濃度(0.563 g/L)×樣本測定前稀釋倍數。
1.3.4.4 肝組織中酶活力和丙二醛含量的測定按照各試劑盒說明書上的方法操作, 計算GSHPx、CAT、T-SOD 活力和MDA 含量。
組織GSH-Px 活力/(U/mg prot)=(非酶管OD值-酶管OD 值)/(標準管OD 值-空白管OD 值)×標準管濃度×稀釋倍數/反應時間/取樣量×樣本蛋白質含量);
組織勻漿中CAT 活力/(U/mg prot)=(對照OD 值-測定OD 值)×271×1/(60×取樣量)×待測樣本蛋白質濃度/(mg prot/mL);
式中:271 為斜率的倒數。
T-SOD 活力/(U/mg prot)=(對照OD 值-測定OD 值)/對照OD 值/50%×反應液總體積(mL)/取樣量(mL)/待測樣本蛋白質濃度(mg prot/mL);
組織中MDA 含量/(nmol/mg prot)=(測定OD值-對照OD 值)/(標準OD 值-空白OD 值)×標準品濃度(10 nmol/mL)/待測樣本蛋白質濃度(mgprot/mL)。
1.4 數據處理 試驗數據用Excel 軟件進行處理。
2 結果與分析
2.1 提取方法及含量測定結果 由表1 可知,本試驗中超聲輔助堿法(pH=9)下核桃殼和板栗殼色素的提取得率分別為6.15%、6.52%, 超聲輔助醇(30%)法下核桃殼和板栗殼色素的提取得率分別為5.56%、5.66%; 兩種殼色素均以堿法提取得率高;無論堿法還是醇法,均以板栗殼色素的提取得率高于核桃殼色素得率。
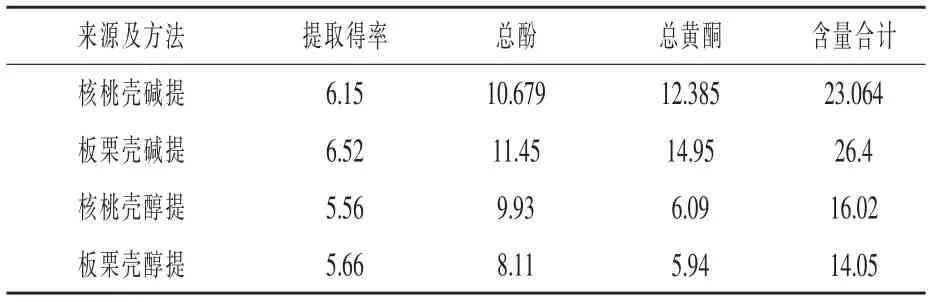
表1 板栗殼和核桃殼色素提取結果比較%
殼色素中的總酚和總黃酮含量均以堿法高于醇法。 堿提法核桃殼色素的總酚和總黃酮含量分別為10.679%和12.385%; 醇提法核桃殼色素的總酚和總黃酮含量分別為9.93%和6.09%; 堿提法板栗殼總酚和總黃酮含量分別為11.45%和14.95%,醇提法板栗殼色素的總酚和總黃酮含量分別為8.11%和5.94%。
2.2 DPPH 清除試驗結果 兩種殼色素對DPPH自由基的清除率結果見表2 和表3。
經計算, 本試驗核桃殼堿提色素的IC50 為23.6 μg/mL。 醇提色素的IC50 為159.156 μg/mL。板栗殼醇提色素的IC50 為1.482 mg/mL, 堿提色素的IC50 為2.2583 mg/mL。
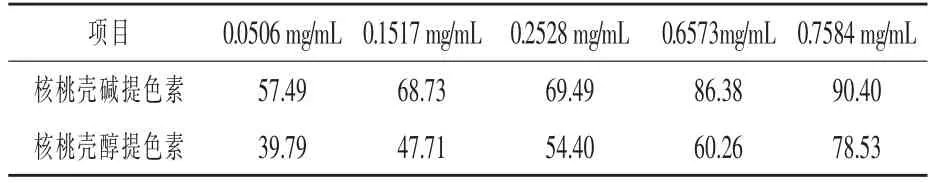
表2 不同濃度的核桃殼色素對DPPH 自由基的清除率%

表3 不同濃度的板栗殼色素對DPPH 自由基的清除率%
雖然板栗殼提取得率高,主成分含量高,但是清除DPPH 自由基的能力不如核桃殼。 核桃殼堿提物清除DPPH 自由基的能力高于醇提物。
綜合比較核桃殼和板栗殼色素的提取得率和體外清除DPPH 自由基的能力, 擇優選取核桃殼堿提物進行體內抗氧化活性研究。
2.3 核桃殼色素對小鼠肝損傷的保護作用
2.3.1 核桃殼提取物對GSH-Px 活力的影響對10%肝組織勻漿的GSH-Px 活力的測定結果見表4。
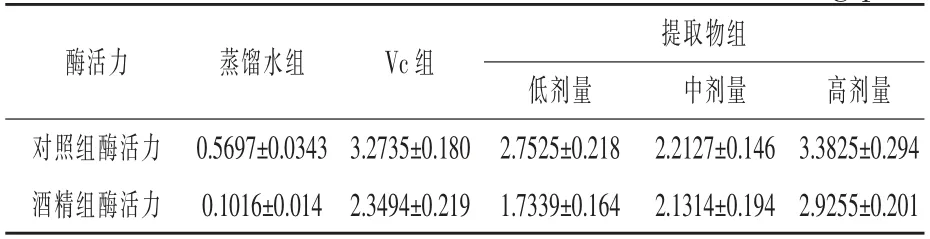
表4 小鼠肝臟中GSH-Px 活力測定結果U/mg prot
由表4 可看出, 未添加藥物的蒸餾水組小鼠在酒精影響下, 肝臟中谷胱甘肽過氧化物酶的活力為0.1016 U/mg prot, 僅為對照組酶活力(0.5697 U/mg prot)的20%。因此,酒精造成了小鼠肝損傷,谷胱甘肽過氧化物酶活力急速下降。
添加Vc 和核桃殼提取物顯著提高了小鼠肝組織的谷胱甘肽過氧化物酶活力; 降低了酒精對于小鼠肝臟酶活力的傷害。 核桃殼提取物高劑量組的酶活力高于Vc 組。
2.3.2 核桃殼提取物對小鼠CAT 活力的影響對10%肝組織勻漿CAT 活力的測定結果見表5。
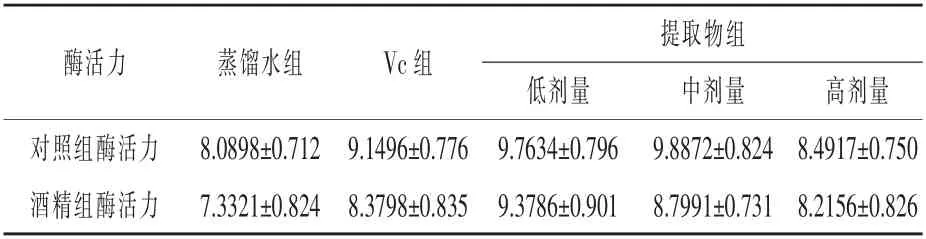
表5 小鼠肝臟中CAT 活力測定結果U/mg prot
根據表5 可以看出, 酒精處理降低了小鼠肝臟中過氧化氫酶的活力。Vc 和核桃殼色素提高了小鼠肝臟中過氧化氫酶活力,隨著濃度的增加,核桃殼色素對過氧化氫酶活力的提高作用逐漸下降,高劑量下的酶活力最低,但仍比蒸餾水組高。核桃殼提取物低劑量和中劑量提高過氧化氫酶活力的效果比Vc 強, 而高劑量核桃殼提取物的作用不如Vc。
2.3.3 核桃殼提取物對小鼠T-SOD 活力的影響對10%肝組織勻漿超氧化物歧化酶活力的測定結果見表6。
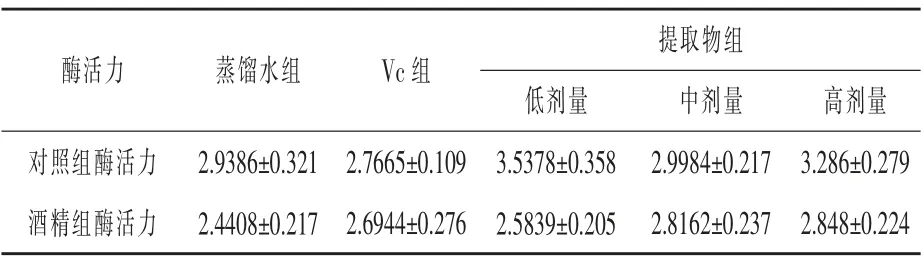
表6 小鼠肝臟中T-SOD 活力測定結果U/mg prot
由表6 可看出, 酒精處理造成了小鼠肝臟超氧化物歧化酶的活力下降,Vc 對小鼠肝臟超氧化物歧化酶的活力提高無效果, 但是仍然保護了酒精處理下的酶活力; 高劑量和低劑量色素提取物對小鼠肝臟超氧化物歧化酶的活力提高作用明顯, 中劑量提取物雖然對酶活力的提高效果不明顯, 但是對小鼠肝臟在酒精作用下酶活力降低的保護作用明顯。
2.3.4 核桃殼提取物對小鼠MDA 含量的影響對10%肝組織勻漿MDA 含量的測定結果見表7。
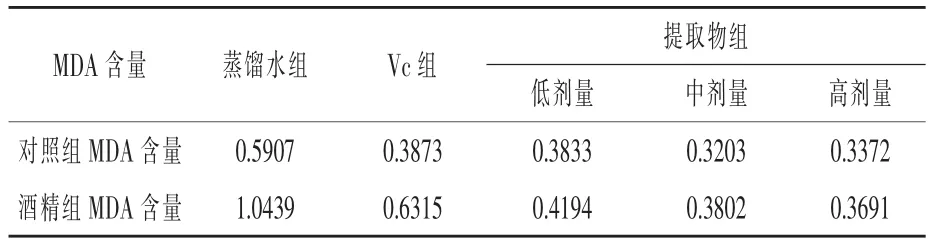
表7 小鼠肝臟中MDA 含量的測定結果nmol/mg prot
根據表7 可知, 酒精處理造成了小鼠肝臟中MDA 含量增加。 Vc 和核桃殼提取物均降低了小鼠肝臟中的MDA 含量, 減少了酒精處理下MDA 含量的增加,保護了酒精處理下小鼠肝臟細胞的損傷。 高、中、低劑量組的MDA 含量均低于Vc 組,即保護作用均大于Vc 組。
3 結論與討論
從提取方法而言, 兩種殼堿提法的得率和主成分含量高于醇提法。 因此, 選擇堿提為主要方法。 板栗殼色素的總酚和黃酮含量與提取得率均稍高于核桃殼色素得率, 但是清除DPPH 自由基的能力不如核桃殼,綜合考慮成本,認為核桃殼色素更適于開發具有抗氧化作用的飼料添加劑。
乙醇濃度會影響堅果殼色素的抗氧化活性。本試驗中板栗殼醇提物清除DPPH 自由基的能力高于堿提物。 戚建華等(2012)通過70%乙醇和pH 11 的氨水分別提取板栗殼色素,結果表明,醇法提取所得色素不如堿法提取所得色素的DPPH自由基清除能力強。 李莉(2011)研究表明,用1%氫氧化鈉溶液和40%乙醇溶液分別提取板栗殼棕色素, 其清除DPPH 自由基能力由高到低依次是: 維生素C、 板栗殼醇提物、 板栗殼堿提物、BHT。 由于70%乙醇提取物的極性略小于40%乙醇提取物,因此認為,板栗殼色素中的抗氧化成分極性偏大。
核桃殼提取物的抗氧化活性與成分含量基本一致。本試驗中,核桃殼堿提物中多酚和黃酮的含量及抗氧化活性均高于醇提物。 魏歡等(2018)研究結果表明,核桃葉75%乙醇提取物及其各萃取部分均表現出一定的抗氧化活性,其中乙酸乙酯、正丁醇的IC50 均高于Vc, 且多酚的含量和抗氧化能力呈現正相關關系。
本試驗中, 酒精處理降低了小鼠肝臟中谷胱甘肽過氧化物酶、過氧化氫酶、超氧化物歧化酶的活力,提高了丙二醛含量,核桃殼提取物提高了酒精處理下小鼠體內的谷胱甘肽過氧化物酶、 過氧化氫酶、總超氧化物歧化酶活性,降低了丙二醛的含量, 因此核桃殼提取物對酒精引起的肝臟GSH-Px、CAT、T-SOD 活力的降低和MDA 含量的升高具有預防作用, 即核桃殼提取物對肝臟具有保護作用。總體來看,核桃殼提取物高劑量對肝臟具有較好的保護作用。 本試驗結果對研究核桃殼的抗氧化活性及其作為飼料添加劑提供了基礎。

