“質量源于設計”在制備N-乙酰半胱氨酸注射液中的應用
張莉燕,宋金春
(武漢大學人民醫院藥學部,湖北 武漢 430060)
2004年9月,美國食品藥品監督管理局(FDA)提出將質量源于設計(QbD)理念應用于藥品的研發和生產[1];2006年,人用藥品注冊技術標準國際協調會(ICH)Q8 指南指出,QbD是從預定義產品目標開始,基于科學和風險管理的方法,加強對產品的理解及過程控制的一種系統的開發方法[2]。基于 QbD 理念建立滿足預定義目標且工藝穩健的設計空間,對相關工藝參數或物料屬性的超限范圍進行界定[3],重點關注控制策略和工藝的耐用性,參數在設計空間內變動時,產品質量也能保持一致。
N-乙酰半胱氨酸(N-acetylcysteine,NAC)是半胱氨酸的乙酰基衍生物[4],作為對乙酰氨基酚過量的解毒劑被廣泛認可[5],可通過作用于谷氨酸能和多巴胺能神經傳遞、氧化應激、神經發生、線粒體障礙和炎癥途徑等發揮作用[6-7]。在國內,其注射液用于肝衰竭早期治療,以降低膽紅素、提高凝血酶原活力;但在滴注時可出現惡心、嘔吐、皮疹、瘙癢、支氣管痙攣、頭痛頭暈、發熱、過敏反應等。實驗參考Cumberland Pharmaceuticals Inc.原研制劑的處方組成,基于QbD理念對處方因素進行優化和選擇,保障注射液質量。
1 儀器與試劑
CPA225D電子分析天平(德國賽多利斯公司);ZNCL-GS智能磁力攪拌器(鞏義市予華儀器有限責任公司);BF2000氮氣吹干儀(北京八方世紀科技有限公司);雷磁PHS-3E型pH計(上海儀電科學儀器股份有限公司);砂芯過濾器(天津市津騰實驗設備有限公司);SK5200H超聲波清洗器(上海科導超聲儀器有限公司);Milli-Q超純水系統(美國密理博公司);安捷倫1100高效液相色譜儀(配有G1379A真空脫氣機、G1311A四元梯度泵、G1313A自動進樣器、G1316A柱溫箱、G1315B-DAD檢測儀及Agilent化學工作站,美國Agilent公司)。
N-乙酰半胱氨酸原料藥(武漢遠大弘元股份有限公司)、依地酸鈣鈉(上海易恩化學技術有限公司);磷酸二氫鈉、磷酸均為分析純;甲醇為色譜純[賽默飛世爾科技(中國)有限公司];水為超純水。
2 試驗方法
2.1 定義目標產品的質量概況
通過查閱原研產品說明書、文獻信息,查詢目標產品的臨床給藥特點、給藥途徑、劑型、規格、容器密閉系統等信息,進行前瞻性的總結,定義目標產品的質量特性(guality target product profile,QTPP)[8],如表1所示。

表1 NAC注射劑的目標產品質量概況
2.2 識別產品關鍵質量屬性
注射劑的關鍵質量屬性(CQAs)通常包括:①無菌保證;②熱原或細菌內毒素;③外源性雜質;④注射液的穩定性(如pH值、顏色、有關物質、含量等)以及復溶性等[8]。NAC易氧化變色,進行處方開發時,將注射液滅菌前后pH值的變化量及主藥含量作為關鍵評價指標,即響應。
2.3 風險評估
根據實驗過程繪制魚骨圖篩選出影響制劑質量的因素(圖1),主要包括處方因素及工藝因素兩部分。
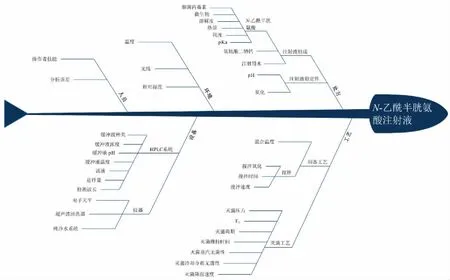
圖1 影響制劑質量因素的魚骨圖
采用失效模式與效應分析(FMEA)對各因素風險進行定量評估[9],根據風險評估系數值(risk priority number,RPN)確定關鍵工藝參數。RPN值是由各因素嚴重程度(S)、發生率(O)和檢測難易程度(D)的得分值相乘得到[3],當某參數的RPN值大于8時,則被確定為關鍵工藝參數。S、O、D評分原則及參數RPN見表2和圖2。

表2 嚴重程度(S)、發生率(O)和檢測難易程度(D)的評分原則
注:由于本試驗中影響制劑質量的因素或可通過儀器檢測間接評估,或為特性參數可直接直觀判斷(圖1、圖2),故對于檢測難易程度(D)只設置了容易檢測到和很難被檢測到兩種情況
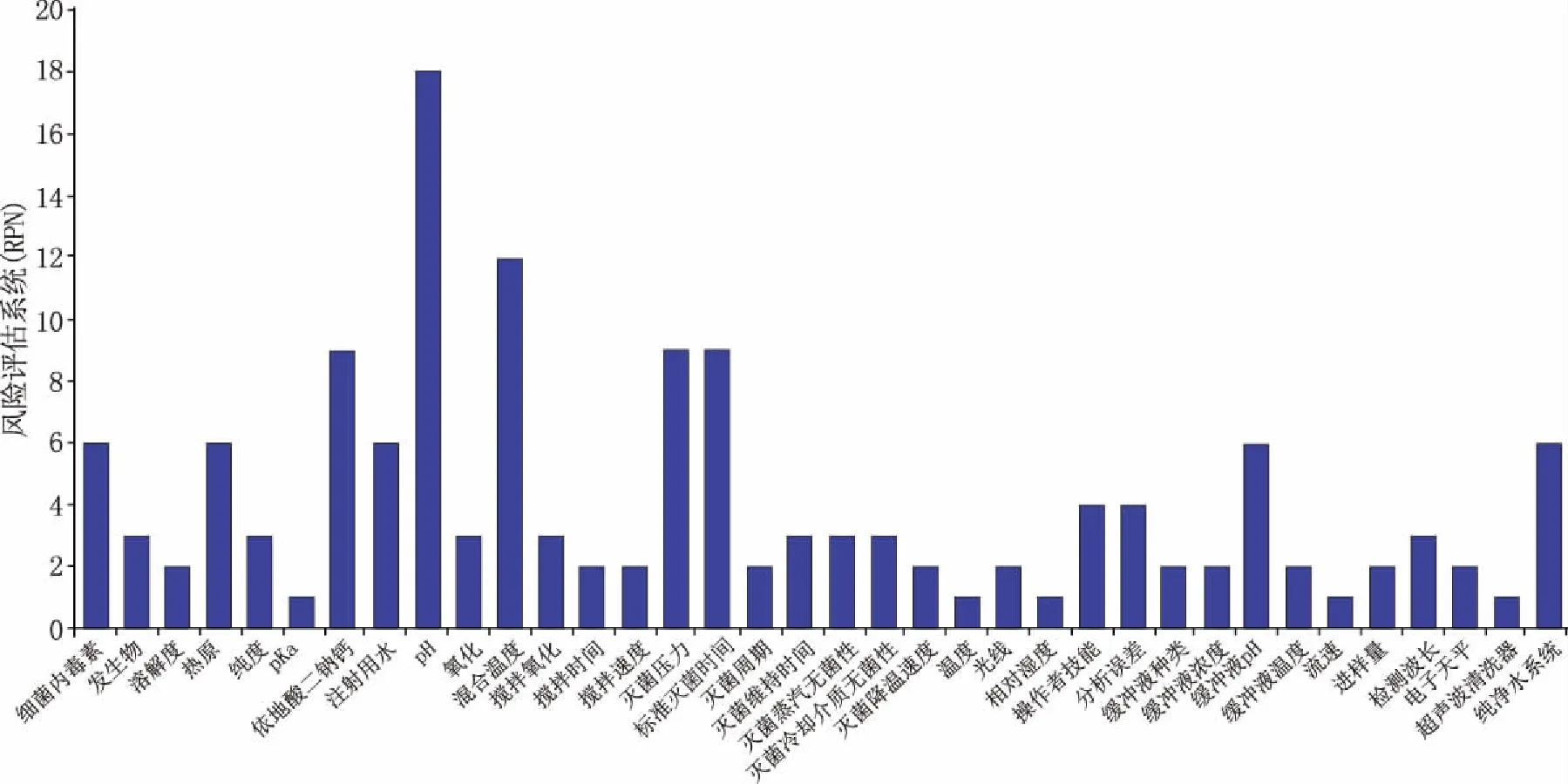
圖2 FMEA風險評估結果
2.4 關鍵工藝參數
由風險評估結果(圖2)可知,依地酸鈣鈉、pH值、配液溫度、滅菌壓力、標準滅菌時間的RPN值較大,pH值由預實驗結果已確定,因此,本實驗選取依地酸鈣鈉添加量、配液溫度及滅菌條件作為影響制劑質量的關鍵工藝參數。
2.5 試驗設計
對3個關鍵工藝參數:依地酸鈣鈉添加量(A)、配液溫度(B)、滅菌條件(C)用Minitab軟件做全因子試驗設計,以滅菌后pH值變化量(Y1)、主藥含量(Y2)為響應,試驗設計因子水平和響應(表3、表4),各序列處方見表5。
2.6 注射劑的制備
量取約80%處方量的注射用水,通氮氣飽和后加入處方量的NAC和不同比例的依地酸鈣鈉,在氮氣條件下攪拌使之溶解,加入飽和NaOH溶液,調節pH 為6.5~7.5,加入氮氣飽和的注射用水至處方量,0.45 μm微孔濾膜過濾,檢查濾液澄明度后灌封,通氮氣于上部空間,滅菌后燈檢,按照規定方法進行可見異物檢查,合格樣品即為成品。
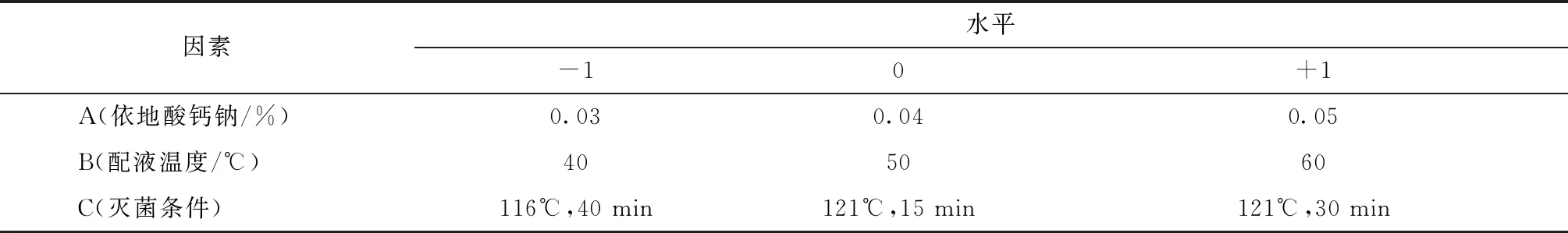
表3 試驗設計因子水平表

表4 相應目標值與可接受范圍
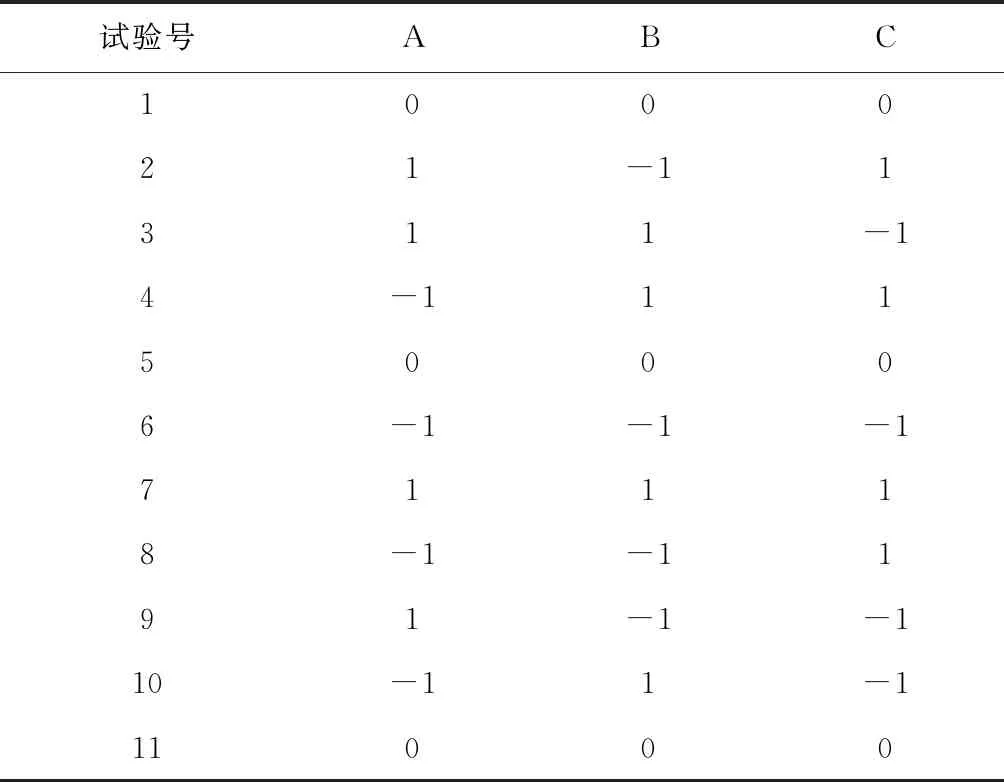
表5 析因試驗設計表
2.7 分析方法
2.7.1色譜條件
色譜柱:Wondasil C18柱(250 mm×4.6 mm,5 μm);流動相:10 mmol/L磷酸鹽緩沖液(濃磷酸調節pH至2.15)-甲醇(90:10,V/V);流速:1.0 ml/min;檢測波長:210 nm;柱溫:25 ℃;進樣量:20 μl。
2.7.2 對照品溶液的制備
取NAC對照品適量,精密稱定,加流動相制成0.08 mg/ml的溶液,按上述色譜條件進樣。
2.7.3供試品溶液的制備
量取制備的NAC注射劑適量,加流動相制成2 mg/ml的溶液,再精密量取上述溶液適量,加流動相制成0.08 mg/ml的溶液,按上述色譜條件進樣。
2.7.4線性關系考察
制備不同濃度的NAC對照品溶液,按上述色譜條件進樣,以NAC對照品峰面積(Y)對質量濃度(X)作圖,進行線性回歸,得NAC的標準曲線回歸方程為Y= 14 679X-99.267,相關系數R2=0.999 7。
3 結果
3.1 試驗設計結果
按表5設計的試驗順序進行試驗,結果見表6。對結果進行分析,各響應的因子效應圖見圖3、圖4,方差分析結果見表7。
因子效應圖表明,因子A、B、C及其相互作用產生的復合因子AB、AC、BC均對響應Y1、Y2有顯著影響。相關性好的模型R2應大于0.8,本試驗 Y1、Y2模型的R2分別為0.994 0和0.989 0,且與R2(調整)接近,表明回歸模型對試驗擬合較好,可以信賴;Y1、Y2模型彎曲P值大于0.05,表明模型不存在彎曲;失擬P值大于0.05,表明不存在更高階的相互作用,構建模型合適。
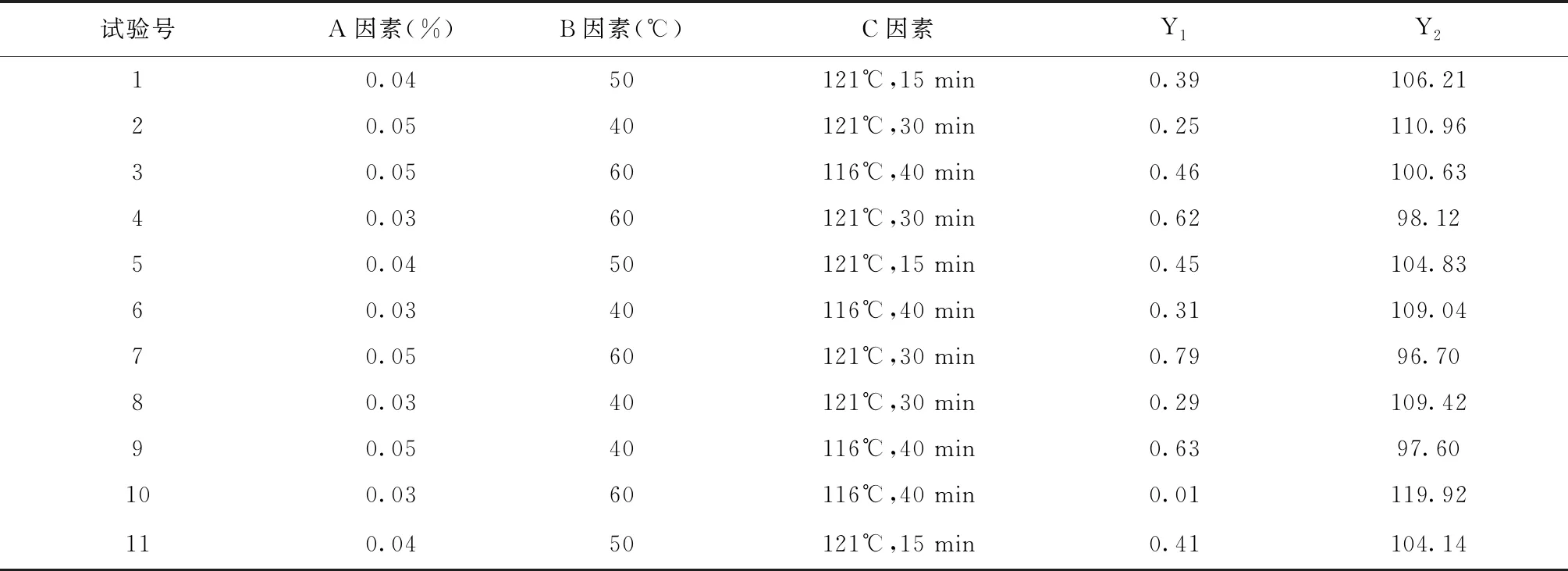
表6 試驗設計結果
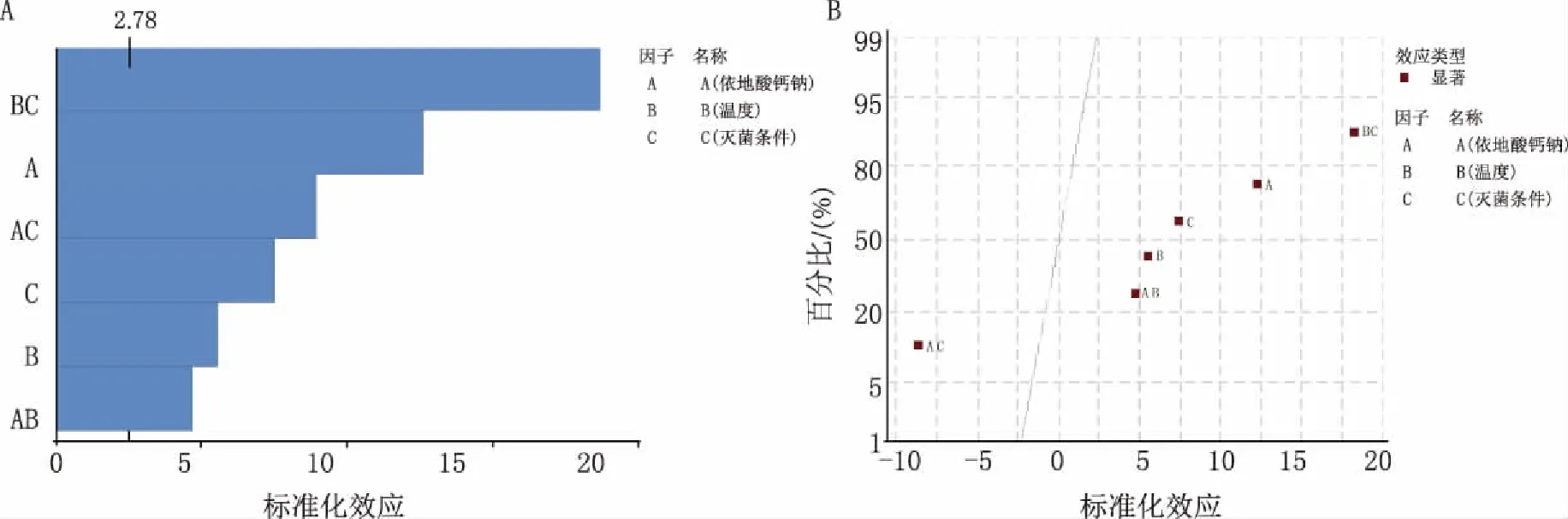
圖3 Y1因子效應圖(α=0.05) A.標準化效應的Pareto圖;B.標準化效應的正態圖
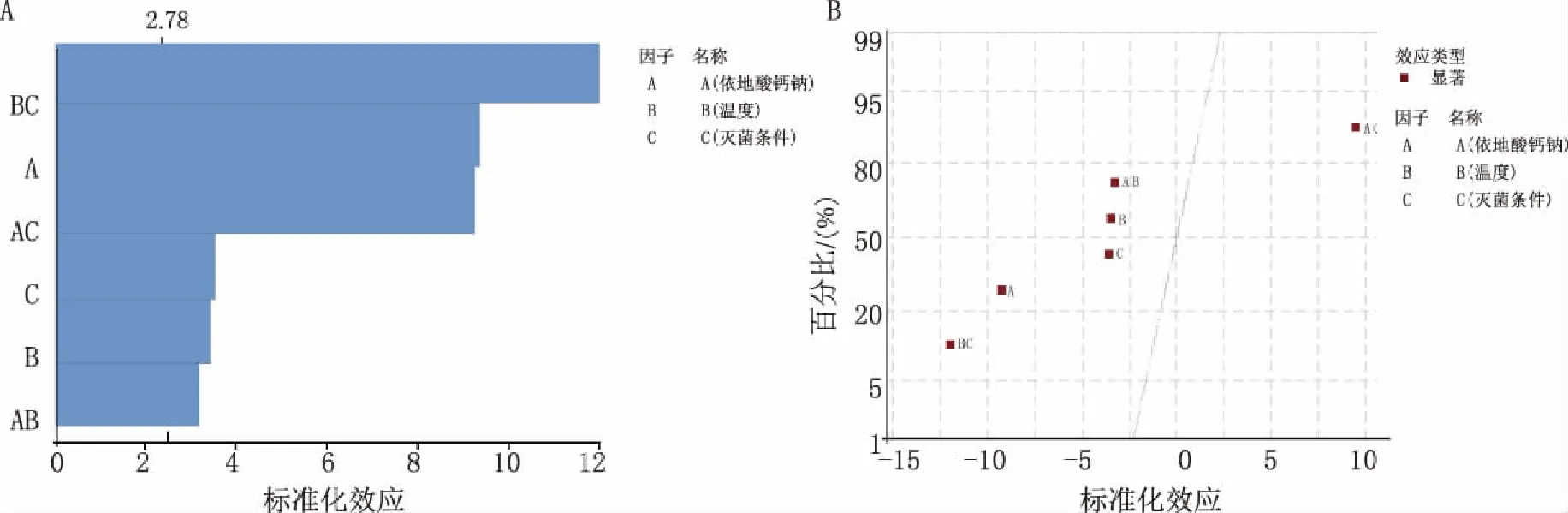
圖4 Y2因子效應圖(α=0.05) A.標準化效應的Pareto圖;B.標準化效應的正態圖

來源模型P值彎曲P值失擬P值R2(%)R2(調整)(%)Y1全模型0.0000.8790.45299.4098.51Y2全模型0.0010.8060.24398.9097.25
注:a=0.05
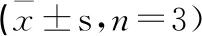
表8 NAC設計空間驗證結果
由圖5可見,殘差均在正常范圍內,且滿足正態分布,最終得到響應Y1、Y2的回歸方程:
Y1=0.419 09+0.112 50A+0.050 00 B+0.067 50C+0.042 50AB-0.080 00AC+0.167 50 BC
Y2=105.234-3.826A-1.456B-1.499C-1.351AB+3.856AC-4.934BC
從輸出的Y1、Y2等值曲線圖(圖6)可見,較淺區域的響應更滿足要求,對響應進行疊加得到等值曲線疊加圖(圖7),確定可接受范圍。圖中白色區域為可行區域,即建立的設計空間。最后運用響應優化器進行優化,如圖8所示,A、B、C因素分別從低水平變化到高水平時,兩個響應的變化趨勢相反;由預實驗結果已知注射液最適合的pH值在6.5~7.5,雖然注射液滅菌前后的pH值變化較大,但仍處于上述范圍內,故對響應Y2給予更多的關注。將Y2和Y1的權重比調至9:1進行優化時,復合合意性為0.7269,表明兩個響應均獲得較好的結果,從而得出最佳工藝參數:依地酸鈣鈉添加量(A)為0.049 192%,配液溫度(B)為60℃,滅菌條件(C)為116℃,40 min。
3.2 設計空間的驗證
為了驗證設計空間的可靠性,選擇空間內的點(0.5,0.0),即依地酸鈣鈉添加量為0.045%,配液溫度為50℃,滅菌條件為116℃, 40 min進行驗證,平行3次測定,結果顯示,實驗值與預測值相近,表明建立的模型具有較好的預測能力,且在設計空間內改變生產工藝和參數時能保證制劑質量的均一可控。

圖5 Y1、Y2殘差圖 A.Y1殘差正態概率圖;B. Y1殘差直方圖;C.Y2殘差正態概率圖;D. Y2殘差直方圖
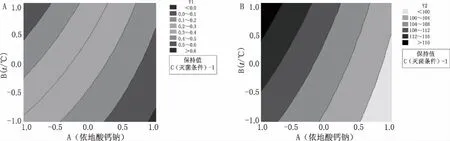
圖6 Y1、Y2等值曲線圖 A.Y1與B(t/℃)、A(依地酸鈣鈉)的等值線圖;B.Y2與B(t/℃)、A(依地酸鈣鈉)的等值線圖
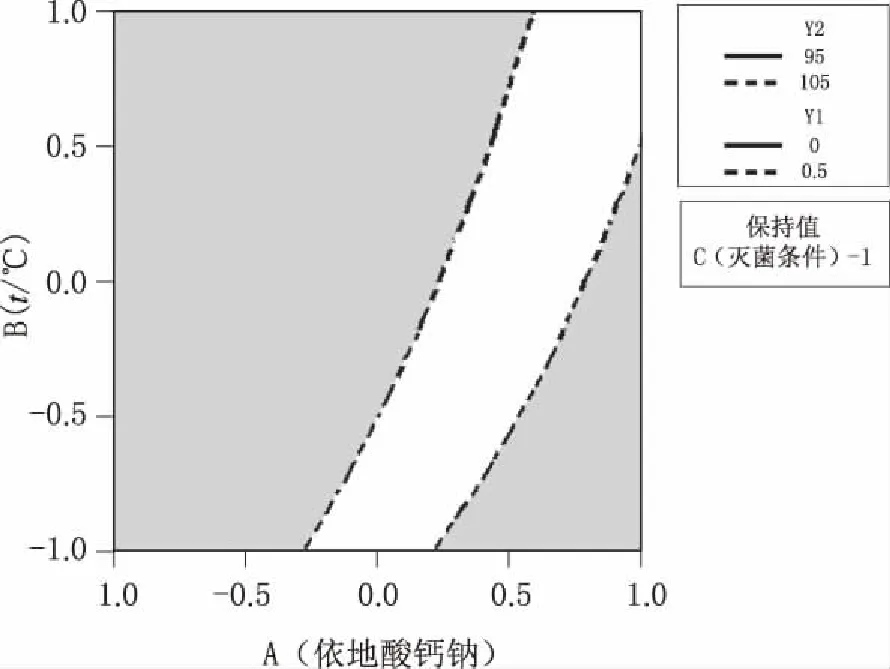
圖7 Y1、Y2等值曲線疊加圖
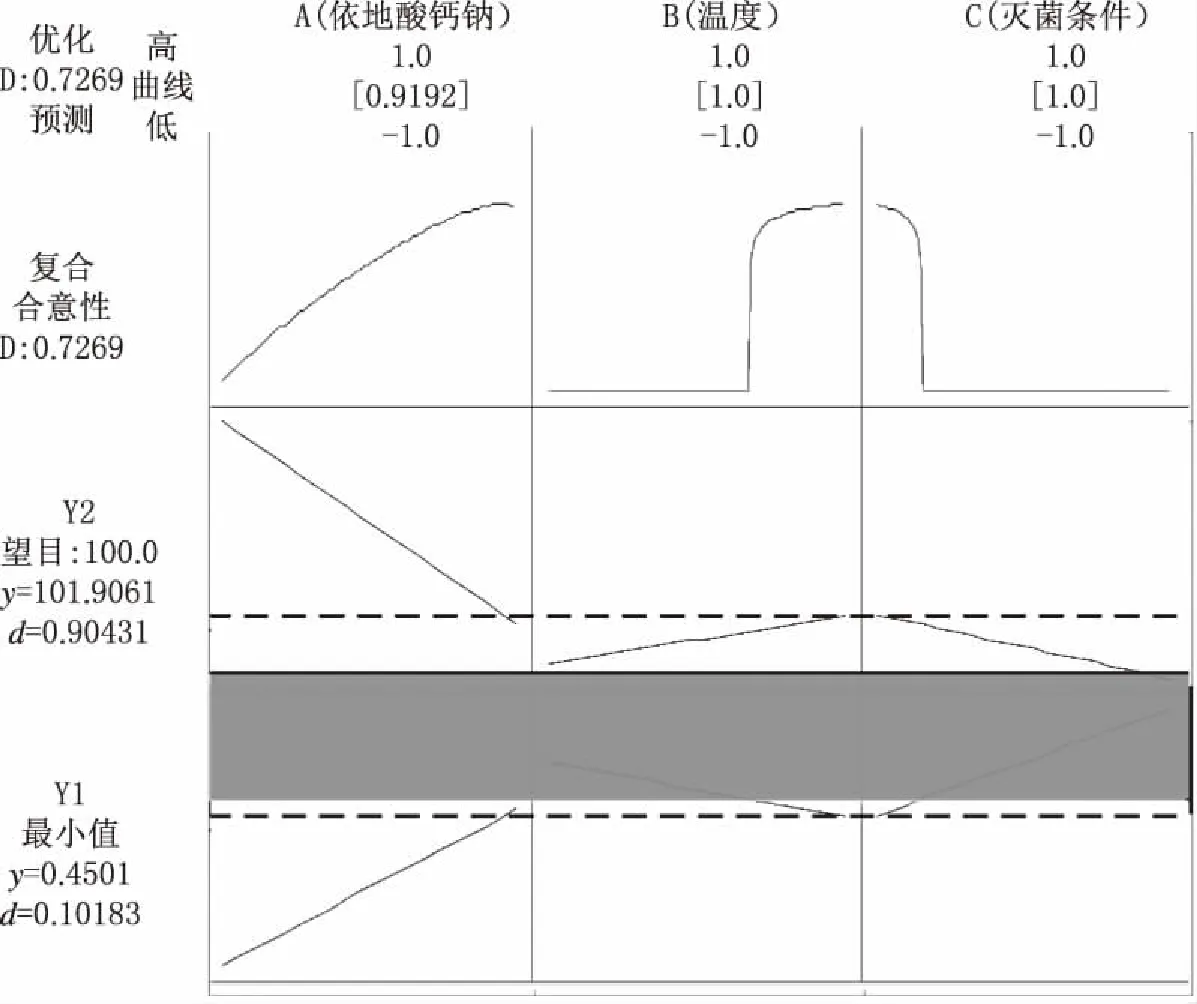
圖8 多響應優化圖
4 討論
本實驗參考Cumberland Pharmaceuticals Inc.原研制劑處方組成,基于QbD理念,開發了穩定性好、致敏性低的注射液。繪制魚骨圖結合FMEA法進行因子風險評估,確定了依地酸鈣鈉添加量、配液溫度及滅菌條件作為影響制劑質量的關鍵工藝參數;通過析因實驗設計研究了CPPs對響應的影響,最終得到最佳工藝參數及設計空間,且驗證空間結果與預測值接近。按照QbD理念設計的注射液,其工藝參數在設計空間內變化時,質量仍能保持均一穩定,從而保障了藥品質量。

