豬圓環(huán)病毒2 型ORF3 蛋白的原核表達(dá)及抗體檢測(cè)ELISA 方法的建立
李鑫鑫,張廣芳,呂其壯,張彥明,郭抗抗
(西北農(nóng)林科技大學(xué)動(dòng)物醫(yī)學(xué)院,陜西 楊凌 712100)
豬圓環(huán)病毒2 型(PCV2)是引起斷奶仔豬多系統(tǒng)衰竭綜合征(PMWS)、豬皮炎與腎病綜合征(PDNS)和豬呼吸道綜合征(PRBC)多種疾病的主要病原之一[1]。PCV2 會(huì)引起豬的免疫抑制、混合感染和繼發(fā)感染,使養(yǎng)殖戶(hù)遭受巨大經(jīng)濟(jì)損失[2]。近些年來(lái),通過(guò)疫苗免疫接種是防控PCV2 相關(guān)疾病的有效方法,但還不能完全阻止病毒的感染[3],因此,闡明PCV2 致病機(jī)理對(duì)本病的防控具有重要的指導(dǎo)作用。
研究表明,PCV2 在感染細(xì)胞中可以促進(jìn)細(xì)胞的凋亡,軟件預(yù)測(cè)其存在11 個(gè)開(kāi)放閱讀框(Open reading frame,ORF),理論上可以編碼11 個(gè)產(chǎn)物。其中,ORF3 編碼產(chǎn)物可以誘導(dǎo)宿主細(xì)胞的凋亡,這種作用可能有利于病毒在動(dòng)物體內(nèi)的增值,在PCV2 感染和致病中發(fā)揮重要作用[4-6]。
目前,臨床常用的檢測(cè)PCV2 抗體的方法仍是ELISA,此方法操作簡(jiǎn)單、快速,易于標(biāo)準(zhǔn)化,適合臨床上檢測(cè)大量樣品[5]。因此,本試驗(yàn)制備ORF3 蛋白抗體,并建立了基于ORF3 蛋白的PCV2 抗體檢測(cè)間接ELISA 方法,為ORF3 抗體檢測(cè)和鑒定提供了方法,也可以用于PCV2 感染和疫苗免疫豬抗體的檢測(cè)。
1 材料與方法
1.1 毒株、菌株、抗體與主要試劑 PCV2 楊凌分離株由西北農(nóng)林科技大學(xué)動(dòng)物醫(yī)學(xué)院獸醫(yī)公共衛(wèi)生學(xué)實(shí)驗(yàn)室(本實(shí)驗(yàn)室)分離保存;TaqDNA 聚合酶、IPTG,購(gòu)自生工生物工程(上海)股份有限公司;DNA 膠回收試劑盒、PCR 試劑盒,購(gòu)自天根生化科技(北京)有限公司;原核表達(dá)載體pGEX-6p-1、大腸埃希菌(E.coli)DH5α 和BL21 感受態(tài)細(xì)胞、T4 DNA 連接酶、DNA Marker DL-5 000 和蛋白Marker,均為寶生物工程有限公司(TakaRa 大連)產(chǎn)品;GST 標(biāo)簽抗體和羊抗鼠二抗,購(gòu)自上海三箭生物技術(shù)有限公司;辣根過(guò)氧化物酶標(biāo)記羊抗豬血清系晶彩生物科技公司產(chǎn)品;豬圓環(huán)病毒ELISA 檢測(cè)試劑盒為上海谷研實(shí)業(yè)有限公司產(chǎn)品;所用陰陽(yáng)性血清均由西北農(nóng)林科技大學(xué)動(dòng)物醫(yī)學(xué)院畜禽疫病防控與獸醫(yī)公共衛(wèi)生實(shí)驗(yàn)室保存;豬瘟病毒(CSFV)、偽狂犬病病毒(PRV)、豬繁殖與呼吸綜合征病毒(PRRSV)陽(yáng)性血清,均由本實(shí)驗(yàn)室鑒定并提供。
1.2 引物設(shè)計(jì)與基因克隆 由PCV2 楊凌分離株全基因測(cè)序結(jié)果、GenBank 中PCV2 ORF3 序列設(shè)計(jì)特異性引物,其序列如下:
FP:5′-GCGAATTCATGGTAACCATCCCACCACTTG-3′
RP:5′-GCGAATTCATGGTAACCATCCCACCACTTG-3′。
PCR 條件為:95 ℃5 min;94 ℃30 s,60 ℃30 s,72 ℃30 s,共35 個(gè)循環(huán);72 ℃10 min。PCR 產(chǎn)物用12 g/L 瓊脂糖凝膠電泳并純化回收。
1.3 重組質(zhì)粒pGEX-6p-ORF3 的構(gòu)建 純化回收的PCR 產(chǎn)物和pGEX-6p-1 空載體連接以構(gòu)建重組質(zhì)粒,轉(zhuǎn)入E.coliDH5α,篩選陽(yáng)性菌落擴(kuò)大培養(yǎng)后提取質(zhì)粒。提取的質(zhì)粒進(jìn)行雙酶切后送北京六合華大基因科技有限公司測(cè)序分析,測(cè)序正確的重組質(zhì)粒命名為pGEX-6p-ORF3。
1.4 重組質(zhì)粒的誘導(dǎo)表達(dá)和蛋白純化 重組質(zhì)粒與空質(zhì)粒共同導(dǎo)入BL21 感受態(tài)菌株中,篩選得到陽(yáng)性菌落并擴(kuò)大培養(yǎng)后加入IPTG,對(duì)不同誘導(dǎo)時(shí)間的菌體蛋白進(jìn)行SDS-PAGE 鑒定以確定最適表達(dá)時(shí)間。
將得到的菌體蛋白用切膠法進(jìn)行純化,純化目的蛋白的樣品進(jìn)行Western Blot 鑒定,確定是否得到重組ORF3 蛋白。
1.5 豬圓環(huán)病毒2 型抗體檢測(cè)間接ELISA 方法的建立
1.5.1 ORF3 蛋白包被濃度與血清稀釋度的確定 采用棋盤(pán)滴定的方法,將已純化的重組蛋白抗原用0.06 mol/L CBS 包被液按照1 μg/mL、2 μg/mL、4 μg/mL、8 μg/mL 梯度稀釋包被酶標(biāo)板。酶標(biāo)板4 ℃過(guò)夜后加入按照1∶40、1∶80、1∶160、1∶320稀釋的PCV2 陰陽(yáng)性血清作為一抗孵育、辣根過(guò)氧化物酶標(biāo)記羊抗豬血清作為二抗孵育,進(jìn)行ELISA。比較血清OD450值,確定重組抗原最佳包被濃度與血清稀釋度。
1.5.2 封閉液的選擇 以重組蛋白抗原最佳包被濃度包被酶標(biāo)板并分成兩組,一組加入10% PBS 的PBST,另一組加入25 g/L 脫脂奶粉的PBST。酶標(biāo)板37 ℃封閉1h 后加入最佳稀釋度的陰陽(yáng)性血清作為一抗,孵育洗滌后加入酶標(biāo)二抗進(jìn)行ELISA。重復(fù)兩次后比較陰陽(yáng)性血清OD450值及P/N 值,確定最佳封閉液。
1.5.3 血清最佳反應(yīng)時(shí)間的確定 以抗原最佳包被濃度與抗原最佳包被條件,加入最佳封閉液和一抗陰陽(yáng)性血清,37 ℃條件下分別反應(yīng)0.5 h、1 h、1.5 h,洗滌后加入酶標(biāo)二抗進(jìn)行ELISA,最后比較陰陽(yáng)性血清OD450值及P/N 值,確定一抗血清最佳反應(yīng)時(shí)間。
1.5.4 顯色時(shí)間的確定 按如上已確定的反應(yīng)條件,加入底物后分別顯色5 min、10 min、15 min。比較陰陽(yáng)性血清OD450值及P/N 值,最終確定最佳顯色時(shí)間。
1.5.5 間接ELISA 陰陽(yáng)性臨界值的確定 將30 份經(jīng)檢測(cè)為PCV2 核酸和抗體陰性的豬血清用建立的間接ELISA 方法進(jìn)行檢測(cè),重復(fù)2 次,計(jì)算30 份血清OD450值的平均值和標(biāo)準(zhǔn)方差(SD),根據(jù)公式:臨界值=X+3SD,計(jì)算出陰陽(yáng)性血清的臨界值。根據(jù)統(tǒng)計(jì)學(xué)規(guī)則,當(dāng)血清OD450>臨界值時(shí),可判定為陽(yáng)性。
1.5.6 特異性試驗(yàn) 用建立的包被ORF3 蛋白的檢測(cè)PCV2 抗體的間接ELISA 方法分別檢測(cè)CSFV、PRV、JEV、PRRSV 的陽(yáng)性血清,同時(shí)設(shè)PCV2 抗體陽(yáng)性、陰性對(duì)照,判斷方法的特異性。
1.5.7 臨床血清樣品檢測(cè) 對(duì)豬場(chǎng)收集的80 份血清,用建立的方法進(jìn)行PCV2 抗體檢測(cè),同時(shí)用商品化試劑盒進(jìn)行對(duì)照檢測(cè),對(duì)檢測(cè)結(jié)果進(jìn)行比較。
2 結(jié)果
2.1 豬圓環(huán)病毒2 型ORF3 蛋白的原核表達(dá)與純化
2.1.1 目的基因的擴(kuò)增 PCR 結(jié)果顯示,擴(kuò)增出的片段大小在300 bp 左右(圖1),符合預(yù)期。對(duì)目的產(chǎn)物進(jìn)行純化回收后,序列測(cè)定表明片段大小為
315 bp,未發(fā)現(xiàn)突變、缺失現(xiàn)象。
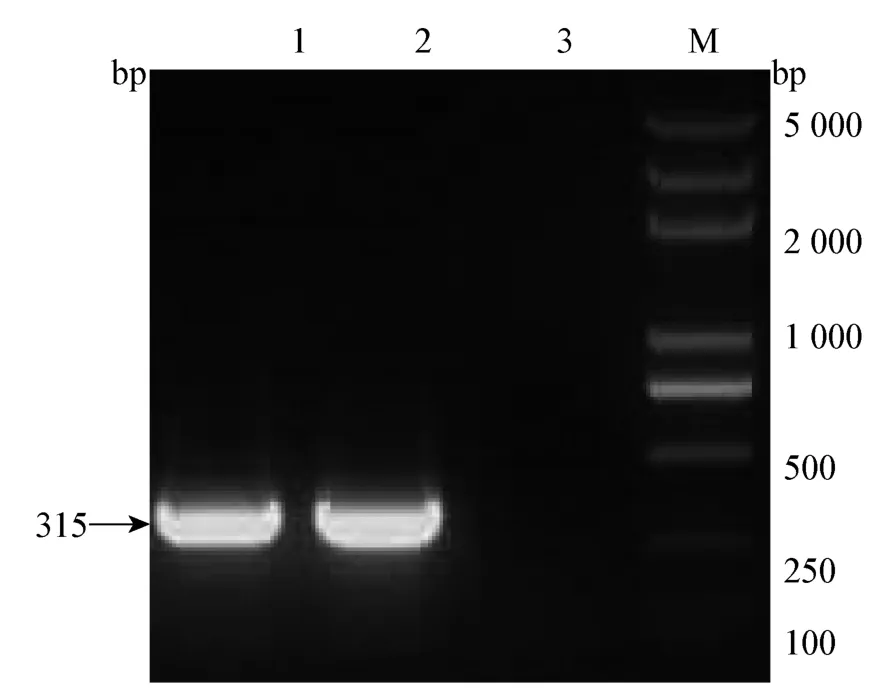
圖1 ORF3 基因的PCR 擴(kuò)增
2.1.2 重組質(zhì)粒的鑒定與表達(dá) 重組質(zhì)粒pGEX-6p-ORF3 測(cè)序結(jié)果顯示,插入的ORF3 基因完全正確,未出現(xiàn)堿基變化,可用于進(jìn)一步的產(chǎn)物表達(dá)。IPTG 誘導(dǎo)表達(dá)確定最適時(shí)間后SDS-PAGE 電泳結(jié)果顯示,重組ORF3 蛋白大小為37 kDa,在37 ℃,225 r/min,IPTG 1.0 mmol/L 誘導(dǎo)5 h 時(shí)表達(dá)量最大(圖2)。

圖2 重組質(zhì)粒表達(dá)產(chǎn)物的SDS-PAGE 分析
2.1.3 GST-ORF3 重組蛋白純化的鑒定 純化回收的重組蛋白經(jīng)SDA-PAGE 電泳,可見(jiàn)到在37 kDa 左右處出現(xiàn)單一的條帶(圖3);Western Blot 分析,出現(xiàn)2 條特異性條帶,大小分別為26 kDa 和37 kDa(圖4),純化蛋白大于空載體。表明ORF3 基因得到了表達(dá),經(jīng)切膠法得到了純化蛋白,測(cè)定純化蛋白的濃度為10.08 μg/mL。
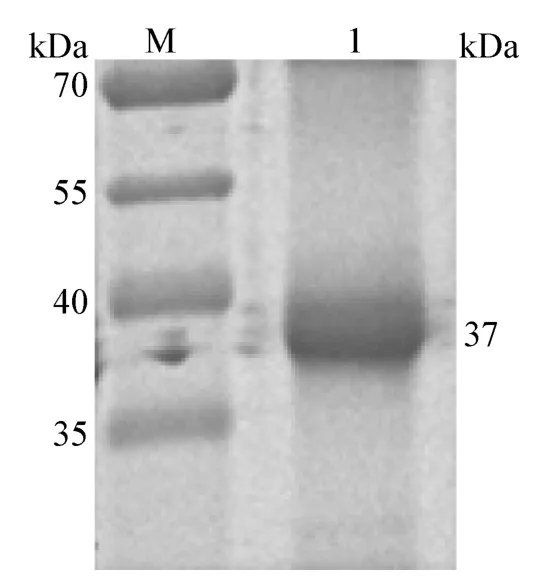
圖3 GST-ORF3 蛋白純化的SDS-PAGE 分析
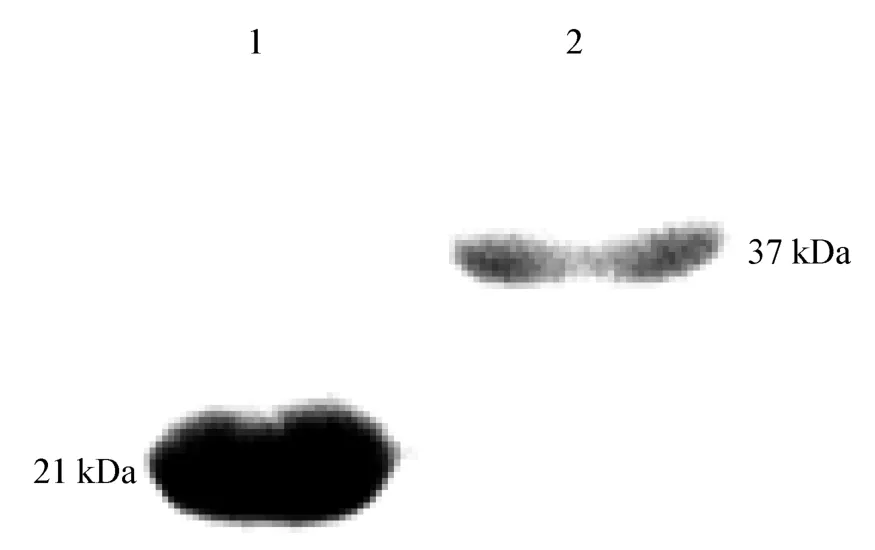
圖4 Western Bolt 對(duì)純化的GST-ORF3 蛋白的檢驗(yàn)
2.2 豬圓環(huán)病毒2 型抗體間接ELISA 方法的建立與應(yīng)用
2.2.1 抗原最佳包被濃度和血清稀釋度的確定采用棋盤(pán)滴定的方法,將已純化的重組蛋白抗原梯度稀釋,4 ℃包被過(guò)夜,加入按照1∶40、1∶80、1∶160、1∶320 稀釋的陰陽(yáng)性血清進(jìn)行ELISA。比較不同包被液濃度和不同血清稀釋度下OD450值(表1),可知抗原的最佳包被濃度為2 μg/mL,血清的最佳稀釋度為1∶160。
2.2.2 封閉液的選擇 分別用10% PBS 的PBST、25 g/L 脫脂奶粉的PBST 2 種封閉液對(duì)已用抗原包被的酶標(biāo)板進(jìn)行封閉,加入最佳稀釋度的陰陽(yáng)性血清,進(jìn)行ELISA 且重復(fù)2 次。比較陰陽(yáng)性血清OD450值及P/N 值(表2),確定最佳封閉液為10%PBS 的PBST。
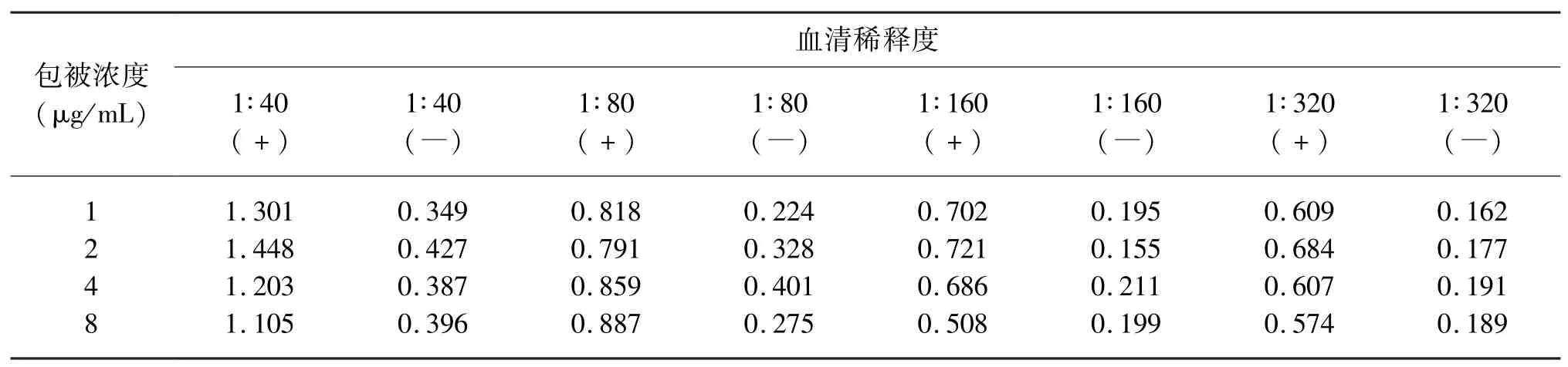
表1 重組ORF3 蛋白抗原最佳包被濃度和血清稀釋度的確定
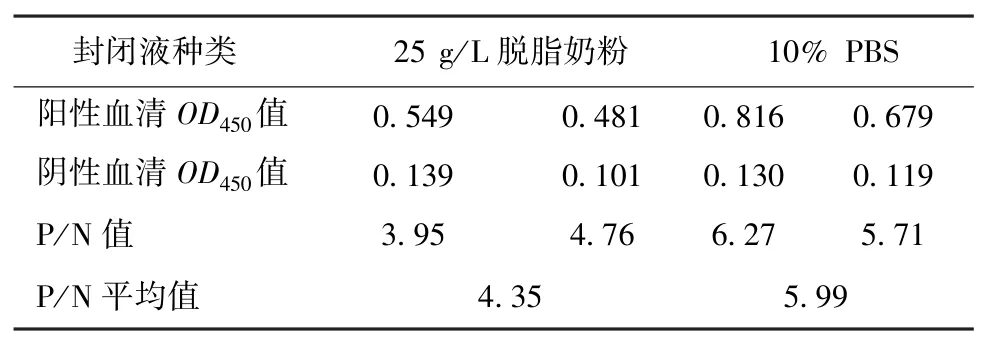
表2 封閉液的確定
2.2.3 血清最佳反應(yīng)時(shí)間的確定 以抗原最佳包被濃度與抗原最佳包被條件,加入封閉液和一抗血清,進(jìn)行ELISA 且重復(fù)2 次。比較陰陽(yáng)性血清OD450值及P/N 值(表3),確定一抗血清最佳反應(yīng)時(shí)間為1 h。
2.2.4 顯色時(shí)間的確定 按已確定的反應(yīng)條件,加入底物后,分別顯色5 min、10 min、15 min,重復(fù)2次。比較陰陽(yáng)性血清OD450值及P/N 值(表4),確定最佳顯色時(shí)間為15 min。
2.2.5 間接ELISA 陰陽(yáng)性臨界值的確定 將30份經(jīng)檢測(cè)為PCV2 核酸和抗體陰性的豬血清用已建立的間接ELISA 方法進(jìn)行檢測(cè),結(jié)果見(jiàn)表5。計(jì)算得到30 份陰性血清的OD450平均值為0.239,標(biāo)準(zhǔn)差(SD)為0.063,臨界值為0.428。因此,當(dāng)待檢血清的OD450值>0.43 時(shí),可判為陽(yáng)性;若待檢血清的OD450值<0.43,則判為陰性。
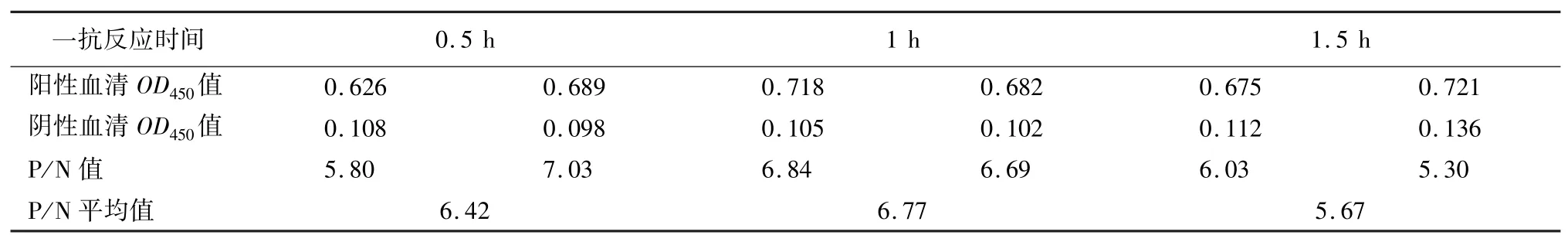
表3 血清最佳反應(yīng)時(shí)間的確定

表4 最佳顯色時(shí)間的確定

表5 間接ELISA 陰陽(yáng)性臨界值的確定
2.2.6 特異性試驗(yàn)結(jié)果 用建立的間接ELISA 方法分別檢測(cè)CSFV、PRV、JEV、PRRSV 的陽(yáng)性血清,同時(shí)設(shè)陽(yáng)性、陰性對(duì)照,結(jié)果(表6)均為陰性,表明該ELISA 方法具有高度的特異性。

表6 間接ELISA 方法的特異性試驗(yàn)
2.2.7 臨床血清樣品檢測(cè)結(jié)果 用建立的間接ELISA 方法對(duì)臨床80 份血清樣品進(jìn)行檢測(cè),同時(shí)和購(gòu)買(mǎi)的商品化試劑盒進(jìn)行比較。結(jié)果顯示,本研究建立的ELISA 方法檢出陽(yáng)性樣品48 份,商品化試劑盒檢出陽(yáng)性樣品45 份,兩種方法陽(yáng)性符合率為93%。
3 討論
目前,基于PCV2 分離株的序列比較可知其大致分為5 個(gè)基因型:PCV2a、PCV2b、PCV2c、PCV2d和PCV2e[6],已報(bào)道與豬群中許多疾病的發(fā)生有顯著關(guān)系,并與PMWS 有直接關(guān)聯(lián)[7]。PCV2 感染后會(huì)引起機(jī)體的細(xì)胞凋亡,病毒通過(guò)刺激細(xì)胞凋亡可躲避宿主免疫系統(tǒng)或誘導(dǎo)宿主感染細(xì)胞死亡,從而加快病毒粒子向周?chē)?xì)胞的擴(kuò)散,促進(jìn)病毒的增殖[8]。PCV2 ORF3 為非結(jié)構(gòu)性蛋白,牽涉誘導(dǎo)受感染細(xì)胞的凋亡,被認(rèn)為與PCV2 的發(fā)病機(jī)制和全身性擴(kuò)散密切相關(guān)。華麗等[9]利用生物信息學(xué)軟件發(fā)現(xiàn)ORF3 成熟蛋白有4 個(gè)主要的抗原位點(diǎn)。Stevenson[10]等證明ORF3(31aa~50aa)編碼的多肽可以誘導(dǎo)T 淋巴細(xì)胞的增殖能力。研究還發(fā)現(xiàn),PCV2 ORF3蛋白可以引起免疫小鼠血清中IL-4 濃度顯著升高,表明ORF3 蛋白在PCV2 誘發(fā)的體液免疫中發(fā)揮一定的作用[11]。PCV2 抗體檢測(cè)的方法有多種,其中ELISA 檢測(cè)與常用的免疫過(guò)氧化物酶單層細(xì)胞試驗(yàn)、免疫組織化學(xué)技術(shù)和間接免疫熒光試驗(yàn)相比,其操作更加簡(jiǎn)便、敏感性好,能夠快速檢測(cè)大量樣品[12]。
本研究構(gòu)建ORF3 重組蛋白,并使用重組蛋白作為包被抗原建立抗體檢測(cè)的間接ELISA 方法。經(jīng)驗(yàn)證,所建立的ELISA 方法的特異性以及與商品化試劑盒檢測(cè)結(jié)果的陽(yáng)性符合率均較高。綜合李鵬飛[13]使用ORF2 蛋白作為包被抗原所建立的檢測(cè)豬圓環(huán)病毒抗體的間接ELISA 方法,本研究用的重組蛋白包含了PCV2 特異性的抗原位點(diǎn),能夠區(qū)分PCV1 和PCV2;兩種抗體檢測(cè)試劑盒均能將PCV2 與CSFV、PRRSV、PRV 進(jìn)行區(qū)分,在實(shí)際應(yīng)用中具有較大意義。
綜上,本試驗(yàn)為進(jìn)一步研究PCV2 ORF3 蛋白提供了思路,建立的間接ELISA 方法可以用于檢測(cè)單克隆抗體效價(jià)、疫苗免疫動(dòng)物后免疫效果的監(jiān)測(cè),為其他研究人員檢測(cè)PCV2 抗體提供了方法。進(jìn)一步研究會(huì)將得到的重組蛋白用于兔子和小鼠的免疫,并利用建立的檢測(cè)方法對(duì)免疫后抗體效價(jià)進(jìn)行測(cè)定,為PCV2 疫苗的研發(fā)、疾病的防控提供基礎(chǔ)。

