分化型甲狀腺癌131I治療后再次停用左旋甲狀腺激素血清促甲狀腺激素未升高伴高甲狀腺球蛋白血癥1例
薛佳辰 趙明
(大連大學附屬中山醫院核醫學科,遼寧 大連 116000)
甲狀腺癌是最常見的內分泌系統惡性腫瘤,其中分化型甲狀腺癌(DTC)占所有甲狀腺癌的90%以上,其發病率在世界上呈逐年上升趨勢,位居女性惡性腫瘤前十位,包括甲狀腺乳頭狀癌(PTC)和濾泡狀癌,其中PTC較為常見且預后良好〔1〕。甲狀腺全切除術或近甲狀腺切除手術后放射性131I治療是DTC的標準治療方式,可以清除殘余的甲狀腺組織,有助于臨床監測腫瘤的復發或遠處轉移情況〔2〕。正常情況下PTC患者行131I治療前需停用左旋甲狀腺激素(L-T4)4 w左右,使機體處于“碘饑餓”狀態。并且DTC隨訪中的血清Tg測定包括:促甲狀腺激素(TSH)抑制狀態下和TSH刺激后的Tg測定。由于TSH抑制狀態下腫瘤細胞分泌Tg的能力可能也會受到抑制。故為更準確地反映病情,應通過停用L-T4或應用重組人促甲狀腺激素(rhTSH)的方法,使血清TSH水平升高至>30 mIU/L之后再進行Tg檢測,即TSH刺激后的Tg測定〔3〕。但是許多DTC患者因長期服用L-T4抑制治療,停用后垂體長期處于被抑制狀態,其功能恢復需要一定的時間,所以血清TSH上升可能較慢;年齡較大者,因垂體功能儲備降低,在停用L-T4后也可能不導致TSH水平增高。而本文患者為43歲中年女性,前兩次停用優甲樂后TSH均能上升至100 μIU/ml以上,僅4個月后第3次停用L-T4 28 d TSH未見增高。既往文獻并未見到與本病例相似,故本文就此情況做一報道。
1 臨床資料
43歲,女性患者,2016年10月28日行右側甲狀腺癌根治術+左甲狀腺全切術。術后病理:甲狀腺乳頭狀癌,侵犯被膜,未見脈管神經侵犯;右甲狀腺乳頭狀癌(直徑0.6 cm),侵犯被膜,另見淋巴結2枚(2/2);右側甲狀腺濾泡擴張,膠質潴留;右側中央區淋巴結見轉移癌(1/1)(圖1)。根據2015年ATA指南復發危險分層及刺激性Tg的水平該患者術后屬于高危組患者〔4〕。術后予L-T4抑制治療。
2017年1月5日行第1次131I治療,根據我國《甲狀腺結節和分化型甲狀腺癌診治指南》推薦:中高危DTC患者兼顧清灶目的的清甲治療,可直接給予3.7~7.4 GBq(100~200 mCi)。所以給予患者治療劑量為150 mCi。治療前停用L-T4 28 d,治療前當天復查TSH>100 μIU/ml,Tg>500 ng/ml。治療后4 d行全身碘顯像(WBS)示:甲狀腺術后殘留組織顯影(圖2)。治療后第3天繼續予L-T4抑制替代治療。 有研究指出,較高的TSH(≥30 μIU/ml)可增加甲狀腺濾泡細胞內的鈉-碘同向轉運體的表達,從而增加殘留甲狀腺組織和DTC細胞攝取131I的能力,不但利于清除殘余病灶,并且可避免131I甲狀腺顯像假陰性的發生〔5,6〕。所以讓患者停用左旋甲狀腺激素來提高TSH的水平。

圖1 第1次術后病理
治療后連續2個月門診隨診復查甲功及甲狀腺球蛋白(Tg)示:游離三碘甲狀腺原氨酸(FT3)、游離甲狀腺激素(FT4)及Tg抗體(TgAb)均在正常范圍內,TSH 0.075 μIU/ml、0.016 μIU/ml,Tg 9.58 ng/ml、5.54 ng/ml。2017年5月2日行甲狀腺彩超:左側頸部Ⅳ區(0.4 cm×0.4 cm)及Ⅳ區多發腫大淋巴結(0.9 cm×0.9 cm)。血液檢查提示第1次131I治療有效。
由于患者WBS示患者仍存在甲狀腺殘留組織顯影,彩超結果顯示仍存在腫大淋巴結且Tg水平較高,故根據2015年美國甲狀腺協會(ATA)指南的中提到的:對于血清刺激性Tg>10 ng/ml且WBS可見功能性核素攝取灶但未見轉移灶的情況,直接給予第2次的經驗性131I治療。2017年5月2日行第2次131I治療,治療前停用L-T4 30 d,復查TSH>100 μIU/ml,Tg>500 ng/ml,予131I劑量為150 mCi。治療后4 d行WBS示:未見異常放射性攝取,與2017年1月5日WBS相比原放射性濃聚灶消失(圖3)。治療后第3天繼續予優甲樂抑制治療。
第2次131I治療后第1個月和第2個月復查甲狀腺功能及Tg均顯示TSH<0.1 μIU/ml及Tg<10 ng/ml且處于逐漸下降的狀態,表示第2次131I治療有效。2017年9月4日復查甲狀腺彩超:左側頸部Ⅳ區(0.3 cm×0.3 cm)及Ⅵ區多發腫大淋巴結(1.0 cm×0.7 cm),且患者第2次131I治療前刺激性Tg>500 ng/ml,所以患者的TSH抑制治療有效,但可能存在腫瘤組織產生Tg能力被抑制的情況,所以決定4個月后評估患者刺激性Tg的水平。

甲狀腺床可見功能性核素攝取圖2 第1次131I治療后WBS
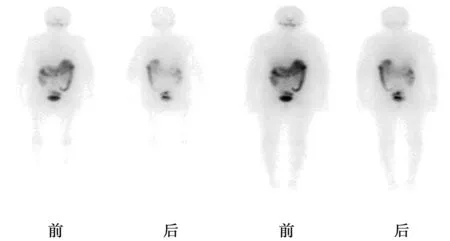
WBS未見異常放射性攝取圖3 第2次131I治療后WBS
患者第3次(2017年9月4日)停用L-T4及禁碘飲食28 d,入院當天復查TSH 0.078 μIU /ml,Tg 20.99 ng/ml,FT3、FT4、TgAb均在正常值范圍內。患者已停用L-T4 28 d,甲狀腺功能水平未達到甲狀腺功能減退癥的狀態,且胸部CT及腹部彩超均未見明顯異常。該患者TSH<0.1 μIU/ml,FT3、FT4未見下降趨勢,所以不考慮讓患者繼續停用L-T4等待TSH上升的方法。
該患者TSH并未升高,但對此產生了疑問,在4個月前的第2次治療TSH可達到>30 μIU/ml的基礎上,且患者第2次131I治療后行WBS已未見殘留及轉移灶顯影,為什么會出現甲狀腺功能結果完全處于正常值的狀態。患者胸部CT及腹部彩超均未見明顯異常,僅甲狀腺彩超示頸部多發腫大淋巴結。以上檢查結果均未顯示患者存在遠處轉移灶。遂建議患者行PET-CT明確全身病情(圖4)。
2017年11月2日患者于大連大學附屬中山醫院行左Ⅵ區淋巴結清掃術+左側功能性淋巴結清掃。術后病理:左Ⅱ區淋巴結1/7,Ⅲ區淋巴結9/13,Ⅳ區淋巴結1/2,Ⅵ區淋巴結1/1,氣管左側淋巴結2/2轉移癌,Ⅴ區淋巴結未見轉移癌。見圖4,5。
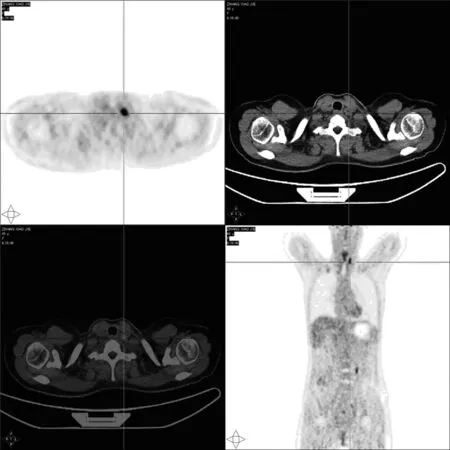
甲狀腺床區多枚FDG代謝增高小淋巴結,左側頸Ⅳ區最大者徑約1.1 cm,放射性攝取最高,SUVmax約11.0,延遲顯像約為12.9,均首先考慮轉移瘤圖4 2017年9月8日PET-CT
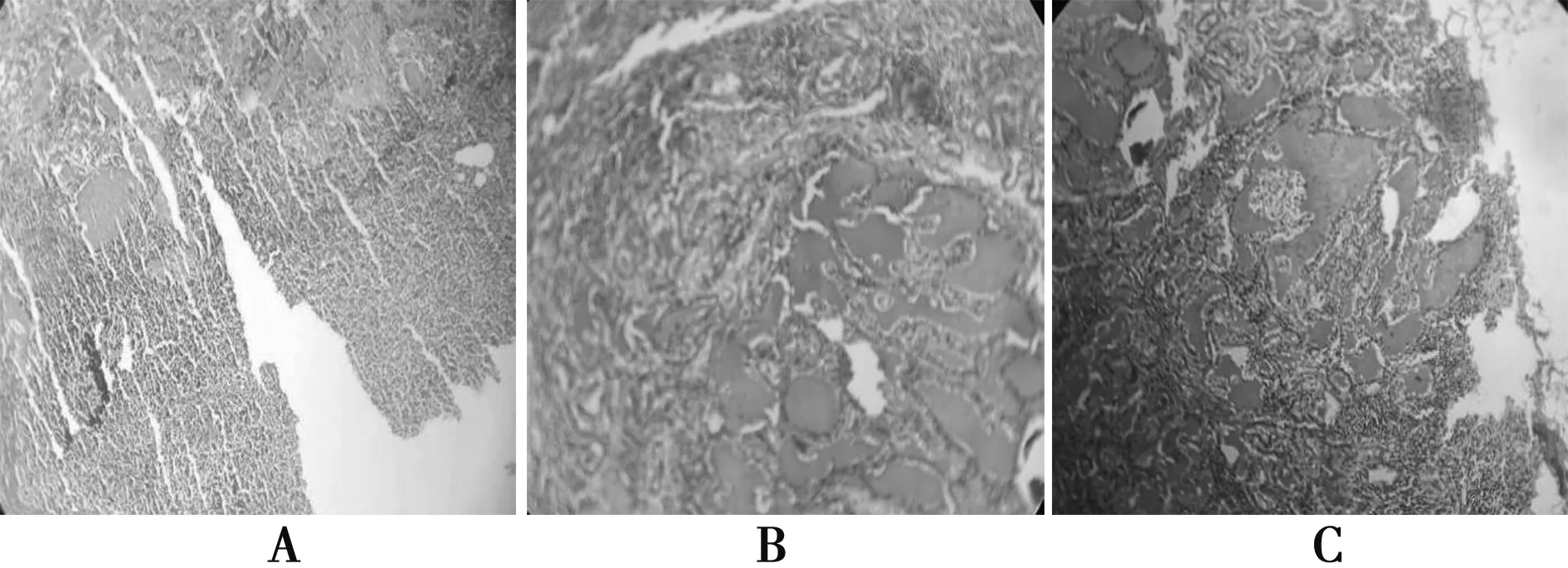
A、B、C均為頸部淋巴結轉移癌病理圖5 第2次手術術后病理(×100)
2 討 論
盡管PTC死亡率低,預后良好,但據報道最多有30%的患者在甲狀腺床或頸部局部復發〔7〕。PTC術后131I治療和長期TSH抑制治療是傳統的治療方法〔8〕。TSH抑制治療是指對DTC術后患者給予超過生理需要量的甲狀腺激素以抑制垂體TSH的分泌,進而減少TSH依賴性癌腫的復發和轉移,降低癌腫相關性的死亡。有研究表明TSH的水平與甲狀腺癌具有密切關系,多種類型甲狀腺癌細胞表面具有TSH受體,能夠影響甲狀腺上皮細胞和濾泡細胞的生長〔9〕。對于TSH抑制程度,2009年ATA提出了具體的方案:對于高危組且腫瘤持續存在的患者,ATA建議將TSH抑制到<0.1 μIU/ml,而對于初治的低危組患者,ATA建議將TSH抑制到0.1~0.5 μIU/ml;對于高危組的無瘤隨訪期患者,ATA指南建議TSH維持在0.1~0.5 μIU/ml 5~10年;無病隨訪的低危組患者,ATA建議將TSH抑制于正常值下限水平〔10〕。而Tg是PTC接受全甲狀腺切除術的最有效的預后預測因素,有研究已表明,Tg、ATG、TSH水平可成為監測DTC術后復發及轉移的特異性指標〔11〕。
本文中的患者在甲狀腺癌根治術后長期服用優甲樂抑制治療,根據2015年ATA指南復發危險分層該患者術后屬于中危組患者,在第1次和第2次131I治療后的第1、2個月復查TSH均可以達到0.1 μIU/ml左右的標準,符合ATA指南中危組建議的TSH抑制目標。但該患者在2次治療前存在刺激性Tg>500 ng/ml的情況,表明該患者存在腫瘤活動性的證據,但該患者在第2次131I治療后行WBS為陰性,且門診隨訪期間Tg指標處于逐漸下降狀態(治療后第1、2個月Tg 分別為6.92及5.05 ng/ml),所以考慮患者TSH抑制治療是有效的。DTC隨訪中的血清Tg測定應包括TSH抑制狀態下和TSH刺激后的Tg測定,由于TSH抑制狀態下腫瘤細胞分泌Tg的能力可能也會受到抑制,故為更準確地反映病情,應通過停用L-T4或應用rhTSH的方法,使血清TSH水平升高至>30 mIU/L之后再進行Tg檢測,即TSH刺激后的Tg測定〔12〕。所以為了評估患者的具體情況,在第2次治療后4個月,再次對患者停用L-T4 28 d,復查甲狀腺功能示患者FT3、FT4處于正常水平且TSH小于0.1 μIU/ml,基本上處于未停用優甲樂的狀態,Tg 20.99 ng/ml,復查甲狀腺彩超均示頸部腫大淋巴結,且大小和數量與4個月前未見明顯變化。但患者體內的腫瘤產生Tg的能力在TSH抑制狀態下也可能被抑制的前提下選擇了第3次監測其刺激性Tg的水平,而本次患者的TSH卻并未升高,由此我們提出了以下幾點可能影響TSH的因素,并對其進行了分析討論:①患者未提供準確信息:患者TSH未升高很可能由于患者未停用L-T4而未提供準確的信息,但是該患者為我科依從性較好患者,且無精神障礙及神經系統相關疾病,醫務人員同時再三詢問患者和家屬,患者出現自行服用L-T4的可能性較小。②TSH檢測因素影響:患者3次測量停用L-T4情況下的TSH均于我院檢驗科測量,檢測儀器均為雅培i2000,檢測方法均為化學發光微粒子免疫檢測法,且第3次TSH未升高后進行了第2次的重復檢測并無太大出入。所以對TSH檢測因素的影響不予以考慮。③131I破壞垂體:一般來講多次131I治療后患者體內累積劑量>1 000 mCi才會出現組織器官的損傷,該患者累積劑量僅300 mCi。并且并未查閱到相關文獻存在131I可以破壞垂體的證據,所以這一點不予以考慮。④年齡較大患者垂體儲備功能降低:對于年齡較大的患者其垂體儲備功能低,也會導致停用左旋甲狀腺激素后出現TSH不及時上升的情況。但是本文患者為中年女性,所以這種情況不予以考慮。⑤垂體長期抑制狀態:如果患者的垂體長期處于被抑制的狀態,停用左旋甲狀腺激素后期功能恢復較慢。但是本文患者4個月前可正常增高,僅短期內出現TSH不上升的情況,所以這一點同樣不成立。⑥生物素影響:生物素(維生素H)為普遍存在的水溶性維生素,美國醫學研究所推薦的成年人每日攝入量為30 μg生物素。生物素對甲狀腺功能測試的干擾首先在1996年一項新生兒研究中被提出〔13〕。也有研究顯示對于多發性硬化患者應用治療劑量的生物素對甲狀腺功能會存在影響,該文章中應用生物素后患者出現TSH降低及T3、T4升高的情況〔13〕。生物素食物藥物來源:牛奶、牛肝、蛋黃、動物腎臟、草莓、柚子、葡萄、瘦肉、糙米、啤酒、小麥、復合維生素(善存)。本文患者第3次停用L-T4前未大劑量服用含生物素的食物或藥物,但是不排除患者未提供準確信息的情況,所以對于是否大量服用生物素無法確定,我們對此項保持懷疑的觀點。但是綜合患者的整體情況,沒有讓患者進行生物素的檢測,而是進一步行PET-CT明確病情。⑦轉移灶功能較強:患者第2次WBS陰性,表明轉移灶不攝取131I,但是患者在第2次和第3次停用左旋甲狀腺激素之間的4個月可能會存在轉移灶變異的情況,短期內失分化為分泌功能較強的轉移灶。但考慮到患者的綜合因素和病情我們沒有行全身碘顯像來驗證這一點。
基于以上幾種可能的情況,對患者提出了2點解決方案:①繼續停用優甲樂或應用rhTSH使TSH升高。但是患者這種情況是在第2次131I治療后WBS陰性情況下短短4個月后出現,TSH<0.1 μIU/ml,并不是TSH在停用優甲樂后存在TSH升高,但未達到行131I治療標準的情況,所以該患者繼續停用優甲樂TSH仍然不會升高。并且僅為了評估患者的病情,所以應用rhTSH意義不大。②行PET-CT明確病情:對于隨訪過程中出現不明原因的血清Tg升高而WBS陰性的患者,如果血清刺激性Tg水平>10 ng/ml,可考慮行18F-FDG PET-CT定位病灶〔14〕。所以建議該患者行PET-CT檢查,結果僅提示甲狀腺床區多枚FDG代謝增高小淋巴結考慮轉移瘤,未見遠處轉移。該患者PET-CT FDG陽性表達,有研究顯示FDG陽性的高糖代謝病灶通常不攝取碘,患者往往無法從131I治療獲益而改變其不良預后,此時應考慮131I之外的其他治療如手術、放療或靶向治療等〔15〕。因此,沒有考慮給患者應用rhTSH制劑來提高TSH水平,而是進行了外科手術治療,術后頸部淋巴結病理證實為甲狀腺乳頭狀癌轉移相關淋巴結。
Wang等〔16〕通過對近50年約3 000例患者的回顧性分析發現,約13%的甲狀腺癌術后轉移患者早期轉移灶內有131I的攝取,24個131I治療療程后轉移灶發生失分化不攝取131I,而18F-FDG顯像則呈陽性,提示甲狀腺癌細胞的分化程度降低,可能與鈉碘轉運體功能喪失有關。所以這個病例提示:①僅僅依靠術后病理診斷決定“復發危險分度”有時不可靠,本案例即要求臨床應結合TSH刺激下的甲狀腺球蛋白水平;②第2次手術后患者Tg仍未達到理想的下限,需要密切的隨訪和動態的精細化評估;③從本案例隨訪中TSH與Tg的變化關聯度看,L-T4 TSH抑制治療是非常必需和有效的。為此,對于沒有131I聚集能力的失分化腫瘤或轉移灶,恢復NIS表達,使其再分化,對甲狀腺癌的131I治療相當重要,當然對于可以手術切除的實質性病灶,手術切除是非常必要的。

