胃癌組織中LncRNA POU6F2-AS2的表達及意義
李理,潘兆軍,梁繼珍,王林
(廣州市紅十字會醫(yī)院·暨南大學(xué)醫(yī)學(xué)院附屬廣州紅十字會醫(yī)院,廣州 510000)
胃癌是常見的消化系統(tǒng)惡性腫瘤,發(fā)展中國家較為常見,全球每年新發(fā)病例約95萬,每年死亡病例約72萬[1]。胃癌早期臨床癥狀不明顯,多數(shù)患者確診時已處于中晚期,同時伴有局部侵襲和淋巴結(jié)轉(zhuǎn)移,患者病死率較高,預(yù)后較差[2]。因而深入研究胃癌發(fā)生發(fā)展的機制,尋找新的早期診斷治療腫瘤標志物十分必要。長鏈非編碼RNA(LncRNA)是一類長度大于200個核苷酸的RNA調(diào)控分子,可分為基因內(nèi)LncRNA、基因間LncRNA,正義LncRNA及反義LncRNA等多種類型,在多個層次調(diào)控基因表達,如其可結(jié)合靶基因啟動子區(qū)抑制基因轉(zhuǎn)錄、作為染色質(zhì)修飾因子介導(dǎo)染色質(zhì)重構(gòu)及結(jié)合信使RNA的初級轉(zhuǎn)錄本抑制翻譯過程等[3]。近年研究表明,LncRNA參與炎癥、腫瘤、心血管疾病及自身免疫等疾病的發(fā)生發(fā)展過程[4,5]。POU6F2-AS2為LncRNA的一種,其位于7p14.1,有7個外顯子,其可編碼產(chǎn)生LncRNA POU6F2-AS2。近年研究表明,LncRNA POU6F2-AS2參與腫瘤的調(diào)控過程,如在食管癌中發(fā)現(xiàn)LncRNA POU6F2-AS2特異性表達升高,LncRNA POU6F2-AS2與Ybx1蛋白相互作用,調(diào)控Ybx1蛋白染色質(zhì)定位,進而調(diào)控DNA損傷修復(fù)反應(yīng),促進細胞的存活[6]。本研究通過檢測胃癌組織中LncRNA POU6F2-AS2表達,分析其與臨床病理特征及預(yù)后的關(guān)系,探討其臨床意義。
1 資料與方法
1.1 臨床資料 收集2015年1月~2016年1月于我院診治的82例行手術(shù)治療的胃癌患者。納入標準:①患者均經(jīng)術(shù)后病理檢查確診為胃腺癌;②均為初次診治,既往未接受過放化療等治療;③臨床病理及隨訪資料完整,患者及家屬均知情同意并已簽署知情同意書;④患者預(yù)期壽命≥10年。排除標準:①合并其他惡性腫瘤病史;②合并嚴重的心肺肝腎等臟器功能不全;③合并類風(fēng)濕關(guān)節(jié)炎等免疫系統(tǒng)疾病。其中男45例、女37例,年齡25~88(58.3±7.3)歲;伴淋巴結(jié)轉(zhuǎn)移38例,無淋巴結(jié)轉(zhuǎn)移44例;腫瘤直徑:<5 cm 47例,≥5 cm 35例;腫瘤位置:賁門胃底部16例,胃體部14例,幽門胃竇部52例;腫瘤TNM分期:Ⅰ期15例,Ⅱ期21例,Ⅲ期41例,Ⅳ期5例;組織學(xué)分化程度:高中分化43例,低分化39例。隨訪起始時間2015年1月,以門診或電話方式隨訪,隨訪內(nèi)容包括患者生存情況及疾病控制情況,無失訪病例,隨訪終止日期為2019年1月。
1.2 胃癌組織中LncRNA POU6F2-AS2表達檢測 采用實時熒光定量PCR(qRT-PCR)法對胃癌組織及癌旁(距離癌組織5 cm以上)正常胃黏膜組織中LncRNA POU6F2-AS2表達進行檢測。收集術(shù)中新鮮獲取的癌組織及癌旁組織,凍存管內(nèi)液氮速凍,轉(zhuǎn)運至實驗室后置于-80 ℃冰箱保存。分別取約50 mg組織,將組織冰上研磨后加入1 mL的TRIzol試劑,應(yīng)用TRIzol法提取組織中總RNA,以總RNA為模板,用反轉(zhuǎn)錄試劑盒進行反轉(zhuǎn)錄,合成cDNA,分光光度計鑒定cDNA純度,使A260/A280=1.9~2.1,-20 ℃冰箱保存待測。反應(yīng)條件:16 ℃ 30 min,42 ℃ 30 min,85 ℃ 5 min。TRIzol試劑及試劑盒均購自美國Invitrogen公司,實驗步驟嚴格按照反轉(zhuǎn)錄試劑盒說明書進行。2×SYBR Green PCR Master Mix試劑盒檢測LncRNA POU6F2-AS2的表達。LncRNA POU6F2-AS2正向引物:5′-CATACTGAGCACTGTCTGA-3′,反向引物:5′-CTGTGTCCAATACTCCTTCT-3′,內(nèi)參基因GAPDH正向引物:5′-GGGAGCCAAAAGGGTCAT-3′,反向引物:5′-GAGTCCTTCCACGATACCAA-3′。熒光定量PCR反應(yīng)體系:2×SYBR Green PCR Master Mix 10 μL,正反向引物各0.5 μL,模板2 μL,加RNAase-free的雙蒸水補足體系。反應(yīng)條件:50 ℃ 2 min,95 ℃ 10 min,95 ℃ 15 s,60 ℃ 1 min,40個循環(huán)。所有反應(yīng)于ABI7500實時定量PCR儀上完成,每個樣本重復(fù)3次。采用相對Ct值方法進行數(shù)據(jù)分析,目的基因LncRNA POU6F2-AS2的相對表達量應(yīng)用2-ΔΔCt法計算。
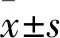
2 結(jié)果
2.1 胃癌組織與癌旁組織中LncRNA POU6F2-AS2表達比較 胃癌組織與癌旁組織中LncRNA POU6F2-AS2相對表達量分別為1.203±0.341、0.210±0.076,胃癌組織中LncRNA POU6F2-AS2的相對表達量高于癌旁組織(t=37.178,P=0.000)。
2.2 胃癌組織中LncRNA POU6F2-AS2表達與患者臨床病理特征的關(guān)系 胃癌組織中LncRNA POU6F2-AS2表達與腫瘤分期及組織學(xué)分級有關(guān)(P均<0.05),而與患者性別、年齡、腫瘤直徑、腫瘤位置及是否淋巴結(jié)轉(zhuǎn)移無關(guān)(P均>0.05)。腫瘤分期Ⅲ~Ⅳ期、低分化癌組織中LncRNA POU6F2-AS2表達分別高于腫瘤分期Ⅰ~Ⅱ期、高中分化癌組織(P均<0.05),見表1。
2.3 不同LncRNA POU6F2-AS2表達水平與患者生存預(yù)后的關(guān)系 患者均完成隨訪,隨訪時間2~48(32.1±6.7)個月,以胃癌組織中LncRNA POU6F2-AS2的相對表達量的中位數(shù)1.205為臨界值,其中高LncRNA POU6F2-AS2表達組43例,低LncRNA POU6F2-AS2表達組39例。高LncRNA POU6F2-AS2表達組、低LncRNA POU6F2-AS2表達組3年生存率分別為34.9%(15/43)、61.5%(24/39),兩組3年生存率比較差異有統(tǒng)計學(xué)意義(χ2=3.974,P=0.046),見圖1。

表1 胃癌組織中POU6F2-AS2表達與患者臨床病理特征的關(guān)系

圖1 不同LncRNA POU6F2-AS2表達水平患者3年生存率比較
3 討論
胃癌是常見的嚴重威脅人類健康的消化系統(tǒng)惡性腫瘤,發(fā)病率及病死率較高。我國胃癌疾病負擔(dān)重,發(fā)病和死亡病例數(shù)約占世界的50%[7]。近年來,隨著胃癌研究機制的不斷深入,新的分子靶向治療、免疫治療及聯(lián)合化療在晚期胃癌的治療中取得良好效果[8]。因此尋找個體化、多學(xué)科聯(lián)合的診斷治療模式是胃癌診治發(fā)展的趨勢。目前胃癌的發(fā)生發(fā)展機制尚不清楚,深入研究其發(fā)病機制,有助于胃癌患者的早期診斷、治療選擇及預(yù)后判斷。
基因組的非編碼序列占97%,其可表達非編碼RNA,以往認為是翻譯過程中的“垃圾信息”,但近年來大量研究表明,非編碼RNA在發(fā)育、代謝、分化及進化過程中發(fā)揮重要的調(diào)節(jié)作用[9]。根據(jù)非編碼RNA核苷酸長度,可分為小的非編碼RNAs(<200 nt)和長的非編碼RNAs(>200 nt)。反義長鏈非編碼RNA(AS)是從非蛋白編碼基因的相反鏈上轉(zhuǎn)錄而來。LncRNA在調(diào)節(jié)生物學(xué)活動時的作用方式具有多樣性,如可調(diào)節(jié)染色質(zhì)重塑、轉(zhuǎn)錄、轉(zhuǎn)錄后修飾等過程,影響炎癥、自身免疫及腫瘤等疾病的發(fā)生發(fā)展過程[10]。近年來研究發(fā)現(xiàn),LncRNA POU6F2-AS2在惡性腫瘤中表達升高,促進腫瘤細胞的增殖、侵襲、抑制凋亡等生物學(xué)作用,促進腫瘤的發(fā)生發(fā)展過程,導(dǎo)致患者不良的臨床預(yù)后[6]。本研究中,胃癌組織中LncRNA POU6F2-AS2的相對表達量高于癌旁組織,差異有統(tǒng)計學(xué)意義,與以往研究報道一致[11]。目前其表達升高的機制尚不清楚,可能是胃癌腫瘤微環(huán)境中淋巴細胞、腫瘤相關(guān)巨噬細胞等分泌產(chǎn)生IL-6、TNF-α等細胞因子,通過相應(yīng)的細胞信號傳導(dǎo)通路,促進腫瘤細胞LncRNA POU6F2-AS2基因的表達,導(dǎo)致LncRNA POU6F2-AS2基因表達增加[12,13]。此外,癌組織中LncRNA POU6F2-AS2表達與腫瘤分期、組織學(xué)分級有關(guān),低分化、腫瘤分期Ⅲ~Ⅳ期癌組織中LncRNA POU6F2-AS2表達明顯升高,表明癌組織中LncRNA POU6F2-AS2表達參與腫瘤的發(fā)生發(fā)展過程。其機制一方面是LncRNA POU6F2-AS2作為內(nèi)源競爭性RNA能抑制下游靶基因如SOX4等的表達[14],SOX4等轉(zhuǎn)錄因子表達增加能促進腫瘤細胞增殖、浸潤、遷徙及黏附能力增強,促進腫瘤的遠處轉(zhuǎn)移[15]。另一方面,LncRNA POU6F2-AS2可能促進腫瘤細胞發(fā)生上皮間質(zhì)轉(zhuǎn)化,促進腫瘤的惡性進展。在宮頸癌中LncRNA HOXA11能促進上皮間質(zhì)轉(zhuǎn)化的關(guān)鍵轉(zhuǎn)錄因子如鋅指轉(zhuǎn)錄因子(Snail)、E盒結(jié)合鋅指蛋白1(ZEB1)等的表達,促進腫瘤細胞的侵襲和浸潤,而在RNA干擾LncRNA HOXA11基因表達后腫瘤細胞的侵襲和浸潤能力下降[16]。胃癌發(fā)生發(fā)展過程中存在大量差異表達的LncRNA,如HOX轉(zhuǎn)錄反義RNA(HOTAIR)、生長特異抑制物5(GAS5)等,在胃癌中參與各自不同的調(diào)控過程[17],因此在復(fù)雜的RNA調(diào)控網(wǎng)絡(luò)中尋找關(guān)鍵的LncRNA,指導(dǎo)臨床診斷、治療及預(yù)后具有重要的意義。本研究中高LncRNA POU6F2-AS2表達患者3年OS明顯低于低LncRNA POU6F2-AS2表達患者,表明LncRNA POU6F2-AS2有可能成為預(yù)測患者預(yù)后的生物學(xué)標志。但目前LncRNA POU6F2-AS2調(diào)控胃癌發(fā)生發(fā)展及預(yù)后的具體作用機制尚不清楚,有待進一步深入研究。
綜上所述,胃癌患者癌組織中LncRNA POU6F2-AS2表達升高,檢測胃癌組織中Lnc RNA POU6F2-AS2表達有助于胃癌患者的病情評估及預(yù)后判斷。

