奧貝膽酸聯合白藜蘆醇治療非酒精性脂肪性肝病小鼠的效果觀察
姜良勇,谷斌,齊亞軍,殷儷寧,馬偉銘,周奎臣
(1佳木斯大學,黑龍江佳木斯 154007;2佳木斯大學附屬第一醫院;3山東第一醫科大學·山東省醫學科學院)
非酒精性脂肪性肝病(NAFLD)是一種除乙醇因素外以肝細胞彌漫性脂肪樣變和脂肪過量沉積為主要臨床特征,與多種代謝紊亂相關的慢性肝臟疾病[1]。據統計,NAFLD的全球發病率為3%~5%,糖尿病和肥胖患者中20%~30%會引起脂肪性肝炎(NASH),69%~87%會患有NAFLD[2]。NAFLD常伴有ALT、AST、TG、TC、LDL-C和HDL-C等生化指標的明顯升高及B超、組織病理學的變化。NAFLD發生脂肪變性常引起NASH,繼發肝纖維化、肝硬化和肝細胞癌(HCC)[3,4]。奧貝膽酸(OCA)是一種強效選擇性法尼醇X受體(FXR)激動劑,而FXR通過間接抑制細胞色素P450家族中膽固醇7-α-羥化酶(CYP7A1)對膽汁酸合成的調節,進而抑制膽汁酸合成[5]。FXR被活化后可下調固醇調節元件結合蛋白-1c(SREBP-1c)表達[6],從而減少肝臟脂肪生成。因而,OCA能顯著減少肝臟脂肪變性,改善肝纖維化[7,8],在治療NASH方面Ⅲ期臨床實驗效果較好[9]。但OCA有致瘙癢及潛在致心血管疾病風險的不良反應[10,11],研發進度受限。白藜蘆醇(RSV)是一種天然的多酚類化合物,廣泛存在于花生、葡萄、桑椹等植物中。RSV具有降低血小板聚集[12],預防和治療動脈粥樣硬化、心腦血管疾病[13,14]等作用。研究[15,16]表明,RSV臨床治療效果較好,可通過PPARα途徑、恢復溶酶體功能和自噬通量等多種機制,改善脂代謝穩態和氧化還原平衡,繼而預防NAFLD。2019年3月,我們將OCA和RSV聯用治療NAFLD小鼠,以期RSV在原有療效不變的情況下,OCA的不良作用能得到改善或消除,治療NAFLD的同時能降低血脂,保護心腦血管。
1 材料與方法
1.1 材料 SPF級C57BL/6Cnc小鼠37只,雄性,體質量19~22 g,日齡42~62 d,購自北京維通利華實驗動物技術有限公司[實驗動物使用許可證號為SCXK (京) 2016-0006]。實驗藥品和試劑:OCA(廈門海樂景生化有限公司,批號:171201);RSV(上海邁瑞爾化學技術有限公司,批號:70837024);高脂模型飼料[百事創新(北京)科技有限公司,批號:19032504HS2.5];羧甲基纖維素鈉(天津市大茂化學試劑廠,批號:20181006);吐溫-20(國藥集團化學試劑有限公司,批號:20090327);CCl4(國藥集團化學試劑有限公司,批號:20180228);甲醛溶液(國藥集團化學試劑有限公司,批號:150422);無水乙醇(國藥集團化學試劑有限公司,批號:20180426);橄欖油[嘉里糧油(天津)有限公司,批號:B20180423X];丙氨酸氨基轉移酶(ALT)、天冬氨酸氨基轉移酶(AST)、堿性磷酸酶(ALP),美國貝克曼庫爾特有限公司全自動生化分析儀配套試劑盒,批號分別為AUZ5326、AUZ5173、AUZ5653;甘油三酯(TG)、總膽固醇(TC)、游離脂肪酸(FFA) 試劑盒購于南京建成生物工程研究所,批號分別為20190228、20190301、20190510。實驗儀器:JNM-ECA-400超導核磁共振儀(日本電子株式會社);API-150(ESI)質譜儀(美國ABI公司);yz-9502醫用冷藏冰箱(中科美菱低溫科技有限責任公司);KZ-Ⅱ勻漿儀(賽維爾生物科技有限公司);PL-203電子天平[梅特勒-托利多儀器(上海)有限公司];AU5800全自動生化分析儀(美國貝克曼庫爾特有限公司);電恒溫培養箱(天津市泰斯特儀器有限公司);D3024R臺式高速冷凍型微量離心機[大龍興創實驗儀器(北京)有限公司];Rt2100c酶標檢測儀(美國Rayto);NanoDrop2000超微量分光光度計(美國Thermo);SW-CJ-1FD超凈工作臺;FBZ2001-up-p標準試劑型純水儀(青島富勒姆科技有限公司)。
1.2 動物分組及NAFLD模型的建立 將雄性C57小鼠37只適應性飼喂,飼養期間保持周圍環境安靜,溫度(22±2)℃,相對濕度50%~60%,自由攝食飲水。6 d后隨機分為6組,即空白對照組(CON組)、NAFLD模型組(MOD組)、OCA組、RSV組、聯合用藥低劑量組(OCA+RSV-L組)和聯合用藥高劑量組(OCA+RSV-H組),除MOD組7只小鼠外,其余每組6只小鼠。給予CON組小鼠腹腔注射同等體積的質量分數0.9%氯化鈉溶液,其余各組小鼠在第1天、第4天、第8天、第12天、第16天、第20天腹腔注射低劑量體積分數0.03% 的CCl4橄欖油混合溶液,每天除CON組小鼠飼喂正常維持飼料外,其余各組小鼠均飼喂高脂飼料造模,各組小鼠自由飲水,每周稱1次體質量,連續飼喂4周后,于第28天尾靜脈取血,檢測小鼠血清TG、TC 水平,初步篩查其是否造模成功。
1.3 給藥方法及取材 誘導小鼠形成NAFLD模型后,繼續給予適當的高脂飼料,每天 12:00 ,CON組和MOD組灌服0.5%CMC-Na 溶液0.2 mL/次,OCA組、RSV組、 OCA+RSV-L組和OCA+RSV-H組分別以0.04、1.33、(0.04+0.02)和(2.45+1.33)mg/d劑量的0.5%CMC-Na混懸液灌胃(劑量設置依據按OCA和RSV推薦劑量及中毒劑量折算成小鼠與人的等效劑量,并以實驗驗證),連續給藥4周。每周稱1次體質量,在同時連續給脂給藥4周后,停脂不停藥2 d,禁食(不禁水)12 h至次日8:00,然后摘除小鼠眼球取血,收集血液,3 500 r/min離心10 min,取上清,用于測定血清學指標;將小鼠麻醉后處死,剖取肝臟和脾臟后進行稱量,計算肝指數;取肝右葉相同部位組織用4%的甲醛溶液固定后用于病理學檢查;同時取肝左葉相同部位的肝組織,加適量無水乙醇制備10%肝組織勻漿液,用于肝脂質指標的檢測,于-80 ℃保存備用。
1.4 肝指數和肝脂質測定 取完整肝臟后進行稱重,并按下列公式[肝指數=肝濕重(g)/體質量(g)×100%]計算肝指數。準確稱取肝組織100 mg,按照重量(mg)∶體積(μL)=1∶9的比例,加入9倍體積的勻漿液(無水乙醇) 900 μL,使用KZ-Ⅱ勻漿儀碾磨2 min后以 2 500 r/min離心10 min,取上清液用酶標檢測儀測定TC、TG和FFA,分別按照TC、TG和FFA試劑盒說明書上提供的步驟及方法進行操作。
1.5 小鼠肝功能和血脂生化指標檢測 用藥4周后采集小鼠血液標本,待血液凝固約0.5 h后,3 500 r/min離心10 min取上清。采用貝克曼庫爾特AU5800全自動生化分析儀對CON組、MOD組、OCA組、RSV組、OCA+RSV-L組和OCA+RSV-H組小鼠血清進行檢測,包括ALT、AST、ALP、TG、TC、LDL-C和HDL-C等肝功能和血脂生化指標。
1.6 肝組織病理學檢查 取肝右葉相同部位的肝組織,用4%的甲醛溶液固定,石蠟包埋、切片,HE染色,光學顯微鏡下觀察小鼠肝臟組織病理學變化。取同一位置肝組織,制備冷凍切片,油紅O染色,光學顯微鏡下400倍視野下觀察小鼠肝臟脂質分布情況。挑選每組內每張切片200倍視野下進行拍照,拍照時盡量讓組織充滿整個視野,保證每張照片的背景光一致。應用Image-Pro Plus 6.0軟件,分別測量區域紅色脂滴像素面積及脂滴面積百分率。
2 結果
2.1 OCA和RSV聯用對小鼠瘙癢癥的影響 在給造模小鼠進行不同藥物治療過程中發現,與CON組比較,MOD組和其他四組小鼠皮膚松弛,毛色暗淡稀疏。與MOD組比較,OCA組有4只小鼠腰背部和(或)面部出現抓撓啃食引起脫毛,瘙癢率66.7%;其余各組小鼠均未出現脫毛現象。
2.2 OCA和RSV聯用對小鼠肝指數的影響 與CON組比較,MOD組體質量和肝濕重均減輕(P均<0.05),而肝指數增加(P均<0.01)。與MOD組比較,OCA組、RSV組和OCA+RSV-L組的肝指數減少(P均<0.05);而OCA+RSV-H組的肝指數變化不明顯(P>0.05)。OCA+RSV-L組較OCA組肝指數減少(P<0.01);OCA+RSV-H組的體質量和肝濕重較RSV組均有所增加(P<0.05)。見表1。

表1 各組小鼠肝濕重和肝指數比較
注:與CON組比較,aP<0.05;與MOD組比較,bP<0.05;與OCA組比較,cP<0.05;與RSV組比較,dP<0.05;與OCA+RSV-L組比較,eP<0.05。
2.3 OCA和RSV聯用對小鼠肝脂質的影響 與CON組比較,MOD組小鼠肝內TG和TC水平升高(P均<0.05)。與MOD組比較,RSV組小鼠肝內TC水平降低(P<0.05);OCA+RSV-H組小鼠肝內TG和TC水平降低(P均<0.01);OCA+RSV-L組小鼠肝內TG水平降低(P<0.05),而OCA組小鼠肝內TG和TC水平變化均不明顯(P均>0.05),RSV組小鼠肝內TG水平變化不明顯(P>0.05),各組小鼠肝內FFA水平比較差異無統計學意義(P均>0.05)。OCA+RSV-H組較OCA組TC水平降低(P<0.01);OCA+RSV-L組較RSV組FFA水平升高(P<0.05),OCA+RSV-H組較RSV組TG水平降低(P<0.01)。見表2。
2.4 OCA和RSV聯用對小鼠肝功能及血清生化指標的影響 與CON組比較,MOD組小鼠血清ALT、AST、ALP水平升高(P均<0.01)。與MOD組比較,OCA組、RSV組、OCA+RSV-L組和OCA+RSV-H組小鼠血清ALT、AST和ALP水平均降低(P均<0.01)。OCA+RSV-L組和OCA+RSV-H組較OCA組和RSV組血清肝功能指標呈降低趨勢,但差異無統計學意義。OCA+RSV-L組和OCA+RSV-H組比較,OCA+RSV-H組血清ALT水平降低(P<0.05)。見表3。
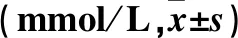
表2 各組小鼠肝10%勻漿液中TG、TC、FFA水平比較
注:與CON組比較,aP<0.05;與MOD組比較,bP<0.05;與OCA比較,cP<0.05;與RSV比較,dP<0.05;與OCA+RSV-L組比較,eP<0.05。

表3 各組小鼠血清ALT、AST、ALP水平比較
注:與CON組比較,aP<0.05;與MOD組比較,bP<0.05;與OCA+RSV-L組比較,cP<0.05。
2.5 OCA和RSV聯用對小鼠血脂生化指標的影響 與CON組比較,MOD組小鼠血清TG、TC、LDL-C水平升高(P均<0.05),血清LDL-C/ HDL-C值增大(P<0.001)。與MOD組比較,OCA組、RSV組和OCA+RSV-L組血清TC水平降低(P均<0.01),而OCA+RSV-H組血清TC水平降低更顯著(P<0.001),各組小鼠血清TG和LDL-C水平均降低(P<0.001);OCA組、RSV組、OCA+RSV-L組、OCA+RSV-H組血清LDL-C/ HDL-C值和血清HDL-C水平均增加(P均<0.001)。OCA+RSV-L組較OCA組LDL-C/HDL-C百分數減少(P<0.001),OCA+RSV-H組較OCA組TG水平降低(P<0.05);OCA+RSV-H組LDL-C水平和LDL-C/HDL-C值較RSV組均下降(P均<0.01)。見表4。
2.6 OCA和RSV聯用對小鼠肝組織形態學的影響 CON組小鼠肝小葉結構清晰,肝索排列整齊,肝細胞胞質豐富、形態結構正常,肝竇未見明顯擴張或擠壓,未見明顯炎癥;MOD組小鼠肝組織中可見大量肝細胞脂肪變性,胞質中可見大小不一的圓形空泡,多見肝細胞水腫,胞質疏松淡染,少量肝細胞水腫至氣球樣變性,細胞腫脹,核居中,胞質空泡化,多見中央靜脈與門靜脈周圍有少量淋巴細胞與中性粒細胞浸潤,并多見脂褐素沉積;OCA和RSV組小鼠的肝臟組織脂肪變性略有改善,但仍可見大量肝細胞脂肪變性,胞質中可見大小不一的圓形空泡;多見中央靜脈與門靜脈周圍有少量淋巴細胞浸潤,局部可見較多脂褐素沉積,并伴有巨噬細胞吞噬;而OCA+RSV-L組和OCA+RSV-H組的小鼠肝臟組織病理形態顯著改善,但伴有肝細胞水腫和組織中匯管區膽管周圍有較多淋巴細胞與中性粒細胞浸潤,并可見較多脂褐素沉積,伴有巨噬細胞吞噬。CON組、MOD組、OCA組、RSV組、OCA+RSV-L組、OCA+RSV-H組小鼠肝內脂滴面積百分比分別為(56.71±2.47)%、(68.27±4.61)%、(67.98±12.08)%、(63.71±9.13)%、(23.73±6.97)%、(2.13±0.57)%,與CON組比較,MOD組小鼠肝內脂滴面積百分比增加(P<0.05)。與MOD組比較,OCA+RSV-L組、OCA+RSV-H組小鼠肝內脂滴面積百分比減少(P均<0.05)。OCA+RSV-L組和OCA+RSV-H組較OCA組、RSV組肝內脂滴面積百分比減少(P均<0.05);OCA+RSV-H組肝內脂滴面積百分比較OCA+RSV-L組減少(P<0.05)。

表4 各組小鼠血脂生化指標水平比較
注:與CON組比較,aP<0.05;與MOD組比較,bP<0.05;與OCA組比較,cP<0.05;與RSV組比較,dP<0.05;與OCA+RSV-L組比較,eP<0.05。
3 討論
近年來,NAFLD患病率已持續升高約20倍,現已成為一種常見的慢性肝病。有關NAFLD的確切發病機制尚未闡明,目前仍處在假說和爭論階段。“二次打擊”學說是解釋NAFLD發病機制的傳統經典理論,該理論認為,“第一次打擊”是胰島素抵抗(IR)和肝脂質代謝障礙所導致的肝脂肪變性,“第二次打擊”則是各種原因導致的氧化應激和脂質過氧化損傷引起肝細胞炎癥浸潤和肝纖維化。當前,諸多研究數據顯示,NAFLD/NASH會對患者的壽命及生活質量產生不良影響,目前NAFLD的治療主要圍繞生活方式改變、身體活動和一般的醫療干預等[17]。然而,患者很難進行長期的生活方式改變和身體活動,而市場上尚無治療NAFLD和NASH的特效藥物。OCA與天然降脂藥物RSV聯合應用干預NAFLD,可能是一種具有較好前景和效益的方法。RSV調節脂質代謝用于治療和預防心腦血管疾病[18],但很少報道其降低膽固醇的潛力。
高甘油三酯血癥、高膽固醇血癥、高LDL-C水平和低HDL-C水平是肝脂肪變性患者脂代謝平衡中最常見的損傷因素[19]。經過CCl4誘導高脂飲食的NAFLD動物模型是已被廣泛用于鑒定其發病機制并評估NAFLD用藥療效的通用做法。在我們的模型中,CCl4誘導高脂飲食的小鼠出現肝臟脂肪變性,臟器脂肪堆積,高脂血癥和FFA增加,此近乎模擬了人類NAFLD的全部臨床癥狀表現。本研究結果顯示,OCA+RSV-L組、OCA+RSV-H組小鼠的瘙癢比例減少,肝指數顯著改善,小鼠肝功能指標ALT、AST、ALP等降低,表明OCA與RSV聯用可保肝護肝。此外,我們觀察到OCA或RSV單獨用藥和OCA+RSV聯合用藥血清TG、TC和LDL-C水平均出現下降,OCA和RSV聯用有效干預了CCl4誘導高脂飲食小鼠的NAFLD發展,且與OCA或RSV單獨用藥相比,OCA和RSV聯合給藥的效果更顯著。而與MOD組相比,OCA+RSV-L組、OCA+RSV-H組小鼠血清中HDL-C水平明顯升高。鑒于LDL-C /HDL-C值與冠心病的風險呈正相關[20],提示OCA或RSV單獨用藥和OCA+RSV聯合用藥具有抗動脈粥樣硬化的潛力。
本研究結果顯示,與MOD組相比,OCA+RSV-L組、OCA+RSV-H組可抑制TG、TC、FFA和LDL-C代謝合成。OCA+RSV-L組、OCA+RSV-H組小鼠肝臟內TG和TC水平均出現顯著下降,其療效優于OCA組或RSV組。同時,組織病理學結果表明,OCA+RSV聯用可顯著預防CCl4誘導的高脂飲食小鼠肝臟脂質積聚,HE染色和油紅O染色觀察分析可知,OCA+RSV-L組、OCA+RSV-H組小鼠NAFLD明顯改善。該療效與TG、TC和LDL-C的降低及HDL-C水平升高呈正相關,互相印證。表明CCl4誘導的高脂飲食小鼠通過下調血漿和肝臟中的脂質積累,抑制IR和維持脂代謝平衡,緩解肝臟脂肪變性程度。因此,OCA和RSV聯合使用可能是通過影響脂肪動員來改善血脂水平,同時,通過促進肝臟內TC的代謝來減少膽固醇合成,最終達到改善NAFLD的目的。
綜上所述,OCA和RSV聯用能改善NAFLD小鼠肝功能、降低血脂水平及改善肝組織病理學變化,有效干預CCl4誘導的高脂飲食小鼠NAFLD發展,可作為降低動脈粥樣硬化和心腦血管疾病風險的潛在治療藥物,有提高NAFLD治愈療效的潛力。

