楊柳田頭菇YAAS711菌株F1子代胞外酶活性分析
周會明,趙永昌,柴紅梅,張焱珍
楊柳田頭菇YAAS711菌株F1子代胞外酶活性分析
周會明1,2,趙永昌2,柴紅梅2,張焱珍1,2
(1滇西科技師范學院生物技術與工程學院,云南臨滄 677000;2云南省農業科學院生物技術與種質資源研究所,昆明 650205)
【】探究楊柳田頭菇YAAS711菌株的單孢菌株及其自交個體的胞外酶活性變化規律,為其遺傳育種提供理論依據。以楊柳田頭菇YAAS711的18個單核體與22個自交雙核體為試驗材料,分別采用3, 5-二硝基水楊酸(DNS)法、福林法、愈創木酚法等測定羧甲基纖維素酶、濾紙纖維素酶、β-葡萄糖苷酶、半纖維素酶、淀粉酶、蛋白酶、漆酶、多酚氧化酶、過氧化物酶9種胞外酶活性,并對這9種胞外酶與子代生長速度、極性和交配因子進行相關性分析。單核體和雙核體絕大多數都具有較高的淀粉酶、濾紙纖維素酶、半纖維素酶、β-葡萄糖苷酶、羧甲基纖維素酶及蛋白酶活性,過氧化物酶、多酚氧化酶及漆酶活性卻較低。9種胞外酶平均活力與單核體和雙核體的菌絲生長速度均存在一定程度的相關性,除部分類型Ⅱ單核體外,菌絲生長速度較快的單核體具有較高的胞外酶活性;反之,胞外酶活性較低。相比單核體菌絲生長速度“快-快”的組合,單核體菌絲生長速度“快-慢”的組合除半纖維素酶、蛋白酶和多酚氧化酶外,其他胞外酶活性都較高。具有類型Ⅱ單核體參與形成的雙合體胞外酶活性卻各不相同且無規律。多酚氧化酶對單核體菌絲生長速度的間接影響大于漆酶,但漆酶對單核體菌絲生長速度的綜合作用最大;胞外酶之間的協同作用對雙核體菌絲生長速度影響較小,其中漆酶對其菌絲生長速度直接作用最大。多重比較結果顯示,在顯著水平為0.05上,極性對胞外酶平均活力的影響大于交配因子。單核體菌絲生長速度與本極性異常和楊柳田頭菇YAAS711子代個體胞外酶活性差異存在顯著相關性,除部分類型Ⅱ單核體和雙核體外,類型Ⅰ菌株胞外酶活性具有相同的規律。單核體菌絲生長速度、極性、胞外酶三者之間具有一定的相關性,但交配因子與胞外酶沒有直接相關性。
楊柳田頭菇;自交后代;胞外酶活性;單核體;雙核體
0 引言
【研究意義】楊柳田頭菇()隸屬于真菌界、擔子菌亞門、傘菌綱、傘菌亞綱、傘菌目、球蓋菇科、田頭菇屬[1-2],其生長于亞熱帶地區柳樹上,具有外觀美、肉質嫩、味道鮮、口感佳等優點,為中國云南省特有的珍稀食用菌。雖然該菌人工栽培出菇,但農藝性狀較差,由于資源的稀缺性及遺傳育種相關的基礎研究不多,開展楊柳田頭菇YAAS711菌株F1子代胞外酶活性分析研究對雜交親本選擇具有指導意義。【前人研究進展】目前,對楊柳田頭菇的一些研究主要集中在形態觀察[3-4]、分子生物學鑒定[5]、菌株馴化[6]、生物活性物質分離[7-9]、轉錄組比較[10]、交配基因分析[11]、交配型測定[12]、品種選育[13]等方面,但缺少必要的生理生化基礎研究。楊柳田頭菇市場需求較大,人工種植比較容易,但從野生子實體中分離出來的菌株,因其農藝性狀不穩定,無法應用于商業化生產用種,選育雜交品種成為其推廣的當務之急。親本的生理特性對雜交后代的影響極為重要,該研究為品種的馴化和優良菌株的選擇提供足夠的理論支持。胞外酶是一類產生于細胞內而在細胞外發揮作用的酶,其活性大小與食用菌種類和培養基質密切相關[14]。食用菌在整個生長發育階段可向培養基質中分泌多種胞外酶,這些酶可將培養基中的大分子物質(纖維素、半纖維素、木質素、淀粉、果膠、蛋白質等)水解成小分子物質供菌絲吸收和利用[15]。通過對食用菌胞外酶活性的研究,可以了解各種食用菌在不同發育階段的胞外酶分泌特點、活性大小及動態變化趨勢[16],推測不同食用菌對培養基質中木質纖維素、淀粉等大分子營養成分的降解動態,對提高其栽培技術具有重要意義。目前在榆黃蘑()[17]、黃孢原毛平革菌()[18]、雅致栓孔菌()[19]、平菇(spp.)[20]、巴爾喀什蘑菇()[21]、蜜環菌(spp.)[22]、玉木耳()[23]、紅托竹蓀()[24]、茶樹菇()[25]、白靈側耳()[26]等大型真菌的胞外酶活性已開展了研究,上述食用菌胞外酶與其生長發育密切相關。【本研究切入點】雜交育種的難點是親本選擇,多數的雜交育種研究都是隨機選擇,不僅工作量大,也具有較大的盲目性。在前期的研究中發現單孢菌株群體在生長速度上有較大的差異,組合配對的雙核體生長與單核體存在某種關系,一般而言,菌絲的生長速度與基質利用(即分泌胞外酶降解基質)相關。有關雙核體胞外酶與兩單核體親本之間的關系研究未見報道,探索單核體交配極性、交配因子和胞外酶活性對形成的雙核體胞外酶活性的影響,將為雜交育種的親本定向選擇奠定基礎。楊柳田頭菇不同極性單核菌株的胞外酶活性至今尚未報道,筆者對該菇的前期研究工作表明,菌株YAAS711分離的單核體在直徑為90 mm的培養皿YPD培養基上培養,根據其生長速度分為生長快型(F:2.2—3.5 mm?d-1)和生長慢型(S:1.2—1.4 mm?d-1)兩類,單孢菌株群體中每種極性都有生長速度快慢之分,生長速度極慢的單核菌株幾乎集中在一種交配型AyBy中[12]。按生長速度將每種極性中的單孢菌株分為兩類,數量多的為I型菌株(包括生長速度快(F)的AxBx、AxBy、AyBx和生長速度慢(S)的AyBy),數量少的為II型菌株(包括生長速度慢()的AxBx、AxBy、AyBx和生長速度快()的AyBy)。【擬解決的關鍵問題】以I型菌株中F×F和F×S組合為對照,對II型中或單孢菌株進行組合,共形成6種雙核體組合,對18個單核體與22個雙核體的9種胞外酶活性進行測定與分析,找出楊柳田頭菇單核體與雙核體胞外酶活性變化規律。
1 材料與方法
1.1 單核體與雙核體
楊柳田頭菇菌株YAAS711由采集于云南省香格里拉市的野生子實體分離得到,試驗用的成熟子實體在云南省農業科學院生物技術與種質資源研究所實驗室通過袋栽法獲得。無菌條件下,將新鮮子實體置于滅過菌的帶有硫酸紙的培養皿內收集擔孢子,稀釋涂布法制備單孢菌株,單核體配對獲得雙核菌絲體(表1)[12,27]。不同菌株的9種胞外酶活性研究于2018年9月在滇西科技師范學院生物技術與工程學院實驗室開展。
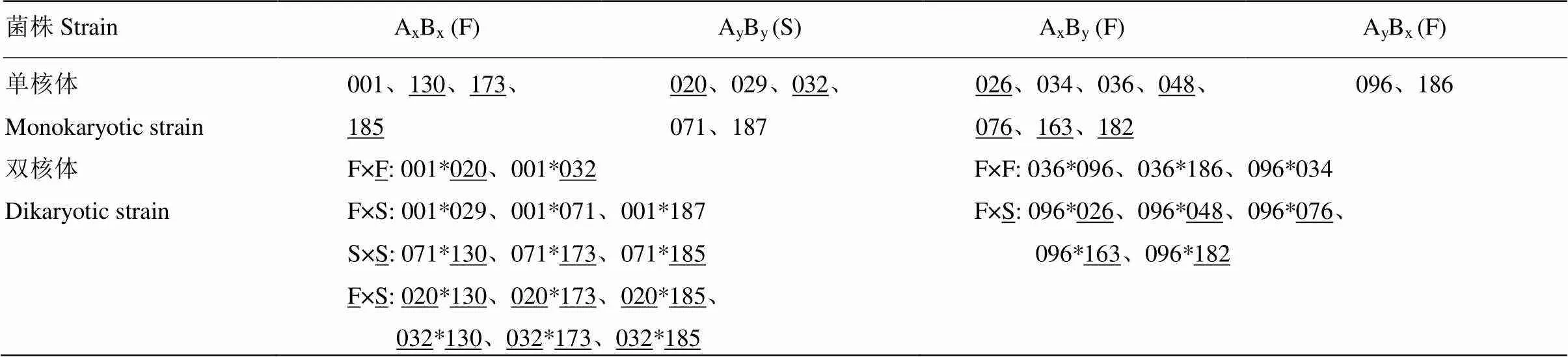
表1 試驗菌株
“F”代表單孢生長速度較快的極性,“S”代表單孢生長速度較慢的極性,“_”代表類型Ⅱ單核體,其他的為類型Ⅰ單核體,“×”代表雜交;“*”代表兩個不同菌株單核體形成雜合體的連接符,*前后分別為雜交配對親本單孢編號
“F” represents the polarity with a faster growth rate of single spore, “S” represents the polarity with a slower growth rate of single spore, “_” represents the type II monokaryons, others are type I monokaryons, “×” represents hybridization, “*” represents connectors of monokaryons formation of a hybrid for two different strains, * before and after is strain No. of single spore of hybrid pairing parents
1.2 菌株培養與粗酶液制備
將已活化的單核體與雙核體菌株接種于YPD(0.2%蛋白胨、0.2%酵母膏、2%葡萄糖、1.5%瓊脂)固體培養基,在25℃條件下培養,平皿生長速率法測定生長速度[12]。將單核體與雙核體菌株接種于YPD固體培養基,在(24±1)℃下黑暗培養15 d,用直徑7 mm打孔器處理培養菌株邊緣打孔,挑取1塊接種于含120 mL YPD液體培養液(除不含瓊脂外,成分同固體)的250 mL三角瓶中,3次重復,置于旋轉式搖床,100 r/min、(25±1)℃下黑暗培養10 d。過濾(200目三層尼龍紗布),取濾液,離心(4℃、4 000 r/min、20 min),上清液即為粗酶液,置于-20℃下保存,用于胞外酶測定[28]。
1.3 酶活測定
40個子代個體是單獨一個處理下的酶活測試,羧甲基纖維素酶、濾紙纖維素酶、β-葡糖糖苷酶、半纖維素酶以及淀粉酶的測定采用二硝基水楊酸(DNS)法[29],所有酶活單位用U表示。
1.3.1 羧甲基纖維素酶 以羧甲基纖維素鈉為底物,用pH 4.6、0.1 mol?L-1檸檬酸緩沖液配制0.5%羧甲基纖維素(CMC)溶液。向試管(3支樣品、3支對照)中加入0.5%的CMC-Na溶液0.75 mL,樣品管加粗酶液0.125 mL,50℃恒溫水浴保溫30 min,取出后立即加入DNS試劑0.75 mL(對照管加入DNS后再加入0.125 mL酶液),沸水浴10 min,取出立即冷卻,加蒸餾水25 mL,混勻,于520 nm測OD值,依據葡萄糖標準曲線(圖1-A)求得還原糖量[30]。1 U=1 mg葡萄糖?(30 min)-1?mL-1發酵液(即1 mL發酵液中的酶量與底物作用30 min釋放出l mg葡萄糖為一個活力單位)。
1.3.2 濾紙纖維素酶 以一層濾紙(規格:1 cm×6 cm,新華1號)為底物,向試管(3支樣品、3支對照)中加入一條新華1號濾紙,而后加入0.1 mol? L-1檸檬酸緩沖液(pH 4.6)0.5 mL,再往樣品管中加入粗酶液0.125 mL,置于50℃保溫60 min,取出后,立即加入DNS試劑1.5 mL(對照管加入DNS后再加入0.125 mL酶液),沸水浴10 min,取出冷卻后加蒸餾水至25 mL,混勻,然后于520 nm處測OD值,依據葡萄糖標準曲線求得還原糖量[31]。1 U=1 mg葡萄糖?(60 min)-1?mL-1發酵液(即1 mL發酵液中的酶量與底物作用60 min釋放出l mg葡萄糖為一個活力單位)。
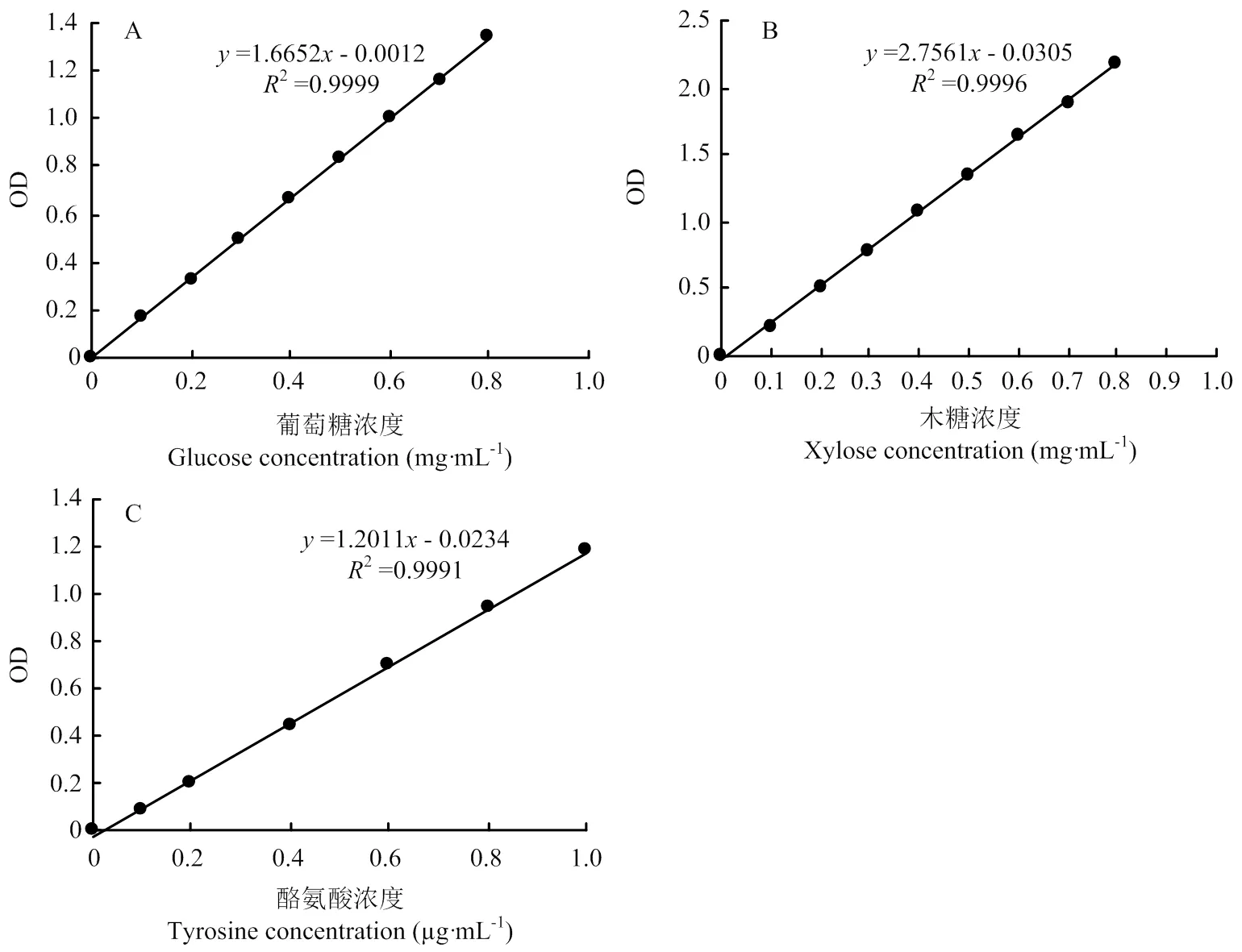
A:葡萄糖標準曲線;B:木糖標準曲線;C:酪氨酸標準曲線A: Glucose standard curve; B: Xylose standard curve; C: Tyrosine standard curve
1.3.3 β-葡糖糖苷酶 以纖維二糖為底物,向試管(3支樣品、3支對照)中加入0.2%的纖維二糖0.5 mL,樣品管加入粗酶液0.075 mL,50℃恒溫水浴保溫30 min,取出后立即加入DNS試劑0.75 mL(對照管加入DNS后再加入0.075 mL酶液),沸水浴10 min,取出立即冷卻,加蒸餾水15 mL,搖勻,于520 nm測OD值,依據葡萄糖標準曲線求得還原糖量[32]。1 U=1 mg葡萄糖?(30 min)-1?mL-1發酵液(即1 mL發酵液中的酶量與底物作用30 min釋放出l mg葡萄糖為一個活力單位)。
1.3.4 半纖維素酶 以木聚糖為底物,用pH 4.6、0.2 mol?L-1的乙酸緩沖液配制0.5%木聚糖溶液。向試管中(3支樣品、3支對照)加入0.5%的木聚糖0.75 mL,樣品管加粗酶液0.05 mL,50℃恒溫水浴保溫30 min,取出立即加入DNS試劑0.75 mL(對照管加入DNS后再加0.05 mL酶液),沸水浴10 min,取出立即冷卻,加蒸餾水10 mL,搖勻,于520 nm測OD值。依據木糖標準曲線(圖1-B)求還原糖量[33]。1 U=1 mg木糖?(30 min)-1?mL-1發酵液(即1 mL發酵液中的酶量與底物作用30 min釋放出l mg木糖為一個活力單位)。
1.3.5 淀粉酶 以可溶性淀粉為底物,向試管(3支樣品、3支對照)中加入0.5%的可溶性淀粉溶液0.5 mL,樣品管加入粗酶液0.05 mL,混勻,38℃恒溫水浴保溫30 min,取出立即加入DNS試劑0.75 mL(對照管加入DNS后再加入0.05 mL酶液),沸水浴10 min,取出立即冷卻,加蒸餾水10 mL,搖勻,于520 nm測OD值,依據葡萄糖標準曲線求得還原糖量[34]。1 U=1 mg葡萄糖?(30 min)-1?mL-1發酵液(即1 mL發酵液中的酶量與底物作用30 min釋放出l mg葡萄糖為一個活力單位)。
1.3.6 蛋白酶 以酪蛋白為底物,向試管中(3支樣品、3支對照)加入2%酪蛋白(預熱至30℃)1 mL,樣品管加入稀釋10倍的粗酶液0.5 mL搖勻,30℃保溫10 min,加入10%三氯乙酸l mL中止反應,再吸取粗酶液0.5 mL加入對照管中,搖勻,25℃靜置30 min,離心(4℃、3 000 r/min)2 min。另取試管(3支樣品,3支對照),然后分別加入0.5 mL上清測定液、對照液,分別加入2.5 mL的0.4 mol?L-1碳酸鈉溶液,最后加入0.5 mL福林-酚試劑,搖勻,30℃水浴保溫30 min,取出后置于分光光度計650 nm處測OD值,依酪氨酸標準曲線(圖1-C)求值[35]。1 U=1 μg酪氨酸?(30 min)-1?mL-1發酵液(即1 mL發酵液中的酶量與底物作用30 min釋放出l μg酪氨酸為一個活力單位)。
1.3.7 木質素酶 木質素酶主要包括漆酶、多酚氧化酶及過氧化物酶,參考Egger[36]、Pointing[37]、S?k[38]等的方法測定。酶活性定義:1 U=ΔOD?(30 min)-1?mL-1發酵液,即1 mL發酵液中的酶量每分鐘使OD值改變0.01為一個活力單位。
1.3.7.1 漆酶 向試管中(3支樣品、3支對照)加入3.36 mmol?L-1鄰聯甲苯胺0.5 mL作為底物,加入0.2 mol?L-1乙酸緩沖液(pH 4.6)3 mL,樣品管再加入0.4 mL酶液,對照管中加入煮沸10 min的粗酶液0.4 mL,置28℃恒溫水浴下反應30 min,取出后立即于600 nm處測OD值。
1.3.7.2 多酚氧化酶 向試管中(3支樣品、3支對照)加入0.1 mmol?L-1的鄰苯二酚2.0 mL和0.05 mol?L-1磷酸緩沖液(pH=6.0)2.0 mL,樣品管再加入粗酶液0.4 mL,對照管中加入煮沸10 min的粗酶液0.4 mL,28℃恒溫水浴保溫30 min,取出后立即于400 nm處測0D值。
1.3.7.3 過氧化物酶 向3支樣品管加入粗酶液0.4 mL,3支對照管中加入煮沸10 min的粗酶液0.4 mL,再分別加入過氧化物反應混合物(取愈創木酚0.019 mL,過氧化氫0.028 mL,pH 6.0的0.2 mol?L-1磷酸緩沖液100 mL混合)3.0 mL,倒入比色皿立即計時30 min,測定470 nm的OD值。
1.4 統計分析
活性值的測定均為3次重復,采用SPSS 19.0 統計軟件對所有數據進行分析[39]。
2 結果
2.1 楊柳田頭菇不同單核體的菌絲生長速度及其9種胞外酶活性分析
通過上述方法測定楊柳田頭菇不同單核體的菌絲生長速度和胞外酶活性。多重比較(Duncan法)結果表明,不同的單核體其菌絲生長速度與9種胞外酶活性均存在較大的差異,在顯著水平為0.05上各自均表現出不同程度的顯著差異(表2)。大部分菌絲生長速度較快的單核體的胞外酶活性也較高,反之,胞外酶活性較低;但少數類型Ⅱ單核體如、及等卻出現菌絲生長速度與大部分胞外酶活性成反比的現象。同時,除類型Ⅱ的單核體和的羧甲基纖維素酶外,所有單核體的淀粉酶、濾紙纖維素酶、半纖維素酶、β-葡糖糖苷酶、羧甲基纖維素酶及蛋白酶比過氧化物酶、多酚氧化酶、漆酶的活性高。因此,單核體生長發育階段,淀粉、纖維素、半纖維素及蛋白質是其菌絲通過胞外酶降解并吸收利用的主要大分子物質,對木質素的要求較少。
2.2 楊柳田頭菇不同雙核體的菌絲生長速度及其9種胞外酶活性分析
雙核體的菌絲生長速度和胞外酶活性多重比較(Duncan法)結果表明,不同類型的雙核體其菌絲生長速度與9種胞外酶活性均存在較大的差異(<0.05)(表3)。對于類型Ⅰ單核體組合所形成的雙核體來說,單核體菌絲生長速度“快-慢”組合與“快-快”組合相比,前者除半纖維素酶、蛋白酶和多酚氧化酶外,其他胞外酶活性都較高,具有類型Ⅱ單核體參與形成的雙核體的胞外酶活性卻各不相同且無規律,一部分雙核體(如:*、096*)胞外酶活性表現較高,另一部分雙核體(如:096*、*)胞外酶活性卻較低。總之,在22個雙核體中,組合編號為001*029、096*、*等的胞外酶活性較高,而組合編號為036*096、071*、071*等胞外酶活性較低。同時,除部分雙核體蛋白酶(001*029、001*071、001*187、*和096*)、半纖維素酶(*和*)和-葡萄糖苷酶(071*和096*)外,所有雙核體的淀粉酶、濾紙纖維素酶、半纖維素酶、β-葡糖糖苷酶、羧甲基纖維素酶及蛋白酶比過氧化物酶、多酚氧化酶、漆酶的活性高。因此,雙核體生長發育階段,對大分子物質的需求與單核體相似。
2.3 單核體菌絲生長速度與9種胞外酶活性之間的相關性分析及通徑分析
為分析不同胞外酶活力大小與楊柳田頭菇菌絲生長速度的關系,對18個單核體的菌絲生長速度及其9種胞外酶平均活力進行相關性分析及通徑分析[40]。相關性分析結果表明(表4),所測定的胞外酶平均活力除濾紙纖維素酶、半纖維素酶、過氧化物酶外,其余與單核體菌絲生長速度呈正相關;其中單核體的菌絲生長速度與漆酶、多酚氧化酶、蛋白酶的平均酶活力呈極顯著正相關(<0.01),與淀粉酶、β-葡萄糖苷酶的平均酶活力呈顯著正相關(<0.05)。因此,單核體的菌絲生長速度與9種胞外酶平均活力存在著一定程度的相關性。
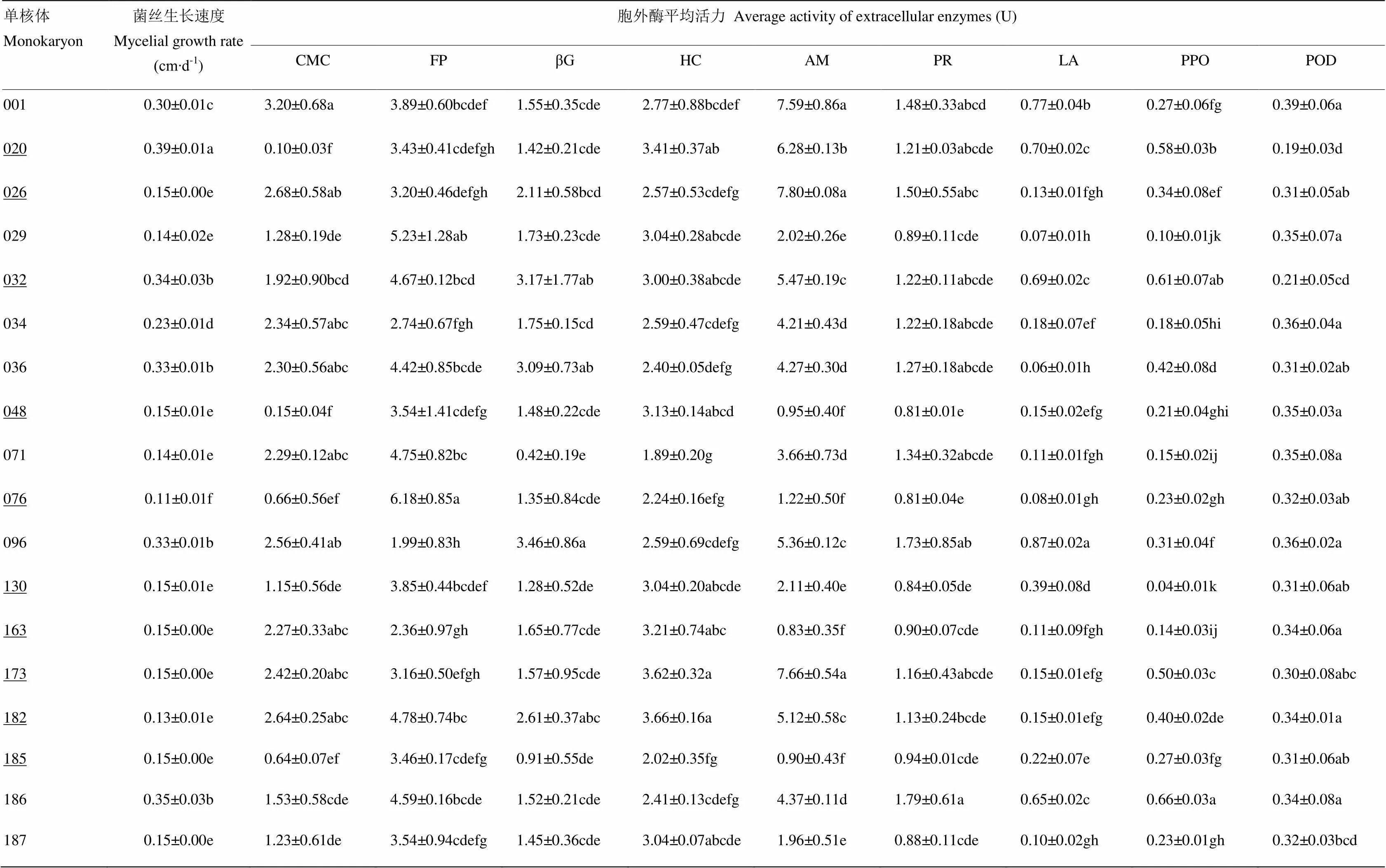
表2 楊柳田頭菇不同單核體的菌絲生長速度與胞外酶平均活力的差異
CMC:羧甲基纖維素酶(CMCase);FP:濾紙纖維素酶(Filter paper cellulose);βG:-葡萄糖苷酶(-glucanase);HC:半纖維素酶(Hemieetlutase);AM:淀粉酶(Amylase);PR:蛋白酶(Protease);LA:漆酶(Laccase);PPO:多酚氧化酶(Polyphenolase);POD:過氧化物酶(Peroxidase)。同列數字后不同小寫字母表示在0.05水平有顯著差異。下同 Different small letters behind the data in the same column mean significant difference at 0.05 level. The same as below

表3 楊柳田頭菇不同雙核體的菌絲生長速度與胞外酶平均活力的差異

表4 菌絲生長速度及其胞外酶平均活力的相關系數
“*”代表顯著相關(<0.05);“**”代表極顯著相關(<0.01)。下同
“*” represents the significant correlation (<0.05), “**” represents the highly significant correlation (<0.01). The same as below
上述相關性分析只能表明胞外酶活力與單核體菌絲生長速度之間的直接關系,但不同胞外酶之間相互作用對其影響沒有直觀表現。因此,需在相關性分析的基礎上進行通徑分析,通過逐步回歸分析法,把胞外酶活力與單核體菌絲生長速度之間的相關性分解為直接作用和間接作用,篩選出與單核體菌絲生長速度較為密切的胞外酶種類。
以單核體菌絲生長速度為因變量Y,羧甲基纖維素酶、濾紙纖維素酶、β-葡萄糖苷酶、HC、半纖維素酶、淀粉酶、蛋白酶、漆酶、多酚氧化酶和過氧化物酶分別為自變量X1、X2、X3、X4、X5、X6、X7、X8和X9。采取多元線性回歸分析法,剔除偏回歸系數不顯著的自變量,建立Y的最優多元回歸方程為:=0.086+0.2057+0.2028(=20.136,=0.000<0.01),多元線形回歸方程的F檢驗達到極顯著,進一步做通徑分析。
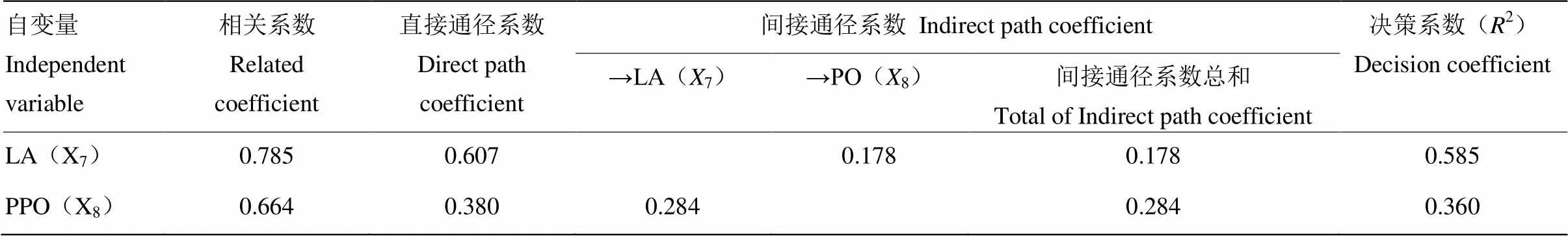
表5 以菌絲生長速度為因變量的通徑分析
“→”表示通過該酶對Y產生間接作用。“→”means that the enzyme has an indirect effect on Y
通徑分析結果表明(表5),在2個自變量與Y的多元線形回歸方程中,直接通徑作用的關聯程度為X7>X8,間接通徑的關聯程度為X8>X7,決策系數的大小為X7>X8。因此,X8通過X7對Y的間接作用大于X7通過X8對Y的間接作用(0.284>0.178),說明多酚氧化酶對單核體的菌絲生長速度的間接影響大于漆酶,但漆酶對單核體的菌絲生長速度的綜合作用(包括直接作用以及與其他胞外酶的協同作用)最大(2=0.585)。同時,多酚氧化酶與漆酶共同作用參與木質素的降解,因此,在楊柳田頭菇單核體的生長發育過程中,木質素對其影響較大。
2.4 雙核體菌絲生長速度與9種胞外酶活性之間的相關性分析及通徑分析
雙核體的菌絲生長速度與胞外酶的相關性分析表明(表6),所測定的胞外酶平均活力除多酚氧化酶與過氧化物酶外,其余與其菌絲生長速度呈正相關。其中雙核體的菌絲生長速度與漆酶、淀粉酶、羧甲基纖維素酶的平均酶活力呈極顯著正相關(<0.01),但與多酚氧化酶平均酶活力呈極顯著負相關(<0.01)。因此,楊柳田頭菇單核體菌絲的生長速度與9種胞外酶平均活力也存在著一定程度的相關性。
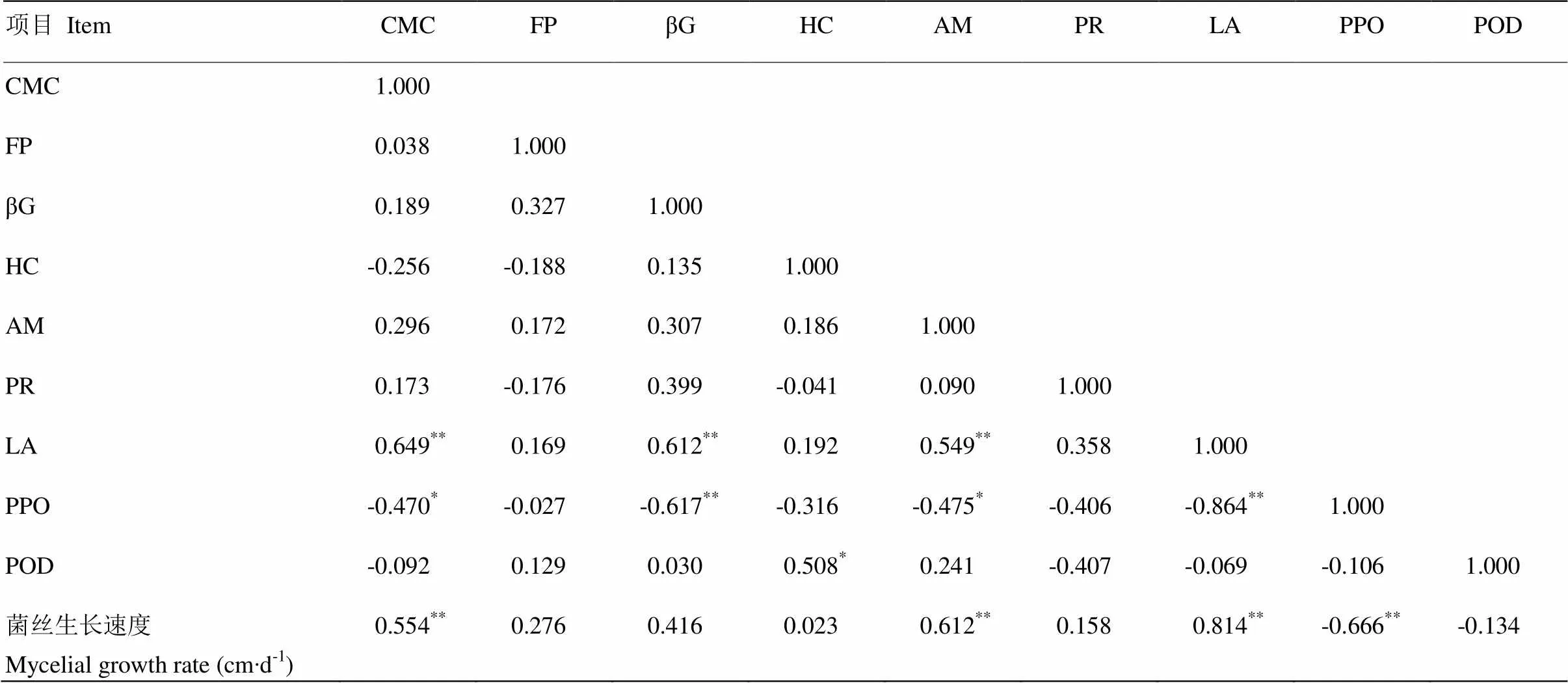
表6 菌絲生長速度及其胞外酶平均活力的相關系數
以相關性分析為基礎,對胞外酶活力與雙核體菌絲生長速度進行通徑分析,剔除偏回歸系數不顯著的自變量,建立Y的最優線性方程為:=0.195+ 0.1047(=39.276,=0.000<0.01),線形回歸方程的F檢驗達到極顯著。總之,漆酶對雙核體的菌絲生長速度的作用最大,不同胞外酶之間的協同作用對雙核體菌絲的生長速度影響較小。
2.5 極性對9種胞外酶平均活力的影響分析
在單核體的基礎上,根據極性不同將單核體分為AxBx、AyBy、AxBy和AyBx4類,分別計算每一類極性中單核體的9種胞外酶平均活力,通過多重比較(Duncan法)分析不同極性對9種胞外酶平均活力的影響。結果表明(表7),-葡萄糖苷酶、淀粉酶、漆酶、多酚氧化因極性不同而表現出一定的顯著差異,其余胞外酶酶活的表現無差異。

表7 不同極性對胞外酶平均活力的影響
2.6 交配因子與9種胞外酶平均活力的影響分析
用上述同樣的方法,在單核體的基礎上,根據交配因子不同將單核體分為Ax、Ay、Bx和By4類,分別計算每一類交配因子中單核體的9種胞外酶平均活力,通過多重比較(Duncan法)分析不同交配因子對9種胞外酶平均活力的影響。結果表明(表8),大部分胞外酶因交配因子不同而未表現出差異性,只有漆酶、多酚氧化酶、過氧化物酶存在一定的顯著差異。
3 討論
據有關文獻報道,大型真菌菌絲體的生長速率是由多個基因控制的數量性狀位點[41-42]。大型真菌菌絲生長速度與酶類、激素分泌和耐溫特性等[43-44]相關,并已經證實其單核體菌絲生長速度相關控制基因或數量基因座與交配因子[45]和自我識別系統連鎖[46]。然而,直接說真菌胞外酶活性與菌絲生長速度相關的研究目前尚未見報道。本研究發現楊柳田頭菇單核體中生長速度較快的也具有較高的胞外酶活性,生長速度較慢的其胞外酶活性低,因此,單核體胞外酶活性與菌絲生長速度之間可能存在一定的相關性。

表8 不同交配因子對胞外酶平均活力的影響
本研究發現,在顯著水平為0.05上,極性對胞外酶的影響大于交配因子,目前的研究已證明交配因子A和B本身并不連鎖且存在于不同的染色體上[47-48]。因此,楊柳田頭菇單核體的胞外酶活性是與極性有相關性的多基因控制的數量性狀,而不是與單獨的交配因子相關。
高等真菌在人工馴化栽培過程中,其有性繁殖階段交配型因子位點內出現重組的現象極其普遍,常常引發交配因子的偏分離,偏分離現象在[49]、[50]、[46]等中均有報道,可導致極性菌株不成比例,嚴重者還出現某一極性丟失的現象[51],與正常菌株相比,偏分離菌株會出現一些不同的特征,如菌絲生長速度和胞外酶活性異常。本研究發現,除一些單核體和雙核體菌株外,類型Ⅰ菌株的胞外酶活性有一定的規律。因此,單核體的菌絲生長速度與本極性異常與其胞外酶活性相關。
4 結論
淀粉酶、濾紙纖維素酶、半纖維素酶、β-葡萄糖苷酶、羧甲基纖維素酶及蛋白酶活性在單核體和雙核體的表達水平較高;單核體與雙核體的胞外酶活性極有可能與菌絲生長速度、極性相關,其中漆酶對單核體和雙核體菌絲生長速度的影響較大,極性對胞外酶平均活力的影響大于交配因子。單核體的菌絲生長速度與本極性異常是改變各菌株生長速度和胞外酶活性表達水平的根源。
[1] 楊祝良, 臧穆, 劉學系. 楊柳田頭菇—無孔組的一個滇產新種. 云南植物研究, 1993, 15(1): 18-20.
Yang Z L, Zang M, Liu X X., a new species of sect. aporus from Yunnan,, 1993, 15(1): 18-20.(in Chinese)
[2] FAYOD V. Prodrome d'une histoire naturelle des Agaricines., 1889, 7(9): 181-411.
[3] 臧穆, 楊祝良, 劉學系. 一種滇產的美味新食菌楊柳田頭菇. 中國食用菌, 1991, 13(6): 8.
ZANG M, YANG Z L, LIU X X., a delicious edible mushroom newly discove red from Yunnan., 1991, 13(6): 8. (in Chinese)
[4] 金鑫. 中國廣義球蓋菇科幾個屬的分類學研究[D]. 長春: 吉林農業大學, 2012.
JIN X. Studies on taxonomy of several genera of strophariaceae (s. l.) from China [D]. Changchun: Jilin Agricultural University, 2012. (in Chinese)
[5] 周會明. 楊柳田頭菇生活史及分類地位研究[D]. 昆明: 昆明理工大學, 2011.
ZHOU H M. Studies on the life cycle and classification of[D]. Kunming: Kunming University of Science and Technology, 2011. (in Chinese)
[6] 汪欣, 劉平. 楊柳田頭菇引種馴化試驗研究. 中國食用菌, 2004, 23(2): 16-17.
WANG X, LIU P. Studies on domestication of., 2004, 23(2): 16-17. (in Chinese)
[7] Liu L Y, Li Z H, Dong Z J, Li X Y, Su J, Li Y, Liu J K. Two novel
fomannosane-type sesquiterpenoids from the culture of the basidiomycete., 2012, 2(3): 130-132.
[8] LIU L Y, ZHANG L, FENG T, LI Z H, DONG Z J, LI X Y, LIU J K. Unusual illudin-type sesquiterpenoids from cultures of., 2011, 1(2): 87-92.
[9] ZHU Y C, WANG G, YANG X L, LUO D Q, ZHU Q C, PENG T, LIUJ K. Agrocybone, a novel bis-sesquiterpene with a spirodienone structure from basidiomycete., 2010, 51(26): 3443-3445.
[10] CHEN W M, ZHANG X L, CHAI H M, CHEN L J, LIU W L, ZHAO Y C. Comparative analysis of aporulating and spore-deficient strains ofbased on the transcriptome sequences., 2015, 71(2): 204-213.
[11] CHEN W M, CHAI H M, YANG W X, ZHANG X L, CHEN Y H, ZHAO Y C. Characterization of non-coding regions in B mating loci ofgroups: target sites for B mating type identification., 2017, 74(6): 772-778.
[12] 周會明, 趙永昌, 陳衛民, 柴紅梅, 李樹紅, 趙靜. 楊柳田頭菇交配型因子與菌絲生長速度關系. 云南植物研究, 2010, 32(4): 315-322.
ZHOU H M, ZHAO Y C, CHEN W M, CHAI H M, LI S H, ZHAO J. The relationship between mating factors with mycelia growth rate of(Bolbitiaceae)., 2010, 32(4): 315-322. (in Chinese)
[13] 周會明, 張小雷, 馬美芳, 楊麗芬, 趙永昌. 田頭菇屬不同分離菌株雜交研究. 生物技術, 2011, 21(1): 69-73.
ZHOU H M, ZHANG X L, MA M F, YANG L F, ZHAO Y C. Study on the hybridization for different isolates of genus., 2011, 21(1): 69-73. (in Chinese)
[14] 曹春蕾, 崔寶凱, 秦問敏. 桑木層孔菌液體培養過程中幾種胞外酶活性的變化. 菌物學報, 2011, 30(2): 275-280.
CAO C L, CUI B K, QIN W M. Activity changes of several extracellular enzymes in liquid culture of., 2011, 30(2): 275-280. (in Chinese)
[15] 方宏陽. 不同顏色的毛木耳菌株生長發育過程及胞外酶活性研究[D]. 長春: 吉林農業大學, 2017.
FANG H Y. Study on the growth and development and extracellular enzyme activity of different color strain of[D]. Changchun: Jilin Agricultural University, 2017. (in Chinese)
[16] 劉兵. γ-氨基丁酸和海藻糖對高溫脅迫香菇菌絲胞外酶活性的影響[D]. 晉中: 山西農業大學, 2017.
LIU B. Effect of GABA and trehalose on the activity of exoenzyme induced by heat stress in mycelia of[D]. Jinzhong: Shanxi Agricultural University, 2017. (in Chinese)
[17] ZERVA A, ZERVAKIS G I, CHRISTAKOPOULOS P, TOPAKAS E. Degradation of olive mill wastewater by the induced extracellular ligninolytic enzymes of two wood-rot fungi., 2017, 203(2): 791-798.
[18] HU C J, HUANG D L, ZENG G M, CHENG M, GONG X M, WANG R Z, XUE W J, HU Z X, LIU Y N. The combination of Fenton process andfor the removal of bisphenol A in river sediments: Mechanism related to extracellular enzyme, organic acid and iron., 2018, 338: 432-439.
[19] PANDEYR K, TEWARIS, TEWARIL. Lignolytic mushroomWDP2: Laccase production, characterization, and bioremediation of synthetic dyes., 2018, 158: 50-58.
[20] ZHAIF H, HANJ R. Decomposition of asparagus old stalks byspp.under mushroom-growing conditions., 2018, 231: 11-14.
[21] 郝敬喆. 新疆野生巴爾喀什蘑菇馴化栽培與漆酶活性研究[D]. 北京: 中國農業大學, 2019.
HAOJ Z. Domesticated cultivation of Xinjiang wild mushroomand laccase activity [D]. Beijing: China Agricultural University, 2019. (in Chinese)
[22] 曾春函, 王傳華. 我國主要蜜環菌生物種胞外酶活性對溫度的種特異性響應. 菌物學報, 2019, 38(1): 1-15.
ZENGC H, WANGC H. Specificity response of extracellular enzyme activities to temperature of eightspecies in China., 2019, 38(1): 1-15. (in Chinese)
[23] 方宏陽, 任梓銘, 孟秀秀, 代俊杰, 李壽建, 黎志文, 李曉. 玉木耳胞外酶變化與農藝性狀關系. 分子植物育種, 2018, 16(13): 4431-4435.
FANGH Y, RENZ M, MENG X X, DAI J J, LI S J, LI Z W, LI X. The relationship between extracellular enzymes changes and agronomic traits in., 2018, 16(13): 4431-4435. (in Chinese)
[24] 李利梅, 朱國勝, 黃萬兵, 盧穎穎, 龔光祿, 張麗娜, 楊通靜, 桂陽. 紅托竹蓀母種菌絲生長特性及胞外酶活性. 食用菌學報, 2018, 25(3): 30-35.
LIL M, ZHUG S, HUANGW B, LUY Y, GONGG L, ZHANGL N, YANGT J , GUIY. Mycelial growth characteristics and extracellular enzyme activity of., 2018, 25(3): 30-35. (in Chinese)
[25] 吳亞召, 張文雋, 雷萍, 杜芳. 茶樹菇生長發育過程中幾種胞外酶活性的變化. 西北農林科技大學學報(自然科學版), 2018, 46(11): 115-120.
WUY Z, ZHANGW J, LEI P, DU F. Changes of extracellular enzymes activities during development of., 2018, 46(11): 115-120. (in Chinese)
[26] 靖云閣. 白靈側耳菌絲生理成熟期環境控制及生理指標測定[D]. 北京: 中國農業科學院, 2018.
JINGY G. Studies of environment control and physiological test duringin mycelium physiological maturity period [D]. Beijing: Chinese Academy of Agricultural Sciences, 2018. (in Chinese)
[27] 柴紅梅, 周會明, 趙靜, 陳衛民, 趙永昌. 利用自交尋找食用菌發育缺陷型基因的研究. 農業科學與技術: 英文版, 2012, 13(10): 2037-2043.
CHAIH M, ZHOUH M, ZHAOJ, CHENW M, ZHAOY C. search development-deficient genes in edible mushroom by self-crossing., 2012, 13(10): 2037-2043. (in Chinese)
[28] JIC, NGUYENL N, HOUJ W, HAIF I, CHENV. Direct immobilization of laccase on titania nanoparticles from crude enzyme extracts ofculture for micro-pollutant degradation., 2017, 178: 215-223.
[29] MILLERG L. Use of dinitrosalicylic acid reagent for determination of reducing sugar., 1959, 31(3): 426-428.
[30] SEBNEMK, SAADETB. Yield performances and changes in enzyme activities of Pleurotus spp. () cultivated on different agricultural wastes., 2010, 101(9): 3164-3169 .
[31] DECKERS R, ADNEYW S, JENNINGSE, VINZANTT B, HIMMELM E. Automated filter paper assay for determination of cellulose activity., 2003, 107(1):689-704.
[32] LUY H, DENGX, CHENGZ, LIQ, LIUG. Enhanced production of hybrid extracellular β-glucanase by recombinantusing experimental design method., 2007, 15(2): 172-177.
[33] SHAMALAT R, SREEKANYIAHK R. Production of cellulases and D-xylanase by some selected fungal isolates., 1986, 8(3): 178-182.
[34] SIMONISJ L, RAJAH A, SHEARERC A. Extracellular enzymes and soft rot decay: Are ascomycetes important degraders in fresh water., 2008, 31(1): 135-146.
[35] LOWRYO H, ROSENBROUGHM J, FARRA L, RANDALLR J. Protein measurement with folin-phenol reagent., 1951, 193(1):265-275.
[36] EGGERK N. Substrate hydrolysis patterns of post-fire ascomycetes (Pezizales)., 1986, 78(5):771-780.
[37] POINTINGS B. Qualitative methods for the determination of lignocellulolytic enzyme production by tropical fungi., 1999, 2: 17-33.
[38] SIKS, UNYAYARA.andfort he degradation of cotton stalk and their laccase, peroxidase, ligninase and cellulose enzyme activities under semisolid state conditions., 1998, 22(3): 287-298.
[39] VAN DER KOOIJM A, HOLLISF, LOZANOL, ZALACHORASI, ABADS, ZANOLETTIO, SANDI C. Diazepam actions in the VTA enhance social dominance and mitochondrial function in the nucleus accumbens by activation of dopamine D1 receptors., 2018, 23(3): 569.
[40] 陳崗, 詹永, 楊勇, 吳振, 謝會川, 石文娟, 柴佳炎, 龔胡榮, 羅楊. 溫度對銀耳胞外酶活力及營養品質特性的影響. 食品科學, 2017, 38(23): 113-120.
CHENG, ZHAN Y, YANGY, WUZ, XIE H C, SHI W J, CHAI J Y, GONG H R, LUO Y. Effect of cultivation temperature on extracellular enzyme activities and nutritional quality characteristics of., 2017, 38(23): 113-120. (in Chinese)
[41] LARRAYA L M, IDARETAE, ARANAD, RITTERE, PISABARROA G, RAMIREZL. Quantitative trait loci controlling vegetative growth rate in the edible basidiomycete., 2002, 68(3): 1109-1114.
[42] LARRAYAL M, ALFONSOM, PISABRROA G, RAMIREZL. Mapping of genomic regions (Quantitative Trait Loci) controlling production and quality in industrial cultures of the edible basidiomycete., 2003, 69(6): 3617-3625.
[43] OLSONA. Genetic linkage between growth rate and the intersterility genes S and P in the basidiomycetes. lat.2006, 110(8): 979-984.
[44] SANTOYOF, GONZáLEZA E, TERRóNM C, RAMíREZL, PISABARROA G. Quantitative linkage mapping of lignin-degrading enzymatic activities in., 2008, 43(2): 137-143.
[45] LARRAYAL M, PEREZG, IRIBARRENI. Relationships between monokaryotic growth rate and mating type in the edible basidiomycete., 2001, 67(8): 3385-3390.
[46] VAN DER NESTM A, SLIPPERSB, STEENKAMP E T, DE VOSL, VAN ZYLK, STENLIDJ, WINGFIELDB J, WINGFIELDB D. Genetic linkage map forreveals an association between vegetative growth and sexual and self-recognition., 2009, 46(9): 632-641.
[47] TOKIMOTOK, KOMATSUM, TAKEMARUT. Incompatibility factors in the natural population ofin Japan., 1973, 10: 371-376.
[48] MURAKAMIS, TAKEMARUT. “Puff” mutation induced by UV irradiation in(Berk.) Sing., 1975, 12: 47-51.
[49] MURAGUCHIH, ITOY, KAMADAT, YANAGIS O. A linkage map of the basidiomycetebased on random amplified polymorphic DNAs and restriction fragment length polymorphisms., 2003, 40(2): 93-102.
[50] TERASHIMAK, MATSUMOTOT, HAYASHIE, FUKUMASA- NAKAIY. A genetic linkage map of(shiitake) based on AFLP markers., 2002, 106(8): 91l-917.
[51] 周會明, 柴紅梅, 趙靜, 魏云林, 趙永昌. 基于SPSS的楊柳田頭菇菌絲生長速度與交配型相關性分析. 西南農業學報, 2010, 23(6): 1992-1998.
ZHOUH M, CHAIH M, ZHAOJ, WEIY L, ZHAOY C. Correlation analysis between mycelial growth rate and mating type ofbased on SPSS statistics., 2010, 23(6): 1992-1998. (in Chinese)
The Extracellular Enzymes Activity of F1Generations and Single-spore Isolations inStrain YAAS711
ZHOU HuiMing1,2, ZHAO YongChang2, CHAI HongMei2, ZHANG YanZhen1,2
(1School of Biotechnology and Engineering, West Yunnan University, Lincang 677000, Yunnan;2Institute of Biotechnology and Germplasmic Resource, Yunnan Academy of Agricultural Sciences, Kunming 650205)
【】The objective of this study was to explore the changes in activities of extracellular enzymes (EEA) of single-spore isolations and its self-crossing individuals fromYAAS711 and to provide evidence for its genetic breeding.【】Eighteen single-spore monokaryons and 22 dikaryons from self-crossing progeny ofYAAS711 were used as the test materials. The activities of CMCase, filter paper cellulase, β-glucanase, hemicellulase, amylase, protease, laccase, polyphenolase and peroxidase of all test strains were determined by 3,5-dinitrosalicylic acid (DNS), Folin methods and guaiacol method, and correlation analysis were carried out between the 9 EEs with mycelial growth rate, polarities and mating factors.【】The results of 9 EEs showed that most of the both monokaryons and dikaryons had higher activities of amylase, filter paper cellulase, hemicellulose, β-glucanase, CMCase and protease, but their activities of peroxidase, polyphenolase and laccase were low. The mycelial growth rate of monokaryons and dikaryons had a certain degree of correlation with the average activity of 9 EEAs. Compared with the dikaryons derived from the combination of “fast-fast” growth rate of monokaryons, the dikaryons derived from the combination of “fast-slow” growth rates of monokaryons had higher EEAs, except hemicellulase, protease and polyphenol oxidase activities. However, there were no rules to follow, when it came to the combination of dikaryons from the cross of type II monokaryons. The indirect effect of polyphenolase on the mycelial growth rate of monokaryons was greater than that of laccase, but the combined effect of laccase on the mycelial growth rate of monokaryons was the largest. The synergistic effect among EEs had little effect on the mycelial growth rate of dikaryons, among them, laccase had the greatest direct effect on its mycelial growth rate. Multiple comparisons showed that the effect of polarity on EEs was greater than that of mating factors at a significant level of 0.05.【】In short, there was a significant correlation between the anomalies of the mycelial growth rate of the monokaryons from same polarity single spore isolations and the EEAs of F1 generations deriverd from these monokaryons instrain YAAS711. The EEAs of type I strains had same rule, but the differences were existed in some type II monokaryons and the dikaryons. There were certain correlation between the growth rate of monokaryons, EEAs and polarity, there were no direct correlation between mating factors and EEAs.
; self-crossing F1generations; extracellular enzyme activity; monokaryon; dikaryon
10.3864/j.issn.0578-1752.2019.20.017

2019-04-08;
2019-08-03
云南省教育廳科學研究基金(2018JS522)、國家食用菌產業技術體系(CARS-20)
周會明,E-mail:632243530@qq.com。
趙永昌,E-mail:yaasmushroom@aliyun.com
(責任編輯 趙伶俐)

