血液IFN-γ、IL-21、CXCR5及CD8+T淋巴細胞與HIV感染病程進展的相關性*
楊水秀, 國果
(1.貴州醫科大學 基礎醫學院, 貴州 貴陽 550025; 2.貴陽市公共衛生救治中心 血庫室, 貴州 貴陽 550004)
獲得性免疫缺陷綜合征(acquired immune deficiency syndrome, AIDS)即艾滋病,是由人類免疫缺陷病毒(human immunodeficiency virus, HIV)引起,主要侵犯機體淋巴細胞,特別是CD4+T淋巴細胞遭大量破壞后,細胞免疫功能缺損,患者出現機會性感染或腫瘤,發展為AIDS[1],迄今AIDS仍未找到治愈的方法,更無疫苗預防,抗反轉錄病毒治療(antiretroviral therapy,ART)是目前AIDS最有效的治療方法,主要是通過抑制病毒的復制,增加CD4+T淋巴細胞數量,從而減少AIDS的機會性感染,改善HIV感染者的預后,進一步提高生存質量,可有效預防HIV,降低其發病率和病死率[2]。近年來,科學家們研究發現多種免疫細胞及其釋放的細胞因子與HIV/AIDS的發病機制有關,他們參與了抗HIV病毒免疫應答過程,有可能成為抗HIV病毒新的輔助治療途徑[3-5]。本研究通過觀察HIV感染者治療前及ART 3個月時血液中干擾素-γ(IFN-γ) 、白細胞介素-21(IL-21)、趨化因子CXC受體5(CXCR5)及CD8+T淋巴細胞水平,分析這些指標與HIV感染病程進展的相關性。
1 對象與方法
1.1 對象及分組
1.1.1對象 2016年5月-2017年4月門診及住院的75例HIV感染病例,其中男48例、女27例,18~64歲,均經免疫印跡法確認為HIV-1型抗體陽性,符合2018年衛生部《艾滋病診療指南》的標準。所有入組者均排除結核感染、其他自身免疫性疾病、糖尿病病、高血壓、心血管疾病等基礎疾病,排除乙型肝炎、丙型肝炎等常見病毒感染及其他感染性疾病,研究均獲得醫院倫理委員會批準,病人知情同意。
1.1.2分組 將75例HIV感染病例根據CD4+T淋巴細胞計數均分為A組(CD4+T<200個/μL)、B組(CD4+T為 200 ~500個/μL)和C組(CD4+T>500個/μL), 另選取同期健康體檢者25例為對照組、均為抗HIV陰性健康體檢者。對照組和3組HIV感染者的年齡、性別比較,差異無統計學意義(P>0.05)。
1.2 方法及觀察指標
分別于患者ART前1 d、ART后3個月時,采集空腹靜脈血,采用BD流式細胞術檢測CD4+T、CD8+T淋巴細胞數,采用酶聯免疫吸附法(ELISA)法檢測血清IFN-γ、IL-21及CXCR5水平,分別比較ART前及ART后3個月時上述檢測指標的變化,采用Pearson相關分析IFN-γ、CXCR5、IL-21、CD8+T淋巴細胞與HIV感染疾病病程進展的相關性。
1.3 統計學分析

2 結果
2.1 血清IFN-γ水平
ART前,各組血清FN-γ水平比較,對照組>C組>B組>A組,各組比較差異有統計學意義(P<0.01); ART后3個月時 ,HIV感染各組(A組、B組、C組)的IFN-γ水平高于治療前,差異均有統計意義(P<0.01);但A、B、C組互相比較,差異無統計學意義(P>0.05)。見表1。

表1 HIV感染者ART前后血清IFN-γ水平與對照組比較
注:(1)與對照組同時點比較,P<0.01;(2)與A組同時點比較,P<0.01;(3)與B組同時點比較,P<0.01;(4)與同組ART前比較,P<0.01。
2.2 血清IL-21水平
ART前各組血清IL-21水平比較,A組顯著低于B組,A組、B組均顯著低于C組和對照組,差異有統計學意義(P<0.05),C組與對照組比較差異無統計學意義(P>0.05); ART后3個月時 ,HIV感染各組(A組、B組、C組)的IFN-γ水平高于同組治療前,差異均有統計意義(P<0.01)。見表2。

表2 HIV感染者ART前后血清IL-21水平與對照組比較
注:(1)與對照組同時點比較,P<0.05;(2)與A組同時點比較,P<0.05;(3)與B組同時點比較,P<0.05;(4)與同組ART前比較,P<0.01。
2.3 血清CXCR5水平
ART前各組血清CXCR5水平比較,A組顯著低于B組,A組、B組均顯著低于C組和對照組,差異有統計學意義(P<0.05);ART后3個月時 ,HIV感染各組(A組、B組、C組)的CXCR5水平顯著高于同組治療前,差異均有統計意義(P<0.01)。見表2。
2.4 CD8+T淋巴細胞、病毒載量與IFN-γ、IL-21、CXCR5水平的相關性
對75例HIV感染者的CD8+T淋巴細胞、病毒載量與血清IFN-γ、IL-21、CXCR5指標進行比較,結果顯示CD8+T淋巴細胞計數與IFN-γ、CXCR5、IL-21的水平呈正相關,病毒載量與IFN-γ、CXCR5、IL-21水平呈負相關,差異均有統計學意義(P<0.05)。見表4。
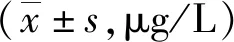
表3 HIV感染者ART前后血清CXCR5水平與對照組比較
注:(1)與對照組同時點比較,P<0.05;(2)與A組同時點比較,P<0.05;(3)與B組同時點比較,P<0.05;(4)與同組ART前比較,P<0.01。

表4 各組HIV感染患者血液CD8+T淋巴細胞、病毒載量與血清IFN-γ、IL-21、CXCR5水平的相關性
注:(1)為P<0.01。
3 討論
HIV感染人體后,會導致淋巴細胞數絕對減少及細胞功能受損,人體的免疫功能紊亂,繼而引起機體免疫功能缺陷及異常免疫激活。有研究表明HIV抗病毒治療可恢復其部分免疫功能[6],但恢復較慢,且其機制尚不十分清楚。IFN-γ主要是由NK細胞和活化的T淋巴細胞(包括CD8+T淋巴細胞和TH0細胞、TH1細胞)分泌,具有抗病毒、抗增殖及免疫調節免疫等功能[7-8]。其通過誘導抗病毒蛋白(antiviral protein, AVP)的合成發揮相應效應,強濾泡輔助T細胞(TFH)的免疫功能,實現對病毒的抑制作用[9-11];IFN-γ在 HIV感染者疾病進展中可與IL-12等免疫細胞因子及CD4+CD25+FOXP3Treg等免疫細胞間相互作用,發揮中心因子作用[12]。HIV可直接激活HIV感染者的T淋巴細胞產生IFN-γ,激活慢性免疫,最終造成機體免疫系統衰竭[13],IFN-γ還可介導單核細胞分泌大量的細胞因子,實現相關的免疫調節[14]。本研究顯示,ART前IFN-γ水平低于對照組,組間比較差異有統計學意義(P<0.01),隨著CD4+T淋巴細胞數下降,外周血中IFN-γ水平呈逐漸下降趨勢。經ART有效抑制病毒后,各組IFN-γ水平均較治療前增加,提示IFN-γ可能參與了抗病毒及機體免疫重建過程,但仍低于對照組,考慮與感染者免疫功能恢復不全有關,與既往研究結果符合[15]。
IL-21在控制慢性病毒感染中有免疫增強的作用,主要由CD4+T淋巴細胞產生。由于HIV感染會導致 CD4+T淋巴細胞的數量減少,使得IL-21水平低下。有研究表明IL-21會增強CD4+T細胞、CD8+T 細胞和自然殺傷細胞的功能,在控制病毒感染中起重要的作用[16]。最新研究顯示,IL-21可上調和增強HIV感染的自然抗性,外源增加IL-21水平或可促進機體細胞中IL-21蓄積,抑制早期HIV感染的程度[17]。IL-21還能提高抗凋亡蛋白 Bcl-2和Bcl-X(L)表達,增強HIV特異抗體依賴細胞介導的細胞毒性作用;IL-21激活的NK細胞在共同培養的被HIV感染同源CD4+T淋巴細胞中可通過穿孔素或白細胞功能相關抗原(LFA-1)依賴方式抑制HIV病毒復制[18]。HIV感染和破壞人T輔助細胞,從而導致感染者機體免疫缺陷。IL-21還能刺激T淋巴細胞分泌IFN-γ,誘導其增殖和細胞毒活性。本研究結果顯示,未ART前,IL-21水平隨著機體免疫功能下降而呈降低趨勢,經ART治療后,其水平逐漸增高,與對照組比較,差異有統計學意義(P<0.05),提示IL-21參與了HIV感染過程。
CXCR5在肝、脾和淋巴結等組織表達豐富,是重要的B淋巴細胞組織因子[19],在相關臨床疾病如系統性紅斑狼瘡、重癥肌無力、糖尿病等患者外周血中可以檢測到CXCR5的高表達,在一些自身免疫性疾病中可作為一種疾病發展階段的指征。CXCR5不僅表達于B細胞表面,還是TFH表面的重要標志,CXCR5CD8+T淋巴細胞具有抑制病毒復制的功能[20-22],有研究表明,外周血CXCR5+CD8+T淋巴細胞頻率及功能與HIV感染者的基本進展密切相關[23]。因此CXCR5水平可能與慢性病毒感染疾病的嚴重程度存在相關性。本研究結果顯示,ART前,CXCR5細胞因子水平變化均為A組 本研究結果顯示,未經過ART治療的HIV感染者血清中IFN-γ、IL-21、CXCR5細胞因子水平變化均為A組 綜上所述,IFN-γ、IL-21、CXCR5等細胞因子及CD8+T淋巴細胞與HIV感染病程密切相關,提示血清IFN-γ、IL-21、CXCR5細胞因子水平變化可能作為疾病病程、病情預判的檢測指標,并可評價ART療效,有望成為此類病人的檢測指標,可能為今后HIV感染免疫治療提供新的方向。

