腎素原受體在IgA腎病中的表達及意義
徐晉徉, 何常, 胡斌
(1.貴州醫科大學 病理學教研室, 貴州 貴陽 550004; 2.貴州醫科大學附院 病理科, 貴州 貴陽 550004)
IgA腎病(IgA nephropathy)是亞洲地區最常見的原發性腎小球疾病[1],也是導致終末期腎病的主要病因之一,其發病機制尚未完全明確,亦缺乏特異性治療方法。有研究表明,腎臟局部腎素-血管緊張素(RAS)系統的激活在IgA腎病的發生發展過程中可能發揮著重要作用[2]。本研究選取腎素原受體(prorenin receptor,PRR)作為突破點研究RAS系統在IgA 腎病發病和進展過程中的作用。
1 資料與方法
1.1 臨床資料
收集2010年1月-2017年9月病理科54例IgA腎病患者腎穿刺活檢標本作為IgA腎病組,按病變程度分為局灶增生型20例(局灶增生組)、IgA腎病合并膜性腎病(membranous nephropathy,MN)20例(合并MN組)、新月體型14例(新月體組)。納入標準:(1)腎臟穿刺活檢標本經蘇木素-伊紅染色、過碘酸六胺銀染色、馬松三色染色、過碘酸雪夫染色,結合新鮮組織免疫熒光結果[免疫球蛋白IgG、IgA、IgM,補體C3、C1q,纖維蛋白原(fibrinogen,Fib)、乙肝表面抗原、乙肝核心抗體、幽門螺桿菌]以及電鏡檢查后,確診為IgA腎病;(2)光鏡下腎小球數目>8個/標本。另隨機抽取20例經腎活檢確診為微小病變腎病患者為對照組。排除肝硬化、過敏性紫癜、乙型肝炎感染、系統性紅斑狼瘡、強直性脊柱炎及惡性腫瘤等系統性疾病引起的繼發性腎小球疾病,排除先天性遺傳性腎臟疾病,排除腎穿刺前有血管緊張素轉換酶抑制劑或血管緊張素2受體阻滯劑藥物治療經歷患者。兩組患者性別、年齡比較,差異無統計學意義(P>0.05),具有可比性。見表1。

表1 兩組患者一般情況
1.2 方法
采用免疫組織化學染色法檢測兩組患者腎臟活檢標本中PRR表達,按照試劑盒說明書進行操作。兔抗人濃縮型多克隆抗體ATP6IP2北京百奧思科生物醫學技術有限公司,工作濃度為1 ∶200;通用二步法試劑盒(小鼠/兔增強聚合物檢測系統)及DAB顯色試劑盒均購自北京中杉金橋生物技術有限公司。用PBS代替一抗作為陰性對照。
1.3 觀察指標
PRR在腎臟組織中的表達情況,以每個標本切片分別選取腎小球區和腎小管區評估PRR的相對表達量。腎小管區:在顯微鏡下放大400倍攝取隨機腎小管視野10個/高倍鏡,對所選視野陽性信號用Image-pro Plus圖像分析軟件進行分析、以積分光密度(integrated optical density, IOD)表示PRR在腎小管間質中的相對表達量[3-4]。腎小球區:以陽性腎小球所占百分比[陽性腎小球所占百分比分為6級評分,無陽性腎小球計0分、陽性率≤20%計1分、陽性率 21%~40%計2分、陽性率41%~60%計3分、陽性率 61%~80%計4分、陽性率≥81%計5分]及染色強度兩項評分之積來判斷PRR表達程度[染色強度分為4級評分,不著色(-)計1分、淺黃色(+)計2分、棕黃色(++)計3分、黃褐色(+++)計4分]。每張切片分別由兩位有經驗的臨床病理科醫生單獨讀片,當評分存在差異時,通過同時使用雙頭顯微鏡閱片以達成共識。 免疫熒光IgA、IgG、IgM、C3、C1q、Fib沉積分為5級進行評分,(-)計0分、(+)計1分、(++)計2分、(+++)計3分、(++++)計4分。
1.4 統計學方法
2 結果
2.1 PRR在腎臟組織中的表達
在對照組和IgA腎病組腎組織中PRR均有不同程度的表達,腎小管區中PRR主要表達在腎小管上皮細胞,以胞質及胞膜為主,棕黃色,呈彌散性分布,但腎間質血管中未見明顯表達;腎小球區中腎小球壁層、臟層上皮細胞均有表達,以胞膜為主,棕黃色,呈線性或顆粒性分布,見圖1。腎小管區:IgA腎病組患者PRR表達水平高于對照組,差異有統計學意義(P<0.05);在IgA腎病組,隨著病變程度的加重,PRR表達水平逐漸減少,局灶增生組PRR表達水平高于其余各組,差異有統計學意義(P<0.05)。腎小球區:對照組PRR表達水平低于IgA腎病各組,差異有統計學意義(P<0.05);在IgA腎病組,隨著病變程度的加重,PRR在腎小球區域的表達逐漸增加,局灶增生組PRR表達水平低于新月體組,差異均有統計學意義(P<0.05)。見表2。
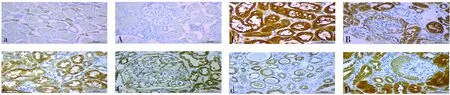
注:a、b、c、d為腎小管區,A、B、C、D為腎小球區;A、a為對照組,B、b為 IgA腎病局灶增生組,C、c為IgA腎病合并MN組,D、d為 IgA腎病新月體組。
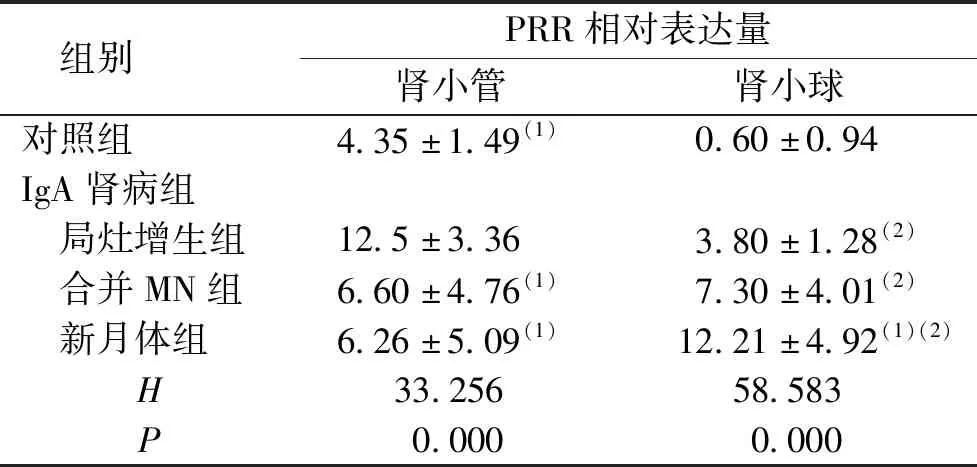
表2 IgA腎病組和對照組中PRR的相對表達量
注:(1)與局灶增生組比較,P<0.05;(2)與對照組比較,P<0.05。
2.2 PRR表達水平與免疫球蛋白及補體在腎小球沉積的關系
IgA腎病組PRR在腎小管區表達水平與IgA、IgM及Fib沉積呈正相關,與IgG沉積呈負相關,而在腎小球區的表達水平與IgA及Fib沉積呈負相關(P<0.05)。見表3。
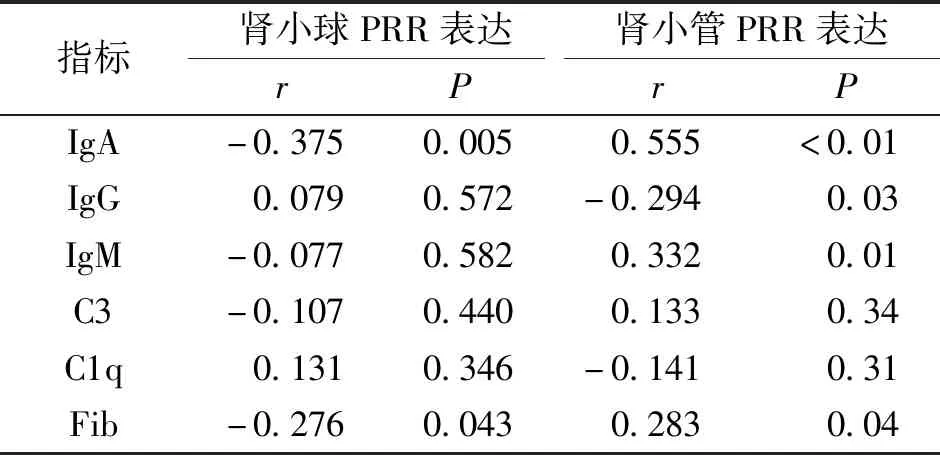
表3 PRR的表達水平與免疫球蛋白及補體在腎小球沉積的相關性
3 討論
IgA腎病是世界上最常見的原發性腎小球疾病[5],腎活檢免疫病理顯示IgA或以IgA為主的免疫球蛋白及補體成分在腎小球系膜區呈彌漫性顆粒狀或團塊狀沉積,有時伴有這些成分在毛細血管襻沉積而引起一系列臨床及病理改變[6]。該疾病呈進展性,最終20%~40%的患者在20年內發展為終末期腎病[7]。盡管目前對于IgA腎病在基礎和臨床方面做了很多研究,但其真正的發病機制尚未明確,亦缺乏針對該疾病的特異性治療。明確IgA腎病發病機制是指導預防、臨床治療、改善預后的關鍵。對于RAS系統基因的多態性的研究已經將腎臟疾病導致高血壓的發病機制與IgA 腎病聯系起來[8-9]。除經典RAS(循環RAS)外,局部組織如腎臟、心臟、血管壁、腦等組織還具有獨立的RAS,主要對局部組織的生長分化和病理生理進行調節[10],腎臟中存在高水平的RAS中各種成分[11]。有研究發現,RAS系統基因多態性與IgA腎病的發生有密切關系[12]。也發現了血管緊張素Ⅱ-1型受體在IgA腎病患者系膜細胞中的過度表達與系膜細胞增殖、腎小球節段硬化和新月體形成有關[13]。有研究報道,可能與IgA腎病高度相關的蛋白中包括腎素原受體(PRR/ATP6AP2)[14],當其與腎素或腎上腺素結合時,能激活并增強RAS系統,其激活的通路可能獨立于血管緊張素Ⅱ形成的通路[15-16]。
本研究結果顯示,在MCD和IgA腎病中PRR均有不同程度的表達,但IgA腎病的表達量明顯高于MCD,PRR主要定位在腎小管上皮細胞上,以胞質和胞膜為主,棕黃色,呈彌散性分布,腎小球壁層、臟層上皮細胞也有少量表達,以胞膜為主,棕黃色,呈線性或顆粒性分布,在腎間質血管及各類炎癥細胞中未見明顯表達。隨著腎臟病變程度的逐漸加重,PRR在腎小管區域的表達量逐漸下降,而在腎小球區域的表達量逐漸增加,尤其在形成新月體的腎小球的壁層上皮細胞中明顯表達,推測可能由于疾病進展至中晚期,大量的腎小管上皮細胞出現萎縮而導致蛋白的分泌的減少。通過相關分析可知, PRR在腎小管區表達與IgA沉積呈正相關,而在腎小球區的表達與IgA沉積呈負相關。
目前對于IgA 腎病發病機制的研究發現,IgA腎病是一種多因素作用的結果[5,17-19],原始缺陷在于異常的IgA1分子的產生,形成的半乳糖缺乏型Gd-IgA1對系膜細胞有較大親和力,能抵抗肝臟清除,從而刺激系膜細胞活化增生。但系膜 IgA1 沉積后腎損傷的機制仍然不完全清楚。本研究發現,PRR在腎臟中的表達不僅與腎臟病變程度有關,也與IgA的沉積有關。綜上推測,在IgA腎病的發生發展過程中,RAS系統可能起到一定作用,但其具體的作用機制還不十分清楚,其中PRR可能參與了IgA1在系膜細胞沉積后的一系列腎臟損傷機制中,通過檢測PRR的表達對于推測IgA 腎病腎臟損傷程度及預后有一定參考價值,PRR可能成為調節腎素-血管緊張素系統新的治療位點,目前公認的PRR拮抗劑柄區肽能對PRR競爭性抑制[20]。但其對于糖尿病腎病的治療尚不可行[21]。對于其能否用于治療IgA腎病仍需進一步研究。

