口服維A酸聯(lián)合復(fù)方黃黛片治療非高危急性早幼粒細(xì)胞白血病的臨床研究*
何秋連,劉 洋 ,魏 錦 ,鄒興立, 馬春蓉, 曹 紅
1.南充市中心醫(yī)院 血液內(nèi)科(南充 637000); 2.川北醫(yī)學(xué)院附屬醫(yī)院 血液內(nèi)科(南充 637000);3.四川省第五人民醫(yī)院 血液內(nèi)科(成都 610000 )
急性早幼粒細(xì)胞白血病(acute promyelocytic leukemia, APL)是急性髓系白血病(acute myeloid leukaemia,AML)的一種特殊亞型,發(fā)病機(jī)制為特異性染色體異位t(15:17)(q22:21)形成特征性的PML-RARa融合基因,這種基因?qū)е铝<?xì)胞分化停滯在早幼粒細(xì)胞階段,使患者易出現(xiàn)彌散性血管內(nèi)凝血(disseminated intravascular coagulation,DIC)而引起急性死亡[1]。近年來,隨著我國血液工作者首次將維A酸(all-trans retinoic acid ,ATRA)聯(lián)合三氧化二砷(arsenic trioxide ,ATO)的治療模式應(yīng)用于APL治療中,使其從一種高危致死性疾病轉(zhuǎn)化為不需要移植就可能治愈的疾病狀態(tài)。非高危APL患者(白細(xì)胞計(jì)數(shù)≤10×109/ L)占APL80%左右。研究[2]表明,90%以上非高危APL患者可通過ATRA聯(lián)合ATO或化療治愈,幾個(gè)大型研究中心通過臨床試驗(yàn)[3-4]證明:對非高危APL選擇ATRA聯(lián)合ATO的非化療方式也可使95%以上患者獲得完全緩解而長期存活。至此,用于非高危APL治療的ATRA聯(lián)合ATO非化療方案成為NCCN指南的一線推薦治療方案[5]。ATO在我國俗稱砒霜,其在白血病中的治療模式被傳統(tǒng)醫(yī)學(xué)稱之為“以毒攻毒”。20世紀(jì)70年代哈爾濱醫(yī)科大學(xué)張亭棟教授等率先使用口服砷劑治療APL患者,并取得滿意療效[6]。復(fù)方黃黛片(realgar-Indigo naturalis formula, RIF)是我國自主研發(fā)的口服砷劑代表方之一,該藥的出現(xiàn)使非高危APL治療實(shí)現(xiàn)了脫離靜脈輸液治療的可能,為該類疾病的治療提供了更光明的前景。本研究對南充地區(qū)38例接受不同治療方法的非高危APL患者的治療效果、不良反應(yīng)及治療總費(fèi)用進(jìn)行統(tǒng)計(jì)分析,以期對口服治療模式的優(yōu)越性進(jìn)行論證。
1 資料與方法
1.1 臨床資料
選取2014年1月至2018年11月南充市中心醫(yī)院及川北醫(yī)學(xué)院附屬醫(yī)院血液內(nèi)科收治的38例非高危APL患者為研究對象,納入標(biāo)準(zhǔn):18~70歲;參照文獻(xiàn)診斷標(biāo)準(zhǔn)[7]:細(xì)胞遺傳學(xué)檢測t(15∶17)易位或RT-PCR檢測有特征性的PML-RARa融合基因且初診時(shí)白細(xì)胞計(jì)數(shù)≤10×109/L,即診斷為中低危APL患者。排除標(biāo)準(zhǔn):合并妊娠;精神疾病及心律失常、心臟病患者。一旦細(xì)胞形態(tài)考慮APL立即開始治療,待3~4 d基因測試回報(bào)后隨機(jī)分為口服組和靜脈組進(jìn)行治療。口服組患者男11例,女9例;中位年齡37.3(17~68)歲。靜脈組患者男7例,女11例;中位年齡39(23~59)歲。兩組患者入組時(shí)一般臨床資料比較,差異無統(tǒng)計(jì)學(xué)意義(P>0.05)(表1),具有可比性。本研究通過南充市中心醫(yī)院倫理委員會(huì)批準(zhǔn),患者對治療方案知情同意并簽署知情同意書。

表1 兩組患者臨床特點(diǎn)比較[n(%)]
1.2 治療方法
1.2.1 誘導(dǎo)治療方案[8]口服組:ATRA 25 mg/m2/d聯(lián)合RIF 60 mg/kg/d方案直至骨髓緩解,誘導(dǎo)期間出現(xiàn)的貧血、血小板減少、凝血功能異常、感染及分化綜合征均住院處理,誘導(dǎo)時(shí)間29~38 d,統(tǒng)計(jì)誘導(dǎo)治療總費(fèi)用。 靜脈組:ATRA 25 mg/m2/d聯(lián)合ATO 0.15 mg/kg/d方案直至骨髓緩解,誘導(dǎo)期間出現(xiàn)的貧血、血小板減少、凝血功能異常、感染及分化綜合征均住院處理,誘導(dǎo)時(shí)間27~40 d,統(tǒng)計(jì)誘導(dǎo)治療總費(fèi)用。
1.2.2 鞏固治療方案 口服組:ATRA 25 mg/m2/d連續(xù)使用14 d后停用14 d,循環(huán)7個(gè)周期后結(jié)束治療;RIF 60 mg/kg/d使用28 d停用28 d循環(huán)4個(gè)周期后結(jié)束治療,所有鞏固治療方案均在家中進(jìn)行,統(tǒng)計(jì)門診檢查及治療總費(fèi)用。 靜脈組:ATRA 25 mg/m2/d連續(xù)使用14 d后停用14 d,循環(huán)7個(gè)周期后結(jié)束治療;ATO 0.15 mg/kg/d使用28 d停用28 d循環(huán)4個(gè)周期后結(jié)束治療,所有鞏固方案均住院完成,統(tǒng)計(jì)每療程治療總費(fèi)用。
1.2.3 支持治療 根據(jù)患者臨床表現(xiàn)及實(shí)驗(yàn)室檢查及時(shí)給予懸浮紅細(xì)胞、血小板、新鮮冰凍血漿及纖維蛋白原輸注,維持血小板計(jì)數(shù)≥30×109/L、纖維蛋白原>1.5 g/L。誘導(dǎo)化療中白細(xì)胞≥20×109/L,則暫停ATRA,加用柔紅霉素化療,同時(shí)予以地塞米松防治分化綜合癥。
1.2.4 監(jiān)測指標(biāo) 患者在誘導(dǎo)治療過程中,定期檢測血常規(guī)、肝腎功、電解質(zhì)、凝血試驗(yàn),在外周血中白血病細(xì)胞消失,同時(shí)中性粒細(xì)胞≥1.5×109/L,血小板≥100×109/L時(shí)進(jìn)行骨髓細(xì)胞學(xué)檢測及PML-RARa融合基因檢測,了解是否緩解。進(jìn)入鞏固治療后,定期檢測血常規(guī)、肝腎功電解質(zhì)、凝血試驗(yàn)、心電圖及骨髓形態(tài)、微小殘留病灶(minimal residual disease,MRD)及PML-RARA融合基因定量,若MRD及PML-RARA融合基因定量轉(zhuǎn)陰,則3~6個(gè)月復(fù)查1次。
1.2.5 中樞神經(jīng)系統(tǒng)白血病預(yù)防 APL患者治療緩解后即進(jìn)行腰椎穿刺檢查及1次鞘內(nèi)化療(使用化療藥物為甲氨蝶呤5 mg+地塞米松5 mg+阿糖胞苷30 mg),腦脊液檢查提示中樞神經(jīng)系統(tǒng)白血病者,進(jìn)行規(guī)則鞘內(nèi)化療或放療,對腦脊液檢查正常患者每2月復(fù)查1次,直至停藥。
1.3 觀察指標(biāo)
觀察APL患者完全緩解率(complete remission rate,CR)、PML-RARa融合基因轉(zhuǎn)陰時(shí)間、5年無病生存率,并統(tǒng)計(jì)治療總費(fèi)用。
1.4 統(tǒng)計(jì)學(xué)方法
采用SPSS 17.0統(tǒng)計(jì)軟件進(jìn)行數(shù)據(jù)處理,等級計(jì)數(shù)資料采用2檢驗(yàn),定量資料以表示,兩樣本間均數(shù)比較采用獨(dú)立樣本t檢驗(yàn),生存分析采用Kaplan-Meier法。檢驗(yàn)水準(zhǔn)α除特別說明外均設(shè)定為0.05。
2 結(jié)果
2.1 兩組患者治療效果比較

表2 兩組患者療效比較
注:*2=-0.05,P=0.074,#t=1.342 ,P=0.061
2.2 兩組患者治療費(fèi)用比較
納入統(tǒng)計(jì)分析的32例患者中口服組 17例,誘導(dǎo)治療階段化療費(fèi)用分別為(51 127.3±51.6)、(52 332.5±32.9)元,兩組比較,差異無統(tǒng)計(jì)學(xué)意義(P>0.05)。兩組患者7次鞏固療程治療總費(fèi)用分別為(76 331.1±21.1)、(114 153.2±45.5)元,兩組比較,差異有統(tǒng)計(jì)學(xué)意義(P<0.05)。口服組在鞏固治療階段治療費(fèi)用明顯少于靜脈組(所有費(fèi)用均為醫(yī)保報(bào)銷前實(shí)際生成費(fèi)用)(表3)。

表3 兩組患者治療費(fèi)用比較(元,
2.3 兩組患者血液學(xué)緩解及PML-RARa融合基因轉(zhuǎn)陰時(shí)間
32例APL患者PML-RARa融合基因均提示陽性。兩組患者在治療后獲得血液學(xué)緩解時(shí)間、CR后3個(gè)月PML-RARa融合基因轉(zhuǎn)陰率、CR后6個(gè)月所有患者監(jiān)測PML-RARa融合基因轉(zhuǎn)陰率比較,差異均無統(tǒng)計(jì)學(xué)意義(P>0.05)。5年隨訪,兩組患者PML-RARa融合基因均提示陰性(表4)。
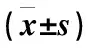
表4 兩組患者血液學(xué)緩解及PML-RARa融合基因轉(zhuǎn)陰時(shí)間比較
注:CR為完全緩解
2.4 兩組患者生存時(shí)間及并發(fā)癥發(fā)生情況
隨訪時(shí)間至2018年11月底,口服組5組生存率(98.92%)與靜脈組(100.00%)比較,差異無統(tǒng)計(jì)學(xué)意義(P>0.05)(圖1)。兩組患者主要并發(fā)癥:口服組中發(fā)生出血/DIC 6例,感染3例,早期死亡1例; 靜脈組中發(fā)生出血/DIC 4例,感染3例,未發(fā)生早期死亡。兩組患者并發(fā)癥發(fā)生情況比較,差異無統(tǒng)計(jì)學(xué)意義(P>0.05)。

圖1 兩組患者治療后生存曲線
3 討論
APL發(fā)病機(jī)制是因特異性染色體異位導(dǎo)致形成PML-RARa融合基因,干擾了全反式維甲酸(ATRA)作用的信號轉(zhuǎn)導(dǎo),導(dǎo)致ATRA活性受到抑制。20世紀(jì)70年代,中國血液病專家開始使用維甲酸治療APL,使這類曾經(jīng)死亡率極高的白血病得到較好緩解。20世紀(jì)90年代,中國專家又將砷劑用于APL治療,兩藥聯(lián)合使APL成為可治愈的白血病。藥物作用機(jī)制為:ATRA以RARa為靶點(diǎn),通過降解PML-RARa融合蛋白,誘導(dǎo)早幼粒細(xì)胞分化,從而起到治療作用[9]; ATO低濃度時(shí)誘導(dǎo)APL細(xì)胞分化,高濃度時(shí)誘導(dǎo)細(xì)胞凋亡,其發(fā)揮藥力作用的具體分子機(jī)制在于ATO以PML為靶點(diǎn),激發(fā)PML-RARa蛋白的降解[10]。我國傳統(tǒng)中藥RIF[5-6]主要成分為青黛、雄黃、太子參、丹參,方以雄黃為君,主要成分為As4s4,具有直接細(xì)胞毒作用,能通過誘導(dǎo)細(xì)胞死亡,包括誘導(dǎo)凋亡相關(guān)基因及干擾線粒體的能量代謝,從而抑制白血病細(xì)胞的過多增殖,還可通過抑制細(xì)胞增殖,促進(jìn)細(xì)胞分化,破壞白血病患者細(xì)胞膜,抑制BNA、RNA的合成、克隆及增殖能力;青黛為臣,具有性味,咸寒,清熱解毒、涼血消斑、清肝瀉火、定驚功用;丹參為佐,活血通淤、涼血消腫、清心除煩之功效;太子參為使,體潤性和、補(bǔ)氣生津。四藥配伍清熱解毒,益氣生血,成為砷劑的經(jīng)典口服代表方劑。RIF Ⅱ期臨床試驗(yàn)協(xié)作組通過區(qū)組、雙盲雙模、隨機(jī)對照、多中心臨床實(shí)驗(yàn)隨機(jī)分組方法得出結(jié)論:RIF對初治APL有較高CR和耐受性[11]。 Zhu等[12]通過多中心數(shù)據(jù)表明,口服RIF可以替代靜脈砷劑。
本研究表明,在非高危APL成人患者治療中,口服ATRA+RIF組與靜脈ATRA+ATO組在APL誘導(dǎo)緩解所需時(shí)間、PML-RARa融合基因轉(zhuǎn)陰及持續(xù)時(shí)間、主要并發(fā)癥、生存率方面比較,差異均無統(tǒng)計(jì)學(xué)意義,與其他學(xué)者研究結(jié)果一致[8,13-15],進(jìn)一步證實(shí)這種口服、非化療的ATRA+RIF治療模式安全、有效,完全可以在非高危APL的治療中替代原有治療方式。
口服組誘導(dǎo)期治療總費(fèi)用與靜脈組比較,差異無統(tǒng)計(jì)學(xué)意義,但在7次循環(huán)鞏固治療總費(fèi)用中,口服組有明顯優(yōu)勢,與實(shí)現(xiàn)門診管理后其他藥品費(fèi)用下降、治療費(fèi)、床位及床位管理費(fèi)、材料費(fèi)等明顯下降相關(guān)。腫瘤患者門診管理既節(jié)約了治療費(fèi)用,同時(shí)使患者回歸家庭,明顯提高患者及家人生活質(zhì)量;同時(shí)節(jié)約了醫(yī)療資源。
生存率是評估急性白血病新治療方法療效的主要指標(biāo),觀察本研究中38例患者的生存曲線,32例經(jīng)過2年治療的患者終點(diǎn)事件并未發(fā)生,5年觀察時(shí)間點(diǎn)仍未見終點(diǎn)事件發(fā)生,這可能與以下因素相關(guān):1)患者均為中低危成年患者,治療反應(yīng)好、平均年齡較小、其他系統(tǒng)不良事件發(fā)生率小;2)定期進(jìn)行MDR及PML-RARa融合基因檢測,一旦PML-RARa融合基因出現(xiàn)>10-3,立即開始干預(yù)治療,控制白血病全面復(fù)發(fā);3)ATRA聯(lián)合砷劑可靶向治療APL的基因突變,療效顯著[16]。
研究[17-18]報(bào)道,ATRA聯(lián)合砷劑不良反應(yīng)包括體液潴留、肝腎功損害、胃腸道反應(yīng)、皮疹、心血管系統(tǒng)損害、皮膚色素沉著、皮膚角化癥、糖尿病、神經(jīng)系統(tǒng)損害、第二腫瘤等。本研究藥物不良反應(yīng)表現(xiàn)并不顯著,部分患者出現(xiàn)ALT/AST升高、心率失常:有4例患者出現(xiàn)早搏,但經(jīng)對癥處理后并未影響患者治療方案的實(shí)施及預(yù)后。參照中國APL診療指南(2018年版)[19]所推薦的劑量為ATO 0.16 mg/kg /d及ATRA 45 mg/m2/d,其不良反應(yīng)小的原因可能與該隨訪實(shí)驗(yàn)中所選藥物使用劑量小相關(guān)(ATO 0.15 mg/kg /d,ATRA 25 mg/m2/d)。
綜上,本研究結(jié)果表明,在非高危 APL中,ATRA聯(lián)合RIF在療效、CR、主要不良反應(yīng)、PML-RARa融合基因轉(zhuǎn)陰時(shí)間、生存率等方面與靜脈砷劑方案相似。本研究進(jìn)一步證實(shí):口服ATRA+RIF治療模式在非高危APL中完全能替代靜脈砷劑,與其他醫(yī)療中心研究結(jié)果一致。同時(shí)方案簡化了低中危APL治療模式、降低了治療費(fèi)用、減少了患者穿刺次數(shù),對提高患者生活質(zhì)量有重大積極意義,值得臨床推廣使用。但APL發(fā)病率較低,本方案不足之處在于納入病例數(shù)量偏少,患者隨訪時(shí)間較短,未來仍需更長隨訪時(shí)間、納入更多病例行進(jìn)一步研究。