米諾環素通過自噬抑制結腸癌細胞增殖的作用研究
李靈玲,蘭景彬,何賢祿
1.成都市婦女兒童中心醫院(成都 610091);2.成都醫學院(成都 610500);3.成都醫學院第二附屬醫院(成都 610051)
結腸癌(colorectal cancer,CRC)是全世界高發的惡性腫瘤之一,其致死率居各類腫瘤第2位。CRC發病率高,預后差,嚴重威脅著人們的健康生活[1]。目前,CRC常用的治療手段包括手術、放療及化療,但這些手段不良反應大、復發率高,嚴重影響患者的治療。因此,尋找新的抗CRC藥物具有重要意義[2]。米諾環素是一種四環素類抗生素,主要用于治療痔瘡類疾病[3]。近期研究[4-6]顯示,米諾環素能有效抑制卵巢癌、骨癌、膠質瘤,但關于米諾環素對CRC抑制作用的報道較少。本實驗以人CRC細胞LoVo細胞為研究對象,檢測米諾環素對LoVo細胞增殖和自噬水平的影響,并探討自噬在米諾環素抑制CRC細胞增殖中的作用。
1 材料與方法
1.1 材料
人CRC細胞LoVo購自中科院上海生命科學研究院細胞資源中心,于-80 ℃凍存;米諾環素(質量分數>98%)和自噬抑制劑氯喹(CQ)均購自上海阿拉丁生物科技有限公司;四唑鹽(MTT)和二甲基亞砜(DMSO)購自美國Sigma公司;細胞培養基Dulbecco′s Modified Eagle Medium(DMEM)購自以色列BI公司;胎牛血清購自德國PAN公司;雙抗(青霉素、鏈霉素溶液)購自美國Hyclone公司;Atg5 siRNA購自上海吉瑪制藥技術有限公司;蛋白質預染Marker購自美國Thermo Fisher公司;RIPA細胞裂解液和BCA蛋白定量試劑盒購自上海碧云天生物公司;β-actin、Beclin1、p62、LC3、Akt、p-Akt、mTOR、p-mTOR、Cleaved-Caspase3、Cyt-C、Bax單克隆抗體均購自美國Santa Cruz公司;兔二抗、鼠二抗均購自成都正能生物技術有限責任公司;ECL顯影液、PVDF 膜購自美國Millipore公司;其他化學試劑均為國產分析純。
1.2 方法
1.2.1 細胞培養 LoVo細胞用DMEM培養基(含10% 胎牛血清、100 U/L青霉素、100 mg/L鏈霉素)于37 ℃,5% CO2培養。
1.2.2 MTT法測細胞活力 取對數生長期的LoVo細胞,以5×103個/孔的密度接種于96孔板,于37 ℃培養箱中孵育過夜。待細胞密度長至40%時,加入不同質量濃度梯度(0.390 62、0.781 25、1.562 5、3.125、6.25、12.5、25、50、100、200、400 μmol/L)米諾環素,放入37 ℃培養箱中繼續培養48 h,每組設置4個復孔,另設不含細胞僅有培養基的空白對照孔。44 h后,將加藥培養好的96孔板取出,在避光條件下向每孔加入20 μL MTT(5 mg/mL),于37 ℃、5% CO2培養箱中孵育4 h,以空白對照孔調零,用酶聯免疫檢測儀檢測490 nm處的吸光度。
1.2.3 克隆形成實驗 取指數生長期的LoVo細胞,以100個/孔細胞接種于無菌六孔板中,搖勻,放入37 ℃培養箱中培養24 h。用米諾環素(0、3、6 μmol/L)處理LoVo細胞,放入37 ℃培養箱中培養2周后,棄六孔板中液體,PBS洗滌3次,每次5 min。 用4%多聚甲醛固定細胞15 min,PBS洗3次, 每次5 min。加入結晶紫,室溫,染色15 min,PBS洗滌3次,每次5 min。觀察、拍照。
1.2.4 TUNEL法檢測細胞凋亡 用米諾環素(0、3、6 μmol/L)處理LoVo細胞,培養箱37 ℃培養24 h。每組收集約1×106個細胞,用PBS液洗1次,重懸,加入經賴氨酸處理過的載玻片上,自然干燥。用4%多聚甲醛固定30 min后,PBS洗滌3次,每次5 min。然后加入含0.1% TritonX-100的PBS,冰浴孵育2 min,PBS洗滌3次,每次5 min,在樣品上加50 μL TUNEL檢測液,37 ℃避光孵育60 min,PBS洗滌3次,每次5 min,用抗熒光淬滅封片液封片后熒光顯微鏡下觀察,計數凋亡細胞。
1.2.5 免疫熒光檢測自噬體的形成 參照文獻[7]方法,通過LC3抗體免疫熒光強弱檢測細胞自噬體的形成。在6孔板中放入處理過的蓋玻片,后將細胞鋪在蓋玻片上,于5% CO2、37 ℃培養箱中培養過夜。待細胞貼壁后,用米諾環素(0、3、6 μmol/L)處理LoVo細胞,在37 ℃,5% CO2培養箱中培養24 h。4%多聚甲醛固定15 min, PBS溶液洗滌3次, 每次5 min。0.5% Triton X-100室溫通透20 min,PBS溶液洗滌3次,每次5 min。5%脫脂奶粉封閉1 h,PBS溶液洗滌3次,每次5 min。LC3一抗室溫孵育1 h,PBS溶液洗滌3次,每次5 min。 FITC-熒光二抗室溫孵育1 h,PBS溶液洗滌3次,每次5 min,滴加抗熒光淬滅封片液,熒光顯微鏡觀察,采集圖像。
1.2.6 MTT法測siRNA沉默自噬關鍵基因Atg5后藥物對細胞的影響 取對數生長期結腸癌細胞LoVo以1×105/孔接種于6孔板中,培養24 h,加入含血清和雙抗的正常培養基2 mL,以每100 μL培養基中含有150 ng Atg5 siRNA或Scramble siRNA并加入轉染試劑12 μL/孔,輕搖使溶液混合均勻,室溫中放置10 min。每孔100 μL輕輕加入6孔板中,混合均勻,37 ℃培養48 h。將轉染后的細胞轉移到96孔板中。向LoVo細胞加入最終體積分數為0、3、6 μmoL/L米諾環素,37 ℃培養48 h。將加藥培養好的96孔板取出,在暗光條件下向每孔加入20 μL MTT(5 mg/mL)處理4 h后490 nm處的OD值。
1.2.7 蛋白質印跡法 收集經藥物處理后的細胞,按照說明書,每1× 106個細胞加入100 μL RIPA 裂解液,振蕩混勻,超聲破碎細胞。12 000 r/min,4 ℃,離心15 min(離心半徑6 cm),取上清用BCA蛋白定量試劑盒進行定量分析,以確保蛋白上樣量一致。加入上樣緩沖液,于90 ℃加熱變性10 min, 通過 12% SDS-PAGE電泳分離后,轉膜至PVDF膜上,5%脫脂奶粉室溫封閉1 h,TBST洗滌3次,每次5 min,加入稀釋的相應一抗,4 ℃孵育過夜,TBST洗滌3次,每次5 min,辣根過氧化物酶標記二抗室溫孵育1 h,TBST洗滌3次,每次5 min,加入ECL顯影液后暗室中通過X線片曝光。
1.3 統計學方法

2 結果
2.1 米諾環素抑制CRC細胞的增殖
采用MTT實驗和克隆形成實驗檢測經不同濃度的米諾環素處理CRC細胞LoVo 48 h后細胞活力的變化。MTT實驗結果顯示:米諾環素可促進LoVo細胞的胞內毒性,細胞活力下降,且呈濃度依賴性。克隆形成實驗結果顯示:米諾環素處理LoVo細胞后,細胞克隆數明顯減少,并且克隆數和米諾環素的濃度呈負相關。實驗結果表明:米諾環素能顯著抑制CRC細胞LoVo的細胞增殖,且抑制程度呈藥物濃度依賴性(圖1)。

圖1 米諾環素對CRC細胞增殖的影響
注:A:MTT實驗檢測米諾環素處理下LoVo的細胞活力;B:米諾環素處理下LoVo細胞的克隆形成情況及細胞克隆數統計;與空白對照組比較,ns:差異無統計學意義;*P<0.05;**P<0.01;***P<0.001
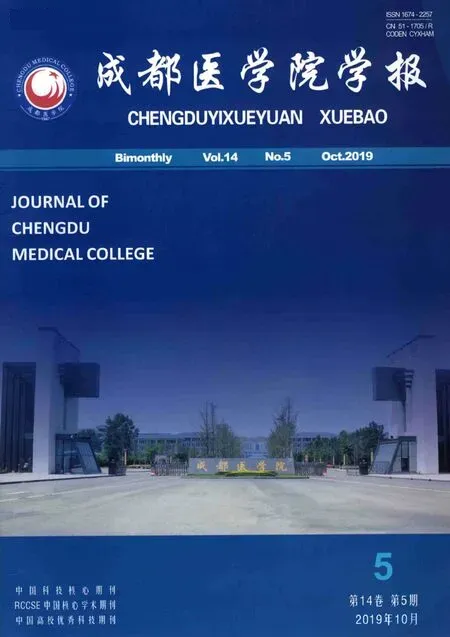
2.2 米諾環素對CRC細胞凋亡的影響
采用TUNEL染色法和蛋白質印跡法檢測經0、3、6 μmol/L米諾環素處理LoVo細胞24 h后,細胞凋亡情況。TUNEL染色實驗結果顯示:米諾環素處理CRC細胞LoVo后,凋亡指數無明顯變化。蛋白質印跡實驗結果顯示:米諾環素處理CRC細胞LoVo后,Bax、Cyt-C、Cleaved-Caspase3等凋亡相關標志蛋白表達無明顯變化。實驗結果表明:米諾環素對CRC LoVo細胞增殖的抑制作用不是由細胞凋亡所致(圖2)。
2.3 米諾環素促進CRC細胞自噬
采用免疫熒光、蛋白質印跡法檢測米諾環素對CRC細胞LoVo自噬的影響。免疫熒光實驗結果顯示:采用米諾環素(0、3、6 μmol/L)處理LoVo細胞24 h后,胞內LC3熒光斑點數明顯增加,表明米諾環素促進自噬體的形成。經米諾環素處理后,自噬相關基因Beclin-1、LC3-Ⅱ的表達增加,自噬抑制基因 p62 的表達降低。為進一步驗證米諾環素對CRC細胞自噬的影響,采用米諾環素單獨處理和米諾環素與自噬抑制劑氯喹(CQ)共處理CRC細胞LoVo后檢測LC3-Ⅱ表達情況。結果顯示:與CQ處理組相比,CQ和米諾環素共處理組LC3-Ⅱ含量明顯增加,表明米諾環素能誘導完整的自噬流。以上實驗結果表明:米諾環素促進CRC細胞自噬(圖3)。
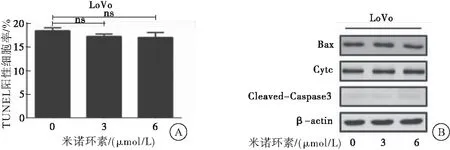
圖2 米諾環素對CRC細胞凋亡的影響
注:A:TUNEL實驗檢測米諾環素處理下LoVo細胞的凋亡率;B:蛋白質印跡法檢測米諾環素處理下凋亡相關標志蛋白的變化;與空白對照組比較,ns:差異無統計學意義,P>0.05
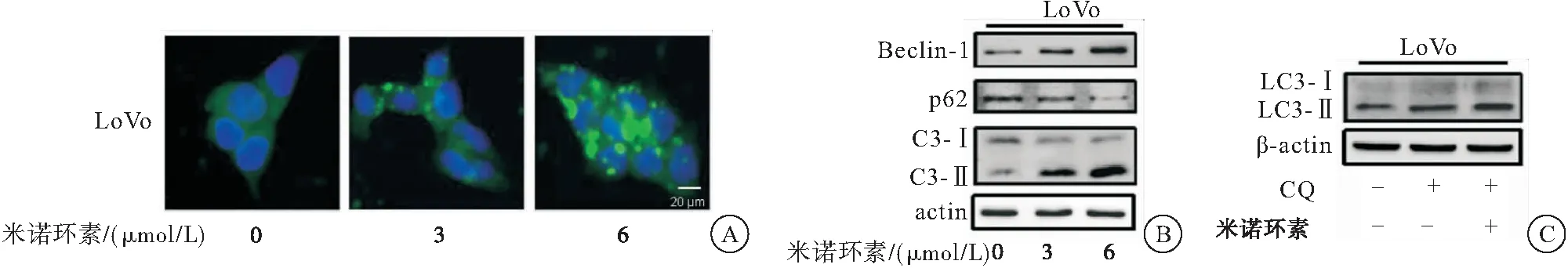
圖3 米諾環素誘導CRC細胞產生自噬
注:A:免疫熒光檢檢測米諾環素處理下LoVo細胞中的LC3熒光斑點;B:蛋白質印跡法檢測米諾環素處理下自噬相關標志蛋白的變化;C:米諾環素單獨處理和米諾環素與自噬抑制劑CQ共處理細胞LoVo后檢測LC3-Ⅱ表達情況
2.4 米諾環素促進自噬進而抑制CRC細胞增殖
采用siRNA沉默自噬相關基因Atg5后檢測米諾環素對CRC LoVo細胞活力的影響(圖4)。結果顯示:與對照組相比,米諾環素作用后,沉默組細胞活力有明顯回復。上述實驗結果表明米諾環素通過促進CRC細胞LoVo自噬,進而抑制CRC細胞增殖。
圖4 MTT法檢測siRNA沉默Atg5后米諾環素對CRC細胞增殖的影響
注:與siScramble組比較,**P<0.01
2.5 米諾環素抑制Akt/mTOR信號通路
采用免疫印跡檢測米諾環素對CRC LoVo細胞Akt、mTOR蛋白磷酸化水平的影響(圖5)。結果顯示:米諾環素處理LoVo細胞24 h后,p-Akt、p-mTOR的蛋白表達量均明顯下調,而Akt、mTOR的蛋白表達量未發現明顯差異。上述實驗結果表明:米諾環素通過抑制Akt/mTOR信號通路促進CRC細胞自噬,進而抑制CRC細胞增殖。

圖5 米諾環素對Akt、mTOR蛋白磷酸化水平的影響
3 討論
CRC是世界上最常見的消化道惡性腫瘤之一,由于其高發病率和死亡率而倍受人們關注[1]。CRC的早期診斷是目前人類需要攻克的一大難題,由于其早期發現率較低,許多患者診斷時已是進展期CRC。進展期CRC轉移率和手術復發性高,因此尋找妥善的CRC治療手段至關重要。米諾環素是二代半合成四環素類衍生物抗生素,最初主要被當作抗菌藥使用。近年研究[8-9]報道,米諾環素除抗菌作用外,還具抗炎抑制腫瘤增殖等作用。本研究證實米諾環素能夠有效抑制CRC細胞的增殖,并呈濃度依賴性。
誘導細胞凋亡是許多化療藥物抑制腫瘤細胞增殖的主要機制。為研究米諾環素抑制結腸癌細胞增殖的機制,本研究選取3、6 μmol/L米諾環素處理人CRC LoVo細胞后,釆用TUNEL染色及蛋白免疫印跡檢測,染色結果發現米諾環素組的細胞凋亡率與正常組比較,差異無統計學意義;而且蛋白免疫印跡檢測發現米諾環素處理結腸癌細胞后凋亡相關標志蛋白(Bax、Cyt-c、Cleaved-Caspase3等)的表達比較,差異無統計學意義。該實驗結果提示米諾環素抑制CRC細胞增殖存在其他主要機制。
自噬是除凋亡外的另一種細胞程序性死亡方式,是一種將胞質內容物遞送給溶酶體進行降解的過程,也是維持真核細胞生存的重要調節過程。近年研究[10-11]表明,自噬是一把雙刃劍,一方面能促進腫瘤細胞的發生發展,另一方面又能介導腫瘤細胞發生自噬性死亡。如何運用好自噬這把雙刃劍是治療腫瘤的新方向。自噬的出現標志是自噬體的形成。本研究采用LC3抗體進行細胞免疫熒光檢測發現,米諾環素處理CRC細胞后,胞質中LC3熒光斑點數明顯增加,提示米諾環素誘導CRC細胞自噬體形成增加。進一步采用蛋白免疫印跡檢測發現,米諾環素組較正常組自噬相關基因Beclin-1、LC3-Ⅱ的表達增加,自噬抑制基因p62的表達降低。同時運用自噬抑制劑CQ發現,聯合運用CQ和米諾環素較單用CQ能明顯增加LC3-Ⅱ表達,提示米諾環素能促進CRC細胞自噬。為了進一步研究細胞自噬是否在米諾環素抑制人CRC細胞增殖中起作用,采用siRNA沉默自噬相關基因Atg5后檢測發現,米諾環素處理后,沉默組較正常組細胞活力有明顯回復,說明米諾環素通過促進細胞自噬,進而抑制CRC細胞增殖。自噬是一個十分復雜的生物學過程,涉及細胞內關鍵分子事件的變化,其中,AKT/mTOR細胞信號轉導通路作為自噬最重要的上游調控因子而受到廣泛關注[12]。本研究證實米諾環素能夠抑制AKT、mTOR蛋白的磷酸化水平從而抑制AKT/mTOR信號通路。
綜上所述,本研究結果解釋了米諾環素通過抑制Akt/mTOR信號通路促進自噬進而抑制CRC細胞增殖,為CRC治療奠定了理論基礎。