經皮腎鏡碎石術治療經腰開放取石術后復發性腎結石的療效與安全性探討
季健 普超 儲永波 孫曉磊 代興銳云南省第三人民醫院泌尿外科6500昆明云南省老年病醫院內三科
PCNL因其結石清除率高、創傷小,目前已成為治療腎結石的首選方法之一[1]。但在PCNL常規開展以前,上尿路結石主要通過經腰切口的開放手術來治療。而泌尿系結石作為一種全球性的疾病,治療后易復發,10年復發率可高達50%[2]。在臨床工作中,早期患者曾經因上尿路結石行經腰切口的開放手術,術后結石復發并不罕見。對此類患者的治療,目前我們還是以PCNL為主。但現階段國內外對經腰開放取石術后復發性腎結石通過PCNL治療的研究較少,因此有必要對此類患者的特點、治療效果和可能存在的風險進行總結。
本研究采用回顧性病例對照研究,通過比較經腰開放取石術后復發性腎結石患者和首次PCNL患者術前臨床檢驗和影像學特點,以及手術安全性及手術效果等指標,為臨床決策提供參考。
1 資料與方法
1.1 臨床資料
選取云南省第三人民醫院2016年6月-2018年5月收治的52例患者,根據既往是否行經腰開放取石術,將52例患者分為開放取石術后PCNL組(A組12例)和首次PCNL組(B組40例)。A組均因泌尿系結石行經腰腹膜后路徑切開取石術,其中既往行腎盂切開取石術患者6例,輸尿管切開取石患者4例,腎實質切開取石術2例;均因開放取石術后6~10年結石復發就診。病例納入標準:①直徑2~4 cm的腎盂或腎盞結石;②腎積水深度為0~4 cm;③無明確的手術禁忌證。排除標準:①先天性腎臟畸形;②嚴重的心肺功能不全,不能耐受俯臥位及全麻手術的患者;③嚴重凝血功能異常的患者;④腎實質或腎盂內嚴重感染證據者;⑤輸尿管結石。患者術前均完善血、尿、糞便常規、肝腎功能、中段尿培養等檢查。行泌尿系超聲、KUB或IVU、泌尿系CT檢查等明確結石體積、位置及腎積水程度。所有患者術前均預防性應用抗生素治療3 d,完善常規術前準備。如有泌尿系感染致發熱等全身癥狀者,則以敏感抗生素積極抗感染及相關對癥支持治療控制發熱等全身癥狀1周以上,待血白細胞,血清降鈣素原(procalcitonin,PCT)及血培養正常后方可手術。兩組患者組間年齡、性別及結石罹患側、結石負荷等數據差異無統計學意義(P>0.05),詳見表l。所有患者均為一期手術,手術由同一醫師完成,患者對于手術均知情同意,上報并得到醫院倫理委員批準。

表1 兩組患者基本資料比較
1.2 手術方法
患者全麻,首先取截石位。膀胱鏡直視下于患側輸尿管逆行置入F5輸尿管導管,留置F20三腔導尿管。改體位為俯臥位,調整腰橋。超聲引導下經腋后線與肩胛下線之間第12肋下或10、11肋間選擇穿刺點,穿刺成功后,留置超滑導絲。使用筋膜擴張器從F4依次擴張至F22后,成功建立皮腎通道,置入F18李遜腎鏡。兩組患者均使用低壓重力滴注法進行沖洗,具體操作為3 000 mL生理鹽水持續滴注,平均流量約200 mL/min,鹽水袋底部高于腎平面40~60 cm[3]。使用氣壓彈道超聲聯合碎石系統擊碎結石并吸出碎石或鈥激光將結石擊碎后直接鉗夾取出。認真檢查視野內結石清除情況及損傷情況,在輸尿管內留置F4.8雙J管1根后退鏡。留置F22腎造瘺管。術后1個月于膀胱鏡下拔除雙J管。
1.3 觀察指標
記錄兩組患者入院尿液常規白細胞數、術前血紅蛋白值。由CT檢查計算腎積水程度、腎皮質厚度、結石占據的腎盞個數。腎皮質厚度具體方式為測量腎皮質最大徑、最小徑取兩者平均值。術后2~3 h測定血紅蛋白值、血白細胞值、術后16~18 h測定血PCT值,如有異常升高給予連續PCT檢測直至正常,并記錄最高PCT值。術后統計最高體溫值、碎石取石時間、相關并發癥發生率。術后2~3 d行胸片及KUB檢查,結石長徑>4 mm定義為殘留結石并統計殘石數。
1.4 統計學方法
采用SPSS 17.0統計軟件處理數據,計量資料數據采用±s表示,正態分布且滿足方差齊性的計量資料比較采用方差分析。計數資料無序分類變量采用χ2檢驗。不能滿足正態分布或方差齊性的計量資料以及計數資料有序分類變量采用中位數(四分位間距)[M(IQR)]表示,采用Mann-WhitneyU檢驗。以P<0.05為差異有統計學意義。
2 結果
52例患者均全部一次性成功建立通道,未發生大出血、周圍器官損傷等相關并發癥,無膿毒血癥、感染性休克及死亡病例。開放術后PCNL組有3例患者PCT異常升高,4例患者術后出現發熱,6例患者出現白細胞異常升高。首次PCNL組1例PCT異常升高,2例患者術后出現發熱現象,3例患者出現白細胞異常升高。
2.1 術前資料比較
A組入院時尿液常規白細胞數、術前腎積水程度、結石占據的腎盞個數明顯大于B組(P<0.05);A組腎皮質厚度小于B組(P<0.05),結果詳見表2。

表2 兩組術前資料比較
2.2 術中及術后資料比較
B組術后發熱人數、血白細胞值、PCT值低于A組(P<0.05),A組碎石取石時間大于B組,差異有統計學意義(P<0.05)。兩組之間血紅蛋白下降值差異無統計學意義(P>0.05)。A組術后殘石數量大于B組(P<0.05),結果詳見表3。
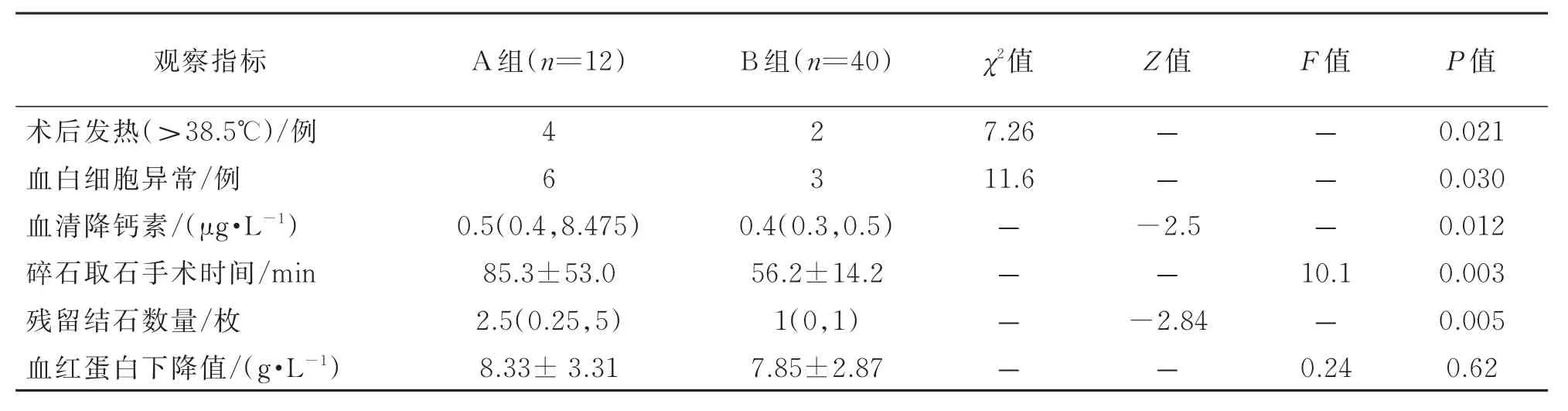
表3 兩組術中及術后資料比較
3 討論
對于經腰切口開放取石術后結石復發的患者,如果具備經皮腎鏡手術指征,目前主要以PCNL作為主要的處理手段。但此類患者的臨床特征具有一定的特殊性,B超主要表現為腎臟形態相對不規則、腎臟輪廓及實質回聲欠均勻以及結石分布較為分散。此外,患者還常伴有不規則的腎積水,且通常合并有較為嚴重的泌尿系統感染。為此,我們通過回顧性病例對照研究來探討經腰開放取石術后復發性腎結石PCNL與首次PCNL在術前尿液白細胞數、腎臟積水、腎皮質厚度和結石特點以及手術安全性和手術效果方面的異同。
PCNL會出現發熱、感染、出血和結石殘留等并發癥,其中術中和術后出血是最主要的并發癥之一[4-6]。有學者發現有開放取石手術史的患者腎臟以及腎周組織脆性增大,再次PCNL時易撕裂腎組織,損傷腎內血管[7]。另外,由于腎臟組織脆性大,損傷后的收縮能力也差,造成術中和術后出血增多。本組12例患者均成功建立通道,碎石取石操作的視野較為清晰,無一例發生術中及術后大出血的情況。推測其可能的原因是開放取石術后患者腎積水較重,腎皮質較薄,建立穿刺通道相對容易,導致出血的風險較小。因此,雖然開放術后PCNL組患者可能存在著腎臟組織脆性增大,開放術后腎及腎周組織瘢痕形成等不利因素,增加出血的風險,但在手術技術成熟的情況下,如果不進行大角度碎石,其大量出血的可能性并不明顯增加。本研究中兩組患者術后血紅蛋白下降值沒有明顯的差異,除了以上原因之外,也可能是由于PCNL大出血并發癥發生率較低,由于樣本量較少,在統計學上尚不足以檢測出二者之間的差異性,所以需要進一步研究來明確開放術后PCNL患者的出血風險。最后,本研究發現A組腎積水程度較B組嚴重,其腎臟解剖形態不規則,腎皮質較薄,其產生原因可能與開放手術的組織損傷愈合過程中產生的粘連有關。雖然A組有更明顯的腎積水,客觀上B超定位和手術穿刺的難度會有所降低,但A組患者結石占據的腎盞個數明顯多于B組,結石位置的不確定性和非連續性,以及腎臟集合系統的不規則形態卻增加了手術難度。最終導致碎石取石手術時間較長和殘石數較高。
經皮腎鏡手術安全性研究多集中于出血和感染等方面,重癥感染是PCNL比較嚴重的并發癥之一,根據文獻報道PCNL后發熱率為25.8%~37.0%,其引發的嚴重的膿毒血癥可能導致患者感染性休克甚至死亡[8-10]。本研究通過比較術前相關指標,發現A組入院尿液常規白細胞數明顯高于B組,分析其主要的原因可能與反復的結石復發、梗阻以及首次開放手術治療體內植入物有一定的關系。目前多數學者認為,尿路感染是PCNL術后具有潛在危險性的并發癥之一[11]。本研究同樣發現,A組術后無論在發熱還是在感染指標方面均明顯高于B組。因此,對于開放術后PCNL患者,其術中和術后感染風險可能會明顯的增加,除需要給予足夠的重視之外,術前有必要通過有效的治療來干預和控制泌尿系感染來減低PCNL重癥感染等嚴重并發癥發生。PCT是降鈣素的前體物質,其已被證明可作為PCNL后尿膿毒血癥早期診斷較理想的標志物。此外,PCT對尿膿毒癥的早期診斷具有良好敏感性和特異性,可作為尿膿毒癥患者的常規檢測指標[12-13]。本研究發現A組PCT值明顯高于B組。雖然A組所有患者循環系統穩定,未發生嚴重的膿毒血癥,無感染性休克及死亡病例,但其感染和潛在發生膿毒血癥的風險需要引起足夠的警覺。有研究表明,由灌注引起的術中腎集合系統壓力失衡,是導致細菌毒素和致熱原入血而出現術后發熱或膿毒血癥的重要原因[14-15],本研究兩組手術患者均使用低壓重力滴注法沖洗而沒有使用常見的灌注泵灌注法沖洗。灌注泵灌注法比低壓重力滴注法可能產生的更高的腎盂壓,因此,在采用灌注泵灌注法處理開放取石術后腎結石患者時其感染的風險可能增加,需要引起手術醫師的重視。
綜上所述,經腰開放術后腎結石復發患者無論在術前評估、準備以及術中操作等多方面均較首次經皮腎鏡難度有一定程度的增加。經腰開放術后腎結石復發患者術后感染風險較大,術后結石清除率低,但出血風險還需要進一步觀察。因此,此類患者需要更為完善圍手術期的處理、評估和解釋工作。

