機器人輔助腹腔鏡腎部分切除術分期治療不同病理類型雙側腎癌1例報告并文獻復習
汪凱紅 張億達 郭炬 王共先 孫庭 傅斌 江豪 曹潤福江西省南昌大學第一附屬醫院泌尿外科330000南昌
腎癌多見于單側,雙側腎癌少見且病理類型常相同,我們收治1例罕見的雙側不同病理類型的腎癌,為最大可能地保留腎單位,對患者行機器人輔助腹腔鏡腎部分切除術(nephron-sparing surgery,NSS),現報告如下。
1 資料與方法
1.1 病例資料
患者,女,61歲。“因雙側腰部脹痛2月余”于2017年12月7日入院。患者2個月前因勞累或久立后出現雙側腰部持續酸脹痛。查體未見明顯異常。多層螺旋CT雙腎動靜脈(CTA+CTV)檢查示:雙腎動靜脈顯影良好,未見明顯充盈缺損及狹窄。右腎病灶由右腎動脈分支供血,左腎病灶未見較大的供血動脈(圖1)。右腎中極腎輪廓局限性隆起,腎實質內見一5.3 cm×5.5 cm分葉狀占位影,邊界尚清,腫物密度不均勻,行增強CT提示早期腫物呈高密度、不均一強化,延遲期呈相對等低密度的不均一強化,右腎下盞內可見大小約0.2 cm斑點狀高密度影(圖2A、B);左腎中極見類圓形稍低密度影,其內見少許高密度影,大小為4.1 cm×4.0 cm,邊界清楚,增強CT提示輕度不均一強化(圖2C、D);考慮雙腎癌可能。左腎腫瘤R.E.N.A.L.評分6分;右腎腫瘤R.E.N.A.L.評分8分。實驗室檢查:血Scr 71.4 μmol/L,腎動態顯像示總GFR值68.36 mL/min,左腎GFR值28.08 mL/min,右腎 GFR 值:40.28 mL/min。入院診斷:①雙腎占位;②右腎小結石。
1.2 手術方法
完善術前檢查后,患者于2017年12月13日在全身麻醉下行機器人輔助腹腔鏡不阻斷腎蒂左側腎部分切除術,患者取右側臥位,選取腋中線髂嵴上2 cm作為鏡頭通道,腋前線肋緣與髂嵴連線中點偏腹側2 cm處為1號操作臂通道,腋后線平1號臂水平為2號操作臂位置,1號臂穿刺點與鏡頭穿刺點連線中點下方8 cm為助手通道。任意兩個通道之間的距離>8 cm,機器人兩操作臂穿刺通道點與鏡頭操作通道連線成角>120°(圖3A),游離顯露出左腎中極腫瘤,直徑約4 cm。于腎脂肪囊外腎后方腰大肌前方游離腎門處,游離出左腎動脈,并用小兒導尿管懸吊標記(圖3B),置入“bulldog”血管夾,以備需要時能及時阻斷腎動脈,使用電剪距腫瘤邊緣0.2 cm切開腎實質,并將腫瘤完整切除(圖3C);取2-0帶CT-1針倒刺線15 cm線尾打結后夾持Hem-o-lok夾對腎臟創面連續縫合。切除的標本由助手孔取出。患者于2017年12月26日在全身麻醉下行機器人輔助腹腔鏡阻斷腎蒂右側腎部分切除術,手術步驟同上,在操作過程中置入“bulldog”血管夾阻斷右腎動靜脈。
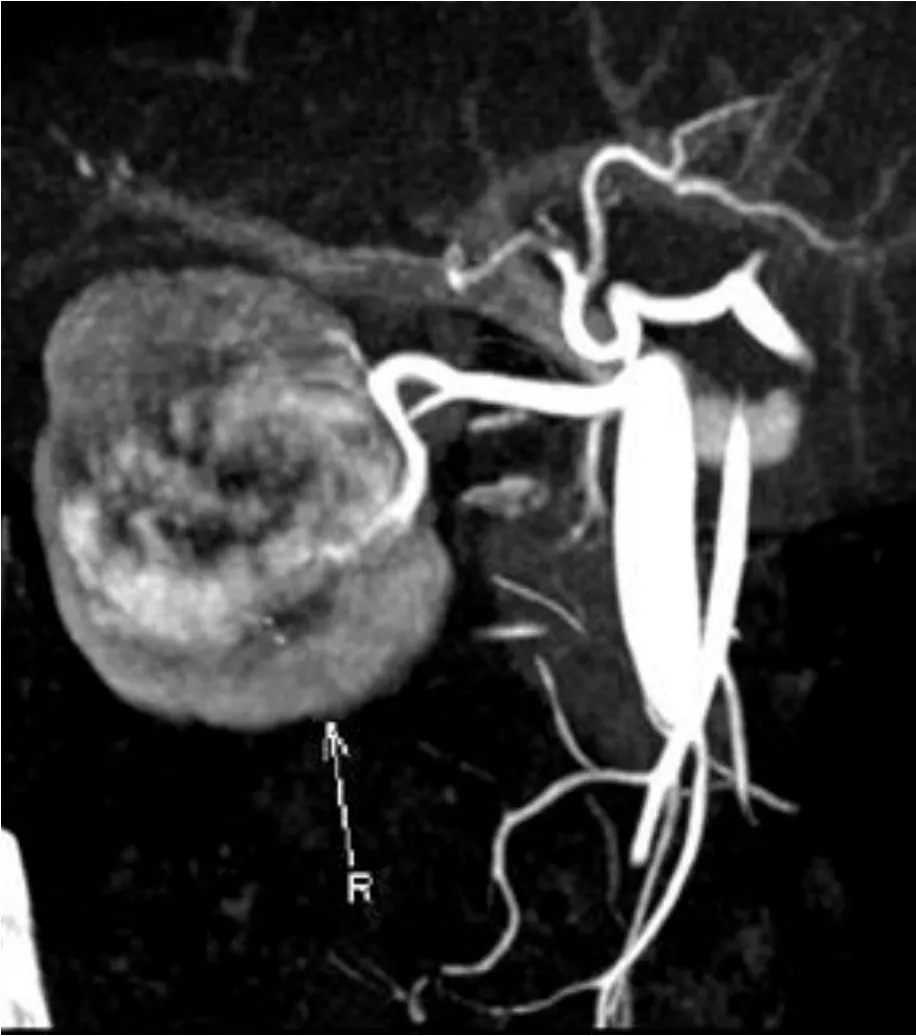
圖1 右腎動脈及分支圖像
2 結果
2.1 手術結果
兩次手術均成功完成,未中轉開放手術,術中未輸血。兩次手術的手術時間分別為153、136 min,出血量分別約250、150 mL,熱缺血時間分別為0、20 min。
2.2 術后病理結果
左腎送檢組織,大小約5 cm×4 cm×3 cm,肉眼觀察切面灰褐色,邊界清楚,表面包膜完整,病理診斷提示:乳頭狀腎細胞癌,核分級:Ⅱ級,切緣陰性(圖4A)。右腎送檢組織,大小6.0 cm×5.5 cm×4.0 cm,病理診斷提示:透明細胞癌,核分級Ⅰ級,切緣陰性(圖4B)。
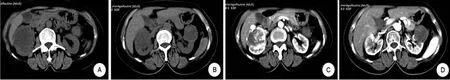
圖2 雙腎CT及增強圖像
2.3 術后隨訪
患者術后共隨訪8個月,第一次手術術后第1天復查血Scr為81.3 μmol/L,與術前比較無明顯差異;術后第7天復查總腎GFR值63.26 mL/min,左腎GFR值17.68 mL/min,右腎GFR值45.58 mL/min。第二次手術術后第1天復查Scr為101 μmol/L,術后第 15天和 1、3、6個月復查 Scr分別為 75.3、105.4、107.5、105.9 μmol/L;術后 3 個月復查總腎GFR值34.53 mL/min,左腎GFR值25.34 mL/min,右腎 GFR 值 9.19 mL/min;術后半個月復查雙腎CT示:雙腎可見多發條狀高密度影,為術后改變。術后8個月復查雙腎CT示:雙腎形態尚規整,邊緣清晰,術區周圍積氣基本吸收,積液明顯吸收(圖5)。
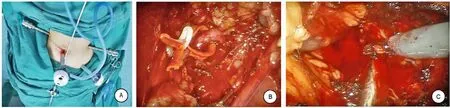
圖3 手術步驟示意圖
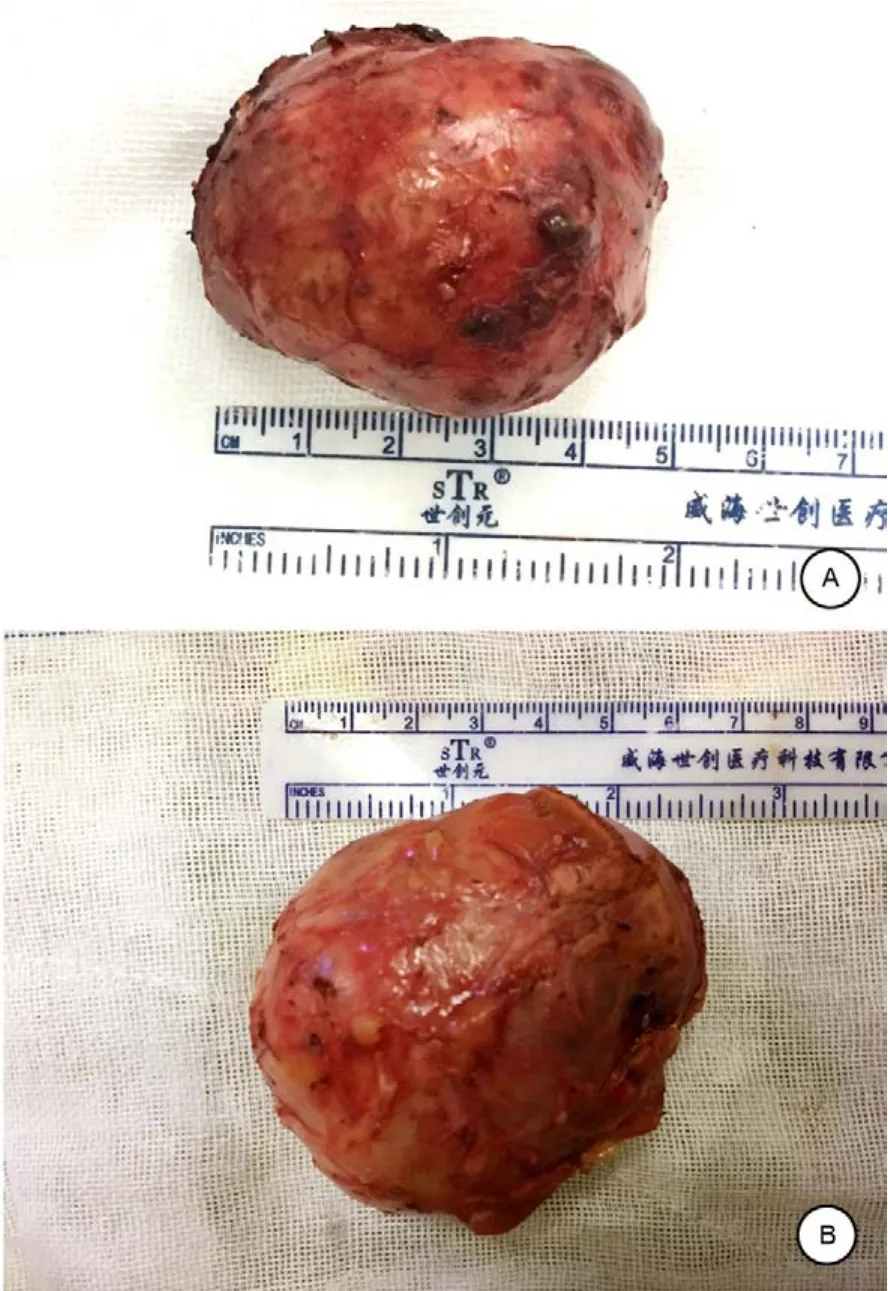
圖4 雙側腎癌術后病理標本
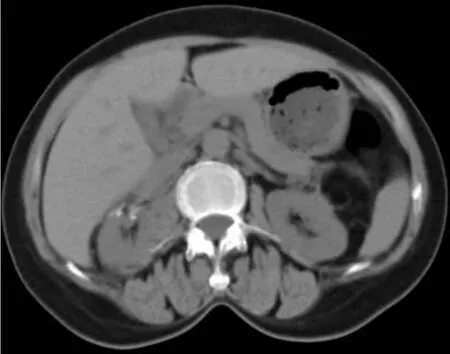
圖5 雙側腎癌術后8個月雙腎CT圖像
3 討論
雙側腎細胞癌的發病率較低,占腎細胞癌的1%~5%[1-3]。根據雙側腎癌患者是否有遺傳家族史分為家族遺傳腎癌(如VHL綜合征雙側腎癌)和散發性腎癌;根據腎癌發生時期分為同時性腎癌和異時性腎癌。臨床上雙側腎癌大多病理類型相同,目前國內外對不同病理類型雙側腎癌報道極少,本例患者病理類型為左側乳頭狀腎細胞癌,右側透明細胞癌。提示不同病理類型雙側腎癌可以均為原發性,且可以同時出現。
雙腎細胞癌是NSS的絕對適應證[4]。一項關于128例雙側腎癌行NSS術的回顧性研究表明,術后10年總生存率和腫瘤特異性生存率分別為88% 和 97%[5];另Becker等[6]對3 097例雙側腎癌進行研究表明,NSS術后5年、10年和20年腫瘤特異性生存率分別為91.9%、79.1%和56.7%。
對于同時性雙腎細胞癌,行一期手術切除還是二期手術切除目前尚未達成統一意見。行一期手術的優點有以下幾方面:減少手術次數;減輕患者生理及心理的負擔;降低多次麻醉可能出現的并發癥風險;縮短患者的住院時間及減少相應的住院費用等。但Simmons等[7]認為一期手術對患者的打擊性更大,手術時間延長可能引發患者機體器官功能受到損傷,另一學者認為一期手術可能會增加急性腎功能不全及透析的風險[8]。Funahashi和徐楚瀟等[9-10]認為行二期手術的優勢主要在于:對一期NSS術后可能出現的腎功能不全會起到不同程度的代償作用。Wang等[11]研究表明二期較一期手術治療雙腎腫瘤更加安全,且能更好地保留腎功能。另外,隨著手術經驗的積累和手術器械的進步,尤其是機器人手術技術的出現,NSS的手術方式發生了巨大的變化。與普通腹腔鏡相比,機器人輔助腹腔鏡技術具有獨特的優勢:①具有裸眼3D高清視野、解剖更加精細,能減少副損傷;②七個自由度的靈活機械手臂能減少操作死角,降低縫合難度,使操作更為順利。本例患者分期行機器人輔助腹腔鏡腎部分切除術,考慮到左側腎腫瘤體積較右側小,且主要為外生性,手術更加安全,因此先處理左側腎腫瘤,二期處理右側腎腫瘤。術后Scr及GFR結果顯示,機器人輔助腹腔鏡腎部分切除術既能夠很好地控制腫瘤的進展,又能夠有效地保留正常腎單位。
值得注意的是,本例患者第二次手術術后3個月復查腎動態顯像顯示,左腎GFR值恢復至第一次手術術前水平,但右腎GFR值下降較多,推測可能由于該患者右腎腫瘤較左側體積大,且位于中央,R.E.N.A.L.評分高;而左腎腫瘤位于外周,R.E.N.A.L.評分低,并不能因此推斷不阻斷腎蒂相較于阻斷腎蒂技術在保護腎功能方面可能具有優勢。Cacciamani等[12]報道了一項包括987例機器人腎部分切除術的回顧性薈萃分析,結果提示不阻斷腎動脈主干對腎功能的保護具有顯著優勢,而各項圍手術期指標和腫瘤控制效果與阻斷技術相當。然而,另一項包含725例病例的多中心回顧性研究表明不阻斷腎蒂對雙腎功能完好的患者似乎并不能帶來顯著的腎功能獲益,其遠期腎功能差異無統計學意義[13]。因此,不阻斷腎蒂在保護腎功能預后方面相比阻斷腎蒂是否具有明顯優勢,還需大中心大樣本的研究。
總之,對于同時性雙側腎癌,病理類型不同,預后亦不同,采用機器人輔助腹腔鏡NSS分期治療是安全可行的,短期療效滿意。復發及遠處轉移情況還需進一步密切隨訪。

