后腹腔入路機器人根治性腎切除聯合靜脈瘤栓取出術的臨床研究(附4例報告)
巫勝攀 彭程 黃慶波 杜松良 范陽 高宇 顧良友 牛少曦 王瀚鋒 劉侃 唐露許勇 趙惠 張帆 李宏召 張旭 王保軍 馬鑫中國人民解放軍總醫院泌尿外科00853北京濰坊醫學院附屬醫院泌尿外科
腎癌伴靜脈瘤栓是泌尿外科手術難度最高的疾病之一,開放的根治性腎切除術聯合靜脈瘤栓取出術是腎癌伴靜脈瘤栓患者的標準術式[1-2]。但開放手術同樣有發生大出血或瘤栓脫落導致肺栓塞的風險[2-3]。隨著機器人手術的開展及手術技巧的提高,對于Mayo分級為Ⅰ、Ⅱ級的腎癌伴靜脈瘤栓患者,機器人輔助腹腔鏡下根治性腎切除聯合靜脈瘤栓取出術可取得與開放手術類似的遠期腫瘤控制效果,且具有更好的圍手術期安全性[4]。經后腹腔入路手術解剖結構相對簡單,更容易顯露腎門重要管道系統的結構,已成為我國腹腔鏡手術的主流入路[5]。現通過回顧性分析在中國人民解放軍總醫院完成的4例經后腹腔入路機器人腎根治性切除聯合靜脈瘤栓取出術的圍手術期情況,總結此類手術的臨床經驗。
1 資料與方法
1.1 一般資料
4例入組患者均為男性,年齡41~69歲,中位年齡54歲。其中右側腎癌伴靜脈瘤栓2例,左側腎癌伴靜脈瘤栓2例。4例患者術前經胸部CT、胸部平片及腹部超聲檢查,其中1例行經導管下腔靜脈造影、ECT全身骨掃描;1例行MRI檢查。1例術前胸部影像學檢查提示左下肺轉移灶。本組4例患者,腎臟原位腫瘤最大直徑為3.0~8.0 cm,平均5.6 cm。2例患者為Mayo臨床分級0級,301瘤栓分級(以下簡稱301分級)均為0a級,1例為Mayo臨床分級Ⅰ級(301分級Ⅰ級),另1例為MayoⅡ級(301分級Ⅰ級)。1例患者術前輔以靶向藥物治療3個月:口服培唑帕尼膠囊,800 mg,1次/d。
1.2 體位及Trocar放置
以右側腎癌伴靜脈瘤栓患者為例,手術采用經后腹腔入路,麻醉成功后患者取完全左側臥位,抬高腰橋。手術應用達芬奇Si手術系統,術中常規使用3個機械臂,對于術前評估原發腫瘤較大、腎周組織粘連嚴重或Ⅱ級瘤栓患者,可加用第3臂協助暴露。Trocar位置如圖1所示。首先于腋中線髂嵴上1~2 cm處做切口作為鏡頭通道,擴開腰背筋膜,用手指鈍性分離,建立腹膜后腔隙,置入自制球囊擴張器,注入300~400 mL空氣擴張后腹腔空間。在肋緣與髂嵴連線中點與腋后線交匯處放置8 mm Trocar(機械臂2)。鏡頭孔放置12 mm Trocar后縫合固定,連接氣腹機,氣腹壓力升至1.862 kPa(14 mmHg)。直視下經腋后線Trocar用吸引器向前正中線方向鈍性推開腹膜,沿機械臂2水平方向,于腋前線腹側1~2 cm置入8 mm Trocar(機械臂1)。分別于鏡頭孔和腹側8 mm Trocar、背側8 mm Trocar連線中點下6~8 cm處,直視下放置2個12 mm Trocar作為輔助孔1、2。對接機器人操作系統,自上向下清理腹膜外脂肪,直視下于腹直肌外緣平機械臂1平面放置第三個8 mm Trocar(機械臂3)。左側靜脈瘤栓患者置管位置與右側互為鏡像。
1.3 手術步驟
右側病例:對于Ⅱ級瘤栓,術中首先使用0°鏡,將第1機械臂連接單極剪,第2機械臂連接雙極鉗,第3機械臂連接無創鉗,縱行剪開腎筋膜,上至膈肌,下至腎下極,依次游離腎臟腹側面、背側面,于腎后筋膜與腰大肌之間鈍性分離,將腎臟推向腹側,于腎門水平游離出腎動脈并夾斷,繼續游離腎臟并離斷輸尿管。更換30°鏡,通過第三臂牽拉以固定腎臟,制造操作空間,沿腰大肌層面暴露并環形游離瘤栓所在段的下腔靜脈,并充分暴露下腔靜脈及左右腎靜脈,同時游離出腰靜脈、肝短靜脈和右側腎上腺中央靜脈等下腔靜脈屬支并離斷。置入腔內超聲探查瘤栓近、遠心端,以確保血管阻斷帶能安全地阻斷下腔靜脈近、遠心端。阻斷下腔靜脈遠心端、左腎靜脈、下腔靜脈近心端后依次剖開,完整剝離瘤栓。采用4-0血管縫線重建下腔靜脈,松開上述阻斷帶,檢查腔靜脈無血液外滲。將標本取出體外,檢查無活動性出血后,依次縫合各層切口(圖2)。

圖1 手術體位及Trocar分布
本組1例右側Ⅰ級瘤栓,由于不需阻斷下腔靜脈,術中向腹側牽拉并抬舉腎臟,采用腔鏡下Satinsky鉗于瘤栓近心端阻斷腎靜脈,將瘤栓推回患側腎靜脈內,隨后置入Endo-GIA于腎靜脈與下腔靜脈交匯處離斷右腎靜脈(圖3)。
對于左側腎癌伴0級靜脈瘤栓患者,體位、Trocar放置與右側腎癌伴瘤栓患者類似。但術中游離并切斷左腎動脈后,需繼續向深面游離并顯露左腎靜脈及其屬支,直至腸系膜上動脈夾角處,以Hem-o-lok夾閉后剪斷或使用Endo-GIA離斷左腎靜脈。
2 結果
本組4例手術順利完成,無中轉開放手術病例。手術時間為110~210 min,平均158.75 min。術中估計出血量為200~1 000 mL,平均487.5 mL,未輸血。僅右側腎癌伴MayoⅡ級瘤栓患者術中阻斷下腔靜脈,時間為13 min。術后引流管放置時間與術后導尿管拔除時間均為3 d。平均術后住院時間為4 d。出院后患者傷口恢復情況良好。向病理科送檢切除的標本,4例患者術后病理結果均提示腎透明細胞癌,送檢淋巴結未見轉移。圍手術期未發生出血、肺栓塞等并發癥。1例使用培唑帕尼術前靶向治療后,肺轉移灶體積減小,下腔靜脈內瘤栓長度減小。術后大體標本及患者恢復情況見圖4。
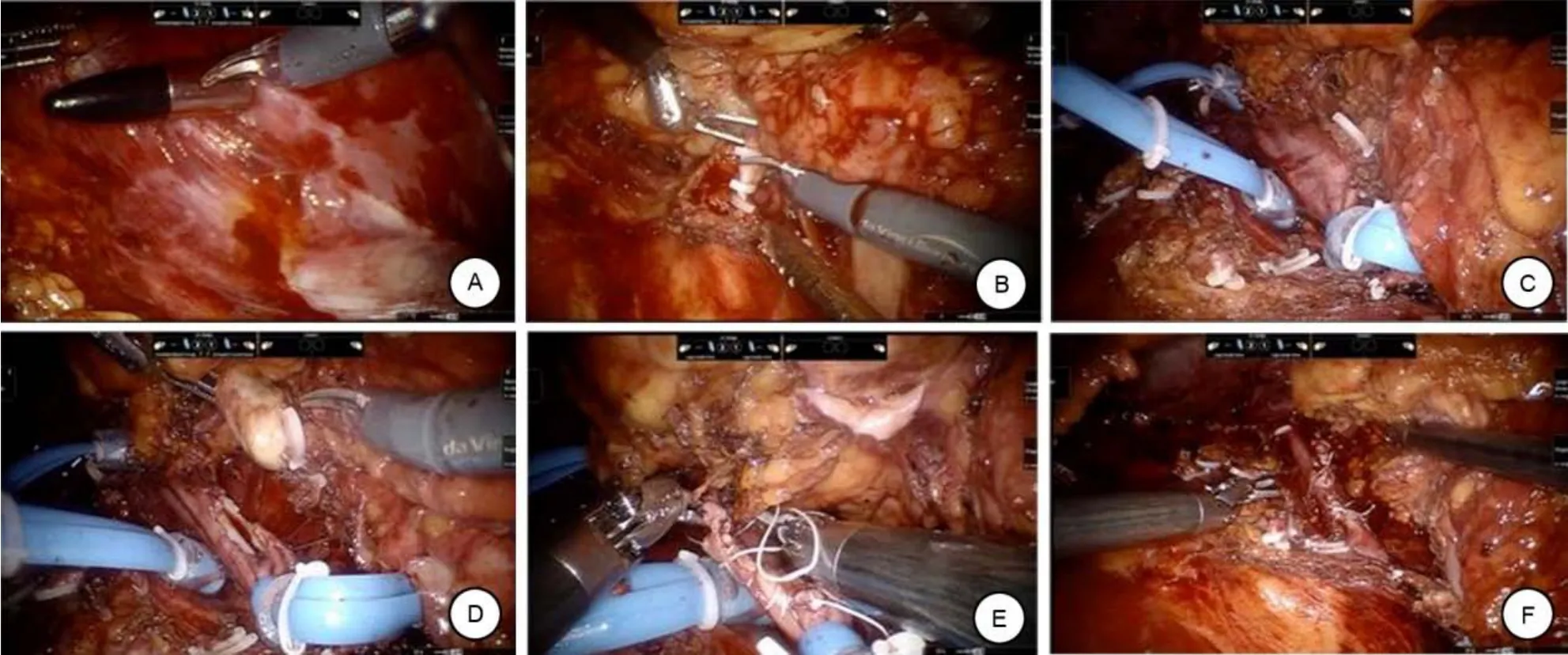
圖2 切開下腔靜脈取栓術
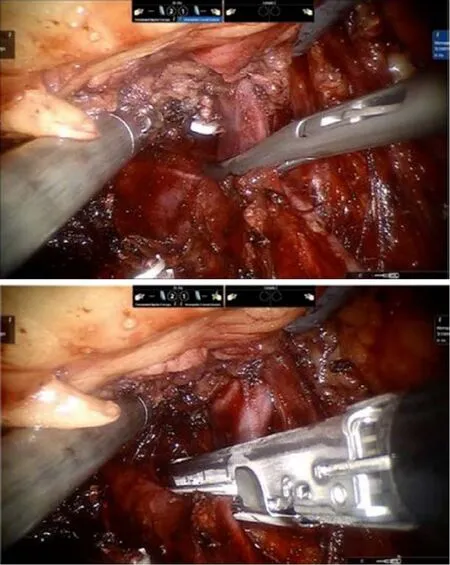
圖3 不阻斷下腔靜脈手術方法
3 討論
腎癌伴靜脈瘤栓圍手術期死亡率高達9.7%~22.2%,是泌尿外科難度最大、風險最高的手術之一。Abaza教授[6]最早報道了機器人輔助腹腔鏡靜脈瘤栓手術的臨床研究。Kundavaram,Gill和Ramirez教授也分享了機器人輔助腹腔鏡下根治性腎切除及靜脈瘤栓取出術的手術經驗[7-9],本單位也曾總結匯報該術式的方法及技巧[10-11]。然而,尚無后腹腔入路機器人根治性腎切除聯合靜脈瘤栓取出術的相關報道。
本研究中4例患者均經后腹腔入路途徑完成手術,分析手術經驗,并結合腹膜后的解剖特點,我們認為對于MayoⅠ,部分Ⅱ級(301分級I級)的右側腎癌伴靜脈瘤栓患者及Mayo 0級(301分級0a級)的左側腎癌伴靜脈瘤栓患者,經后腹腔入路機器人根治性腎切除聯合瘤栓取出術安全可行。手術的核心技術點為:①經后腹腔途徑可更快,更直接地顯露腎動脈,我們前期研究證實內側弓狀韌帶可作為術中尋找腎動脈的解剖標志。對腎動脈的早期控制可減少腫瘤血供,縮小腫瘤體積,降低出血風險。②對于術前評估原發腫瘤較大、腎周組織粘連嚴重或Ⅱ級瘤栓患者,靈活使用3臂,可通過牽拉制造操作空間,術中可在充分解剖顯露的情況下分離下腔靜脈及左腎靜脈、腰靜脈等各屬支,降低了血管損傷的風險。③對于Ⅰ級或長度較短的Ⅱ級下腔靜脈瘤栓,用Satinsky鉗將下腔靜脈瘤栓推回至腎靜脈內,隨后置入Endo-GIA于腎靜脈與下腔靜脈交匯處離斷右腎靜脈,該術式不需阻斷下腔靜脈。
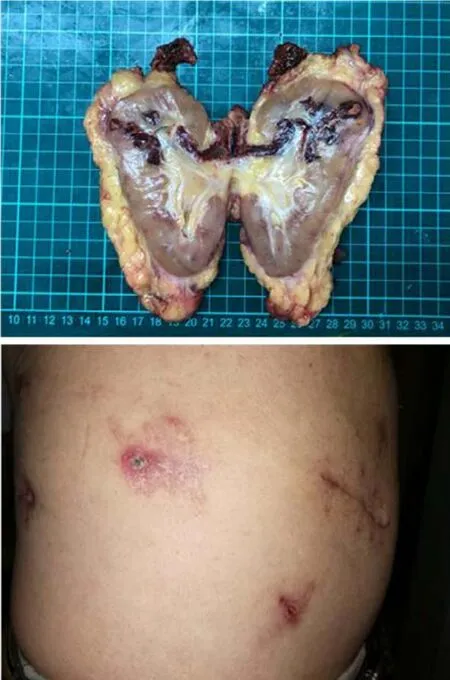
圖4 術后病理大體標本及術口恢復情況
經后腹腔入路機器人手術相比經腹腔途徑手術,出血量較少,同時可更清晰地顯露后腹腔的外側壁及后壁各解剖結構及腰靜脈,有利于游離并阻斷腰靜脈等下腔靜脈屬支,減少血管損傷的風險。由于機器人手術系統的三維放大視覺和7個自由度的運動,可更好地進行腎蒂的游離及腫瘤的切除,同時減少腎臟的損傷,更好地保護腎功能,中轉開放手術的概率更低[12]。經后腹腔途徑手術與經腹腔途徑手術相比,熱缺血時間及切緣陽性率無明顯差別[13]。而后腹腔入路手術對腹腹腔臟器如肝臟、腸道等的刺激較小,可減少術后胃腸道并發癥及抗嘔吐藥物的使用,且經后腹腔機器人手術具有術中出血少,手術時間短等優勢,使患者圍手術期恢復快[14-16]。經后腹腔機器人手術存在操作空間小,腫瘤分離風險及腫瘤破裂的問題,本研究中的4例患者,腎臟腫瘤最大徑為8 cm,均經后腹腔機器人手術完成,但是,本研究為小樣本量研究,其有效性及適應證仍需更大樣本量的研究來驗證。同時,對于腎臟原位腫瘤最大徑大于10 cm且伴腔靜脈瘤栓患者,建議經腹腔入路完成。
后腹腔入路機器人根治性腎切除聯合靜脈瘤栓取出術具有嚴格的適應證。對于右側腎癌伴靜脈瘤栓患者,經后腹腔入路機器人腹腔鏡根治性腎切除術聯合靜脈瘤栓取出術對于瘤栓高度位于第一肝門以下水平的腎癌伴靜脈瘤栓患者是可行的,但對于瘤栓高度達到甚至超過第一肝門水平的病例,仍需進一步探索該術式的可行性。而對于左側腎癌伴靜脈瘤栓患者,若Mayo分級為0級且瘤栓高度未超過腸系膜上動脈水平者(301分級為0a)可經后腹腔入路完成該手術。由于經后腹腔途徑入路手術為創造操作空間,常需要更高的氣腹壓力,雖然可減少切開取栓時的出血量,但理論上也增加了靜脈內瘤栓脫落的風險。對于左側腎癌伴靜脈瘤栓患者,由于腸系膜上動脈橫跨左腎靜脈,經后腹腔入路手術有損傷腸系膜上動脈的風險。因此我們認為,對于左側腎癌伴靜脈瘤栓,手術策略根據瘤栓近心端是否跨過腸系膜上動脈有所不同。此外,本組研究樣本量有限,應根據隨訪數據及更大樣本量的實踐來評估其療效;對于原發腫瘤體積過大且伴I級靜脈瘤栓的患者,能否行經后腹腔途徑機器人手術仍需進一步的臨床研究。
綜上,對于MayoⅠ級或Ⅱ級(301分級Ⅰ級)右側腎癌伴靜脈瘤栓患者及Mayo分級為Ⅰ級且瘤栓高度位于腸系膜動脈水平或以下(301分級0a級)的患者,我們初步探索了后腹腔入路機器人根治性腎切除聯合靜脈瘤栓取出術安全性和可行性,但其臨床療效仍需擴大樣本量及完整的隨訪數據來進一步分析研究。
【編者按】腎癌伴靜脈瘤栓取出術是泌尿外科風險較大的手術,術中瘤栓脫落可造成肺動脈栓塞等致命性并發癥。盡量避免圍手術期瘤栓脫落誘因,降低瘤栓脫落的風險是該手術重要的原則之一。后腹腔入路手術在顯露腎動脈、控制出血方面具有優勢,但建立人工氣腹的過程中有可能增加癌栓脫落的風險,需嚴格掌握手術適應證。

