“四步”快速書寫離子方程式
洪慶賢
摘 要:溶液中進(jìn)行的氧化還原反應(yīng)離子方程式、電極反應(yīng)式、雙水解離子方程式等的書寫,可以通過直接分析發(fā)生離子反應(yīng)的微粒,直接快速進(jìn)行書寫,本文通過分析溶液中的反應(yīng)物微粒和產(chǎn)物微粒,通過四步快速書寫相應(yīng)的離子方程式。
關(guān)鍵詞:氧化還原反應(yīng)離子方程式;電極反應(yīng)式;雙水解離子方程式;四步書寫
高中階段的離子反應(yīng)基本上都是在溶液中進(jìn)行的,課本上給出的書寫離子方程式的方法只是適合初學(xué)者,而且離子反應(yīng)實質(zhì)上是微粒在溶液中直接進(jìn)行的,通過寫化學(xué)方程式來改寫離子方程式本來就是本末倒置的做法。若溶液中的反應(yīng)很復(fù)雜,有時根本無法書寫化學(xué)方程式,那么要書寫出離子方程式就更無從下手。本文針對中學(xué)常見的溶液中發(fā)生的氧化還原反應(yīng)離子反應(yīng)、電化學(xué)部分電極反應(yīng)、雙水解離子反應(yīng)三種類型,直接對溶液中發(fā)生反應(yīng)的微粒進(jìn)行分析,結(jié)合基礎(chǔ)知識,通過四步處理直接快速書寫出相應(yīng)的離子方程式。
一、四步書寫離子方程式的書寫原則
如何離子反應(yīng)方程式的都必須遵循質(zhì)量守恒定律、電荷守恒規(guī)律,這四步的書寫同樣是以這些守恒規(guī)律為基礎(chǔ)的。總體上來看,這四步處理分別是:
步驟一:直接分析溶液中發(fā)生反應(yīng)的兩種微粒,根據(jù)相關(guān)知識分析出反應(yīng)生成的產(chǎn)物,寫出離子反應(yīng)的基本框架。一般來說,反應(yīng)微粒是兩種,那么產(chǎn)物往往也是兩種,電極反應(yīng)則要具體分析。
步驟二:若涉及到氧化還原反應(yīng),則根據(jù)化合價或是電子得失來配平氧化劑還原劑劑氧化產(chǎn)物還原產(chǎn)物前面的計量數(shù)。
步驟三:根據(jù)反應(yīng)前后的守恒,分析出反應(yīng)前帶電微粒的電荷總數(shù)和反應(yīng)后帶點微粒的電荷總數(shù),對比反應(yīng)前后的電荷數(shù),給方程式左邊或者是右邊不上陰陽離子,使方程式兩邊電荷守恒。一般來說,補陽離子往往補H+,補陰離子往往補OH-,具體補充那種離子要根據(jù)溶液的酸堿性以及題設(shè)條件來進(jìn)行判斷。
步驟四:根據(jù)反應(yīng)前后原子守恒,補充出反應(yīng)前后未寫出的物質(zhì),同時配平其他物質(zhì)前面的計量數(shù)。一般來說,一邊補充H+或是OH-,則另一邊補充H2O。
這四步對于初學(xué)者來說,要求觀察能力、分析能力和基礎(chǔ)知識都是比較高的,但是進(jìn)行相應(yīng)的練習(xí)后,還是很好掌握和運用的,而且這種方法書寫離子方程式直接從溶液中微粒進(jìn)行分析,書寫會更加準(zhǔn)確和快速,能為學(xué)生簡化書寫和步驟同時節(jié)約時間。
二、三種類型的離子反應(yīng)方程式書寫實例及分析
1.溶液中進(jìn)行的氧化還原反應(yīng)離子方程式的書寫
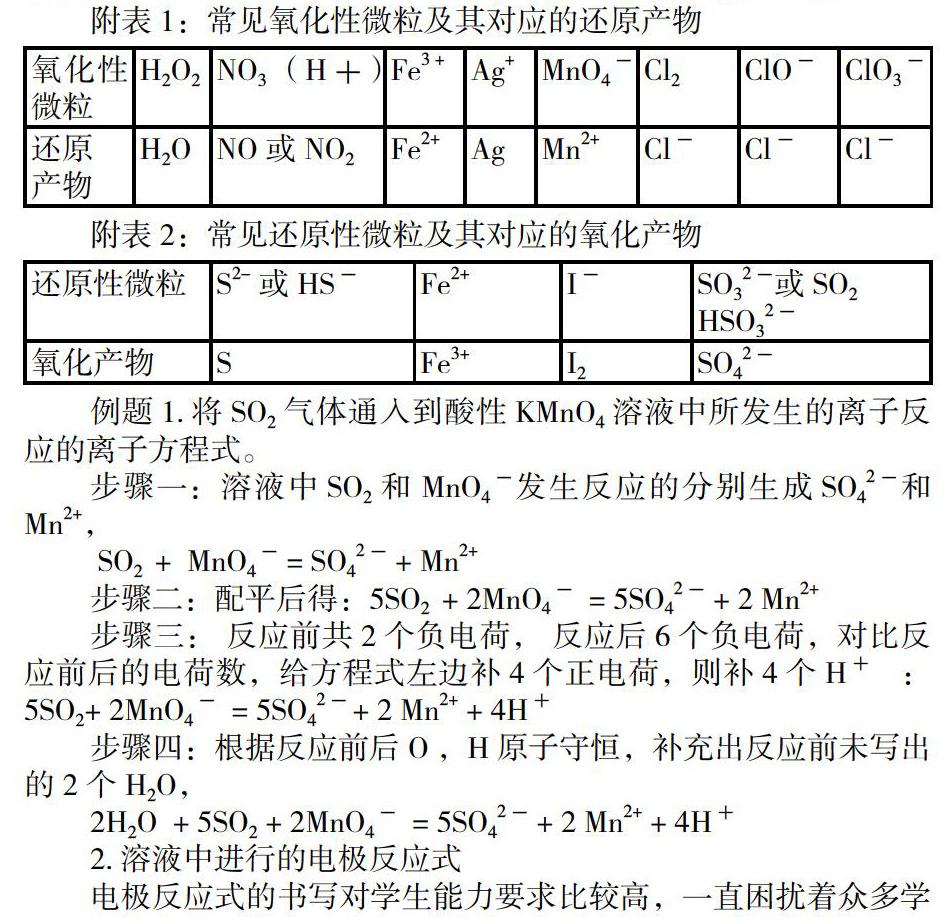
這類離子方程式的一般是溶液中氧化性微粒和還原性微粒之間發(fā)生了氧化還原反應(yīng)離子方程式,所以要對常見的氧化性微粒和還原性微粒有一定的了解,同時還要了解它們發(fā)生反應(yīng)后通常生成產(chǎn)物,如果生成不常見的產(chǎn)物,則要根據(jù)題設(shè)條件去分析判斷。
附表1:常見氧化性微粒及其對應(yīng)的還原產(chǎn)物
氧化性微粒 H2O2 NO3 ?(H+) Fe3 + Ag+ MnO4- Cl2 ClO- ClO3-
還原
產(chǎn)物 H2O NO或NO2 Fe2+ Ag Mn2+ Cl- Cl- Cl-
附表2:常見還原性微粒及其對應(yīng)的氧化產(chǎn)物
還原性微粒 S2-或 HS- Fe2+ I- SO32-或SO2
HSO32-
氧化產(chǎn)物 S Fe3+ I2 SO42-
例題1.將SO2氣體通入到酸性KMnO4溶液中所發(fā)生的離子反應(yīng)的離子方程式。
步驟一:溶液中SO2 和 MnO4-發(fā)生反應(yīng)的分別生成SO42-和Mn2+,
SO2 ?+ ?MnO4- = SO42- + Mn2+
步驟二:配平后得:5SO2 ?+ 2MnO4- ?= 5SO42- + 2 Mn2+
步驟三: 反應(yīng)前共2個負(fù)電荷, 反應(yīng)后6個負(fù)電荷,對比反應(yīng)前后的電荷數(shù),給方程式左邊補4個正電荷,則補4個H+ ? : 5SO2+ 2MnO4- ?= 5SO42-+ 2 Mn2+ + 4H+
步驟四:根據(jù)反應(yīng)前后O ,H原子守恒,補充出反應(yīng)前未寫出的2個H2O,
2H2O ?+ 5SO2 + 2MnO4- ?= 5SO42- + 2 Mn2+ + 4H+
2.溶液中進(jìn)行的電極反應(yīng)式
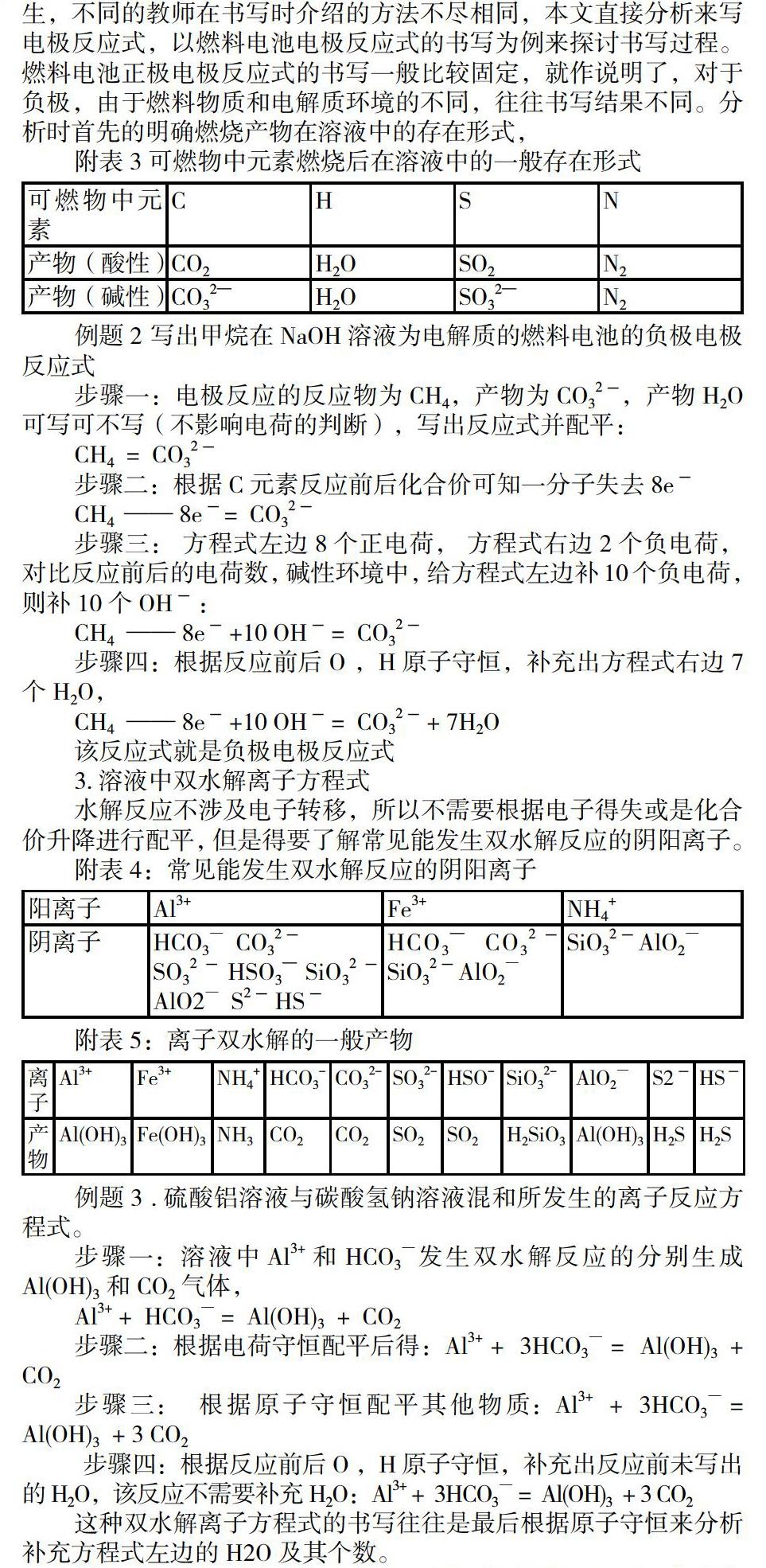
電極反應(yīng)式的書寫對學(xué)生能力要求比較高,一直困擾著眾多學(xué)生,不同的教師在書寫時介紹的方法不盡相同,本文直接分析來寫電極反應(yīng)式,以燃料電池電極反應(yīng)式的書寫為例來探討書寫過程。燃料電池正極電極反應(yīng)式的書寫一般比較固定,就作說明了,對于負(fù)極,由于燃料物質(zhì)和電解質(zhì)環(huán)境的不同,往往書寫結(jié)果不同。分析時首先的明確燃燒產(chǎn)物在溶液中的存在形式,
附表3 可燃物中元素燃燒后在溶液中的一般存在形式
可燃物中元素 C H S N
產(chǎn)物(酸性) CO2 H2O SO2 N2
產(chǎn)物(堿性) CO32— H2O SO32— N2
例題2 寫出甲烷在NaOH溶液為電解質(zhì)的燃料電池的負(fù)極電極反應(yīng)式
步驟一:電極反應(yīng)的反應(yīng)物為CH4,產(chǎn)物為CO32-,產(chǎn)物H2O可寫可不寫(不影響電荷的判斷),寫出反應(yīng)式并配平:
CH4 ?= ?CO32-
步驟二:根據(jù)C元素反應(yīng)前后化合價可知一分子失去8e-
CH4 ?—— 8e-= ?CO32-
步驟三: 方程式左邊8個正電荷, 方程式右邊2個負(fù)電荷,對比反應(yīng)前后的電荷數(shù),堿性環(huán)境中,給方程式左邊補10個負(fù)電荷,則補10個 OH- :
CH4 ?—— 8e- +10 OH- = ?CO32-
步驟四:根據(jù)反應(yīng)前后O ,H原子守恒,補充出方程式右邊7個H2O,
CH4 ?—— 8e- +10 OH- = ?CO32- + 7H2O
該反應(yīng)式就是負(fù)極電極反應(yīng)式
3.溶液中雙水解離子方程式
水解反應(yīng)不涉及電子轉(zhuǎn)移,所以不需要根據(jù)電子得失或是化合價升降進(jìn)行配平,但是得要了解常見能發(fā)生雙水解反應(yīng)的陰陽離子。
附表4:常見能發(fā)生雙水解反應(yīng)的陰陽離子
陽離子 Al3+ Fe3+ NH4+
陰離子 HCO3― ?CO32-
SO32- HSO3— SiO32-AlO2― ?S2- HS- HCO3— ?CO32-SiO32-AlO2― SiO32-AlO2―
附表5:離子雙水解的一般產(chǎn)物
離子 Al3+ Fe3+ NH4+ HCO3- ? CO32- SO32- HSO- ? SiO32- AlO2― S2- HS-
產(chǎn)物 Al(OH)3 Fe(OH)3 NH3 CO2 CO2 SO2 SO2 H2SiO3 Al(OH)3 H2S H2S
例題3 .硫酸鋁溶液與碳酸氫鈉溶液混和所發(fā)生的離子反應(yīng)方程式。
步驟一:溶液中Al3+和 HCO3―發(fā)生雙水解反應(yīng)的分別生成Al(OH)3和CO2氣體,
Al3+ + ?HCO3― = ?Al(OH)3 ?+ ?CO2
步驟二:根據(jù)電荷守恒配平后得:Al3+ + ?3HCO3― = ?Al(OH)3 ?+ ?CO2
步驟三: ?根據(jù)原子守恒配平其他物質(zhì):Al3+ ?+ ?3HCO3― = ?Al(OH)3 ?+ 3 CO2
步驟四:根據(jù)反應(yīng)前后O ,H原子守恒,補充出反應(yīng)前未寫出的 H2O,該反應(yīng)不需要補充H2O:Al3+ + ?3HCO3― = ?Al(OH)3 ?+ 3 CO2
這種雙水解離子方程式的書寫往往是最后根據(jù)原子守恒來分析補充方程式左邊的H2O及其個數(shù)。
以上通過溶液中常見的三種離子方程式的書寫,過程很簡單直接,但是必須要對基礎(chǔ)知識掌握的比較牢靠。對于初學(xué)的學(xué)生來說,在了解了這四步基本方法后應(yīng)該多加練習(xí),達(dá)到一定的熟練程度后在做題過程中使用起來就會得心應(yīng)手。教學(xué)隨筆,見解粗淺,有不妥之處望同行多指正。

