急性心肌梗死患者PCI術中球囊擴張度與術后無復流的關系
袁平年 王琦
[摘 要] 目的 研究急性心肌梗死患者經皮冠狀動脈介入術(PCI)中球囊擴張度與術后無復流發生的相關性。方法 將本院收治的94例急性心肌梗死患者作為研究對象,分為觀察組和對照組各47例。兩組術前均進行常規治療(服用氯吡格雷300mg,阿司匹林300mg等),且急診PCI證實病變血管遠端完全閉塞。其中,對照組經小球囊和低強度擴張后,可部分恢復閉塞血管遠端血流,之后行支架植入術;觀察組經小球囊和低壓力預擴張后,可部分恢復閉塞血管遠端血流,接著通過大球囊及強度擴張后行支架植入術。比較兩組患者臨床基線資料(性別、年齡、體質量指數、糖尿病史、高血壓史、吸煙史等)、病變血管部位(右冠狀動脈、回旋支、前降支)、血管開通時間及無復流的發生情況。結果 兩組患者臨床基線資料比較,均無統計學意義(均P>0.05)。兩組患者病變血管部位和血管開通時間的比較,無統計學意義(均P>0.05)。觀察組無復流發生率為19例(40.43%),較對照組5例(10.64%)顯著升高,差異有統計學意義(P<0.05)。結論 經小球囊和低壓力預擴張,部分恢復閉塞血管遠端血流后,通過大球囊及高強度擴張后行支架植入術,會增加急性心肌梗死患者PCI后病變血管無復流的發生率,提示術中球囊擴張度與術后無復流的發生率密切相關。
[關鍵詞] 急性心肌梗死;經皮冠狀動脈介入術;球囊擴張度;無復流
中圖分類號:R542.2;R815? 文獻標識碼:A? 文章編號:1009-816X(2019)04-0325-03
近年來,國內外對急性心肌梗死經皮冠狀動脈介入術(PCI)后無復流發生的相關報道逐漸增多[1,2],但與術中球囊擴張度相關性的研究報道較為少見。如何有效避免或減少無復流的發生,仍是目前冠狀動脈治療的重中之重。為此,本研究將本院94例急性心肌梗死患者作為研究對象,旨在探討PCI術中球囊擴張度與術后無復流發生的相關性。
1 資料與方法
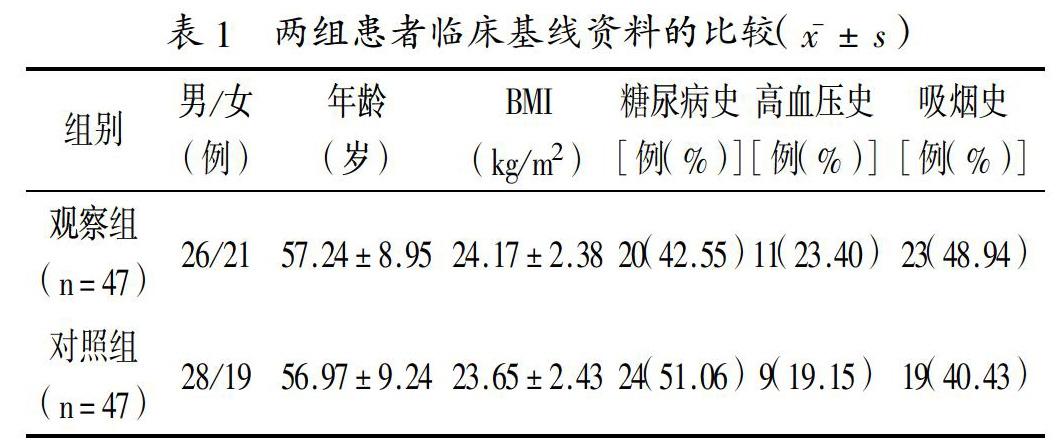
1.1 一般資料:將2017年3月至2018年3月本院收治的94例急性心肌梗死患者作為研究對象,并按照隨機數字表法,將患者分為對照組和觀察組各47例。入選標準:(1)符合冠心病診療指南中有關急性心肌梗死的診斷標準[3];(2)既往未行PCI;(3)可耐受支架植入術。排除標準:(1)合并腦、肺、肝、腎功能異常;(2)病變血管遠端血流心肌梗死溶栓治療分級為1~3級,存在支架植入術禁忌證;(3)伴有出血性腦血管病變、出血傾向和抗凝禁忌;(4)伴有活動性消化性潰瘍、手術創傷;(5)應用華法林抗凝者,未耐受抗血小板治療,伴有藥物過敏史;(6)伴有惡性腫瘤、病情危急。本研究內容已通過本院醫學倫理委員會批準。記錄兩組患者臨床基線資料(性別、年齡、體質量指數(BMI)、糖尿病史、高血壓史、吸煙史等)、病變血管部位(右冠狀動脈、回旋支、前降支)、血管開通時間及無復流的發生情況。兩組患者性別、年齡、BMI等臨床基線資料的比較,差異均無統計學意義(均P>0.05),見表1。
1.2 方法:術前均進行常規治療(服用氯吡格雷300mg,阿司匹林300mg等),且急診PCI證實病變血管遠端完全閉塞對照組經小球囊(15mm×1.5mm)和低強度(400~600)kPa×10s擴張后,可部分恢復閉塞血管遠端血流(血流分級為1~2級),之后行支架植入術。觀察組經小球囊(15mm×1.5mm)和低壓力(400~600)kPa×10s預擴張后,可部分恢復閉塞血管遠端血流(血流分級為1~2級),接著通過大球囊(15mm×2.0mm)及強度(1000~1400)kPa×10s擴張后,行支架植入術。
1.3 無復流的評估標準:由參與介入術的兩名手術醫師經血管造影的方式對兩組患者術后是否發生復流進行評價,無復流或慢復流定義為經球囊擴張、植入支架后病變遠端血管的血流分級為0~2級,并將影響血流的血栓、夾層、痙攣、栓塞等情況予以排除[4]。
1.4 統計學處理:將數據錄入SPSS23.0版統計學軟件,其中計量資料用(x -±s)表示,組間比較采用t檢驗,計數資料用百分率(%)表示,組間比較采用χ2檢驗,P<0.05為差異具有統計學意義。
2 結果
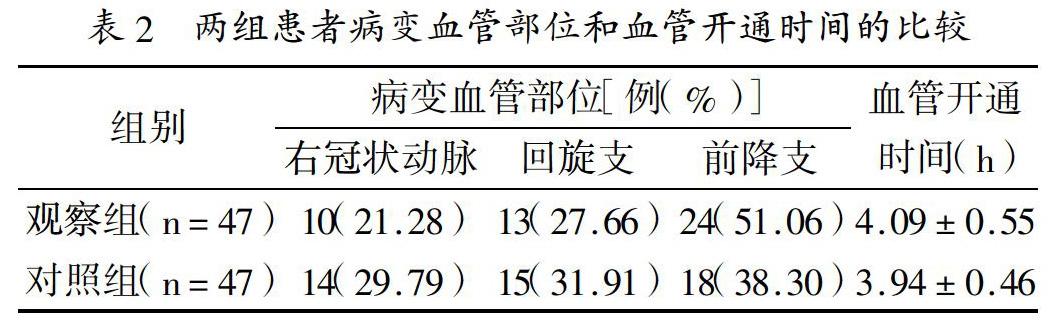
2.1 兩組患者病變血管部位和血管開通時間的比較:見表2。
2.2 兩組患者術后無復流發生情況的比較:觀察組無復流發生率為19例(40.43%),較對照組的5例(10.64%)顯著升高,差異有統計學意義(P<0.05)。
3 討論
無復流是指PCI術以開通梗死血管后,冠狀動脈原狹窄病變的部位出現無明顯殘余狹窄、無痙攣、無血栓形成的情況,但血流減慢較明顯[5]。血流持續性減緩會引起對比劑延遲排空,引起心肌缺血的表現。在臨床中,無復流的發生率居高不下,尤其高發于急性心肌梗死患者直接PCI術中。無復流的發生對PCI術的手術效果造成極大的影響,會加重急性心肌梗死患者病情,對其預后狀況極為不利。目前,國內外有關無復流發生的具體原因機制仍未完全定論,但普遍觀點認為其與植入支架、球囊擴張而導致缺血再灌注、微血管痙攣、梗死血管遠端微血管栓塞等密切相關。從缺血再灌注的角度上看,發生再灌注時會破壞內皮超微結構,并且因氧自由基的影響,使得細胞損傷加重,進而引起頓抑、心肌壞死等心肌損傷,導致微血管痙攣,繼而發生無復流的風險性提高[6]。從微血管痙攣的觀點上看,其發生的原因主要與以下幾點密切相關:(1)支架擴張或球囊擴張可引起血栓碎裂,使得縮血管因子如血栓A2及5-羥色胺等大量釋放,繼而導致微血管痙攣[7];(2)支架或球囊擴張對血管壁血流的抑制作用,亦會導致交感神經興奮,因α-受體興奮可引起冠狀動脈系統彌漫痙攣;(3)PCI于術過程中因三磷酸腺苷敏感鉀通道受阻滯,可引起冠狀動脈痙攣[8]。而該通道是調節冠狀動脈循環的重要通道,其激活可引起小動脈擴張,對保護微血管出現損傷起到重要的作用;(4)PCI術本身可引起血管內皮的結構性損傷,對α-受體介導的腎上腺能血管收縮效應的拮抗作用較弱,使得發生微血管痙攣的風險性提高[9]。從微血管栓塞的角度上看,梗死血管遠端血管栓塞是導致無復流發生的一種主要原因,而微血管栓塞的發生原因主要是因PCI術中導致梗死血管處出現不穩定斑塊且發生破碎,血栓形成,進而出現諸多微栓子、纖維碎片,最終導致遠端微血管栓塞[10]。此外,這也會引起內膜破裂,使得新的血栓和冠狀動脈夾層形成,繼而引起梗死血管遠端微血管堵塞,使得冠狀動脈血流明顯減緩。
有研究認為,未預擴張植入支架具有一定的可行性[11]。分析其原因,可能因未預擴張,使得斑塊內容物、血栓移動阻塞遠端血管的情況減少,此時附壁可直接或完全貼附在血管壁上,使得無復流的發生減少。此外,這亦能夠避免使用大球囊擴張造成冠狀動脈內膜撕裂,防止新的冠狀動脈夾層及血栓形成,最終有助于降低無復流的發生率。但需要指出的是,臨床中直接行支架植入術時需要具備一定的手術指征,如冠狀動脈病變具有適宜的病變特征和一定基礎的前向血流。本研究發現,經小球囊(15mm×1.5mm)和低壓力(400~600)kPa充分預擴張,待部分恢復閉塞血管遠端血流后,選擇大球囊及高強度擴張后行支架植入術,會增加急性心肌梗死患者PCI術后病變血管無復流的發生率。
綜上所述,術中球囊擴張度與術后無復流的發生密切相關。但本研究的樣本數相對較少,對術中球囊擴張度與術后無復流之間的相關性及相關機制仍需今后增加病例數以進行深入分析。
參考文獻
[1]楊華,信栓力,常超,等.急性心肌梗死急診介入治療無復流的研究進展[J].心血管康復醫學雜志,2013,22(5):525-527.
[2]Carrick D, Oldroyd KG, McEntegart M, et al. A randomized trial of deferred stenting versus immediate stenting to prevent no-or slow-reflow in acute ST-segment elevation myocardial infarction (DEFER-STEMI)[J]. J Am Coll Cardiol,2014,63(20):2088-2098.
[3]Levine GN, Bates ER, Blankenship JC, et al. 2015 ACC/AHA/SCAI focused update on primary percutaneous coronary intervention for patients with ST-elevation myocardial infarction: an update of the 2011 ACCF/AHA/SCAI guideline for percutaneous coronary intervention and the 2013 ACCF/AHA guideline for the management of ST-elevation myocardial infarction[J]. J Am Coll Cardiol,2016,67(10):1235-1250.
[4]周華,何曉燕,莊少偉,等.急診經皮冠狀動脈介入后無復流的臨床及程序危險因素分析[J].中華急診醫學雜志,2013,22(3):280-286.
[5]吳源鴻,林冬銘,羅穎,等.冠狀動脈無復流機制及評估方法研究進展[J].心腦血管病防治,2017,17(1):49-52.
[6]Ichimura K, Matoba T, Nakano K, et al. A translational study of a new therapeutic approach for acute myocardial infarction: nanoparticle-mediated delivery of pitavastatin into reperfused myocardium reduces ischemia-reperfusion injury in a preclinical porcine model[J]. PloS one,2016,11(9):e0162425.
[7]Arrebola-Moreno AL, Arrebola JP, Moral-Ruiz A, et al. Coronary microvascularspasm triggers transient ischemic left ventricular diastolic abnormalities in patients with chest pain and angiographically normal coronary arteries[J]. Atherosclerosis,2014,236(1):207-214.
[8]Tanabe Y, Yoneyama K, Izumo M, et al. A case of coronary microvascular spasm with slow flow induced by the intracoronary acetylcholine provocation test[J]. Cardiovasc Interv Ther,2015,30(4):372-376.
[9]Yildiz A, Yuksel M, Oylumlu M, et al. The utility of the platelet-lymphocyte ratio for predicting no reflow in patients with st-segment elevation myocardial infarction[J]. Clin Appl Thromb/Hem,2015,21(3):223-228.
[10]鄭海農,林益芳,蔣愛敏,等.保護微血管是防治心腦血管病的重要靶點——第13屆國際絡病學大會上國家973項目重大成果發布[J].心腦血管病防治,2017,17(1):74.
[11]Ibanez B, James S, Agewall S, et al. 2017 ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation: The Task Force for the management of acute myocardial infarction in patients presenting with ST-segment elevation of the European Society of Cardiology (ESC)[J]. Eur Heart J,2017,39(2):119-177.

