PD-1/L1類腫瘤免疫藥品的醫療經濟特點及其醫保定價機制探討
王芳旭 陶立波 孫 爽
(1北京醫藥衛生經濟研究會 北京 100069;2中山大學藥學院醫藥經濟研究所 中山 510006;3北京大學醫學部衛生政策與管理學系 北京 100191 )
腫瘤免疫療法(Immunotherapy)近年來備受矚目,被稱為腫瘤治療領域的革命性突破[1,2]。這其中程序性細胞死亡蛋白-1(Programmed Death-1,PD-1)及其配體(PD-L1)抑制劑是腫瘤免疫治療中最活躍和成熟的藥物技術,其治療原理是通過阻斷PD-1與L1的結合,解除免疫抑制,重新激活免疫系統對腫瘤細胞的識別和殺傷[3]。
由于PD-1/L1類藥物有著廣闊的應用前景,醫藥產業界對其投入了巨大的熱情和資源。據悉,目前該領域有上百個研發項目正在開展,且大部分在中國大陸[4]。不少跨國企業和國內企業在這個領域展開了激烈的競爭,目前已有多個PD-1/L1藥物已在我國上市或即將上市[5]。
基于PD-1/L1藥物的特點,當該類藥品紛紛上市并進入醫保目錄后,預期會對醫保基金產生壓力。考慮到該類藥品是創新性藥物,為腫瘤治療開辟了新的道路,如果定價過低,研發和生產企業無法獲得合理的市場回報,會挫傷創新積極性,不利于未來新技術的發展。因此,對PD-1/L1藥物的創新支持與醫保控費之間的矛盾必須正視,合理的定價和支付機制亟待建立。本文將對該類藥品的特點和醫保定價機制進行探討,以便為我國醫保相關政策的設計和實施提供參考建議。
1 PD-1/L1腫瘤免疫藥物的特點
PD-1/L1藥物通過解除免疫抑制來恢復人體免疫細胞對腫瘤細胞的識別和殺傷,目前上市的藥物劑型以靜脈注射給藥型為主,其劑量根據患者體重計算。PD-1/L1藥物上市時往往只針對某種腫瘤適應癥,但未來可能會擴展到多種腫瘤。
1.1 廣譜性
PD-1/L1藥物對各類腫瘤都可以有治療效果,頗類似于抗感染領域的抗生素。有大量臨床實驗均已證實PD-1/L1藥物對于眾多實體腫瘤和血液腫瘤均具有明顯的療效,患者均能不同程度的受益。目前在美國上市的PD-1/L1藥物獲批適應癥大多超過10個,覆蓋多種腫瘤,且適應癥數字還在不斷增加中[6-8]。
1.2 持久性
PD-1/L1藥物是通過恢復免疫能力來治療腫瘤的,而人體免疫系統具有免疫記憶的特性,因此PD-1/L1藥物的抗癌效果通常具有持久性。一旦藥物見效,其療效維持的平均時間較長,能實質性改善患者的生存期[9,10]。當然,相應的治療時間和費用也會隨之增加。
1.3 安全性
PD-1/L1藥物常見的不良反應有皮膚毒性、腹瀉與結腸炎、肝臟毒性等[11,12]。與傳統的腫瘤放化療相比,PD-1/L1藥物的嚴重不良反應發生率更低,安全性更高,因此患者的服藥依從性和持續性會更佳。
1.4 多聯用性
從療效角度講,PD-1/L1藥物的單藥治療并沒有顯著優勢,其針對絕大多數實體瘤的有效率為20%左右。但該類藥品可以與傳統放化療、靶向治療、T細胞活化介質等各種療法聯合使用[13,14],增強腫瘤治療效果,從而可顯著擴展其治療人群。
2 PD-1/L1藥物對醫保基金的潛在壓力
如上所述,PD-1/L1藥物具有廣譜、持久、安全、多聯用等特點,這對腫瘤治療是利好消息,但如果眾多該類藥物上市并進入醫保目錄,也會對醫保基金產生潛在壓力。
據國家癌癥中心發布的最新一期全國癌癥統計數據顯示[15],我國平均每天有超過1萬人被確診為癌癥,每分鐘有7.5個人被確診為癌癥,惡性腫瘤死亡占居民全部死因的23.91%。近10多年來,惡性腫瘤發病率每年保持約3.9%的增幅,每年惡性腫瘤所致的醫療花費超過2200億,形勢嚴峻。
在我國,眾多PD-1/L1藥物已經上市或即將上市。截至2019年2月,我國已有4種該類藥物獲批上市,其年治療費用均超過20萬(甚至更多)。此外,用PD-1/L1藥物治療的患者需要持續用藥,其相對高昂的費用將對患者及其家庭產生沉重的經濟負擔。因此,通過醫療保險的互助共濟機制緩解腫瘤患者的經濟負擔,提高該類藥品的可及性,將成為社會的一種殷切期望和呼聲。
作為腫瘤治療藥品,PD-1/L1藥物的價格和治療費用相比其他疾病的治療費用是昂貴的。目前PD-1/L1類藥品研發熱情高漲,預計將會有諸多新藥上市,雖然PD-1/L1藥物上市和申請醫保準入是基于某個適應癥開始,但其后完全有可能擴展到多個癌種及腫瘤治療各個階段,并和其他治療方式形成聯用,預計其應用范圍和使用數量均較為可觀。然而,目前我國基本醫療保險基金可持續的壓力在不斷增大,據報道,2018年醫保基金的支出增速高于收入增速近3個百分點[16]。因此,PD-1/L1藥物對醫保基金的潛在壓力甚至風險將不可小覷。
3 基于支付標準聯動的PD-1/L1藥物醫保定價機制
鑒于PD-1/L1藥物的特點,醫保為其制定支付標準時會面臨兩難:一方面,作為創新性腫瘤藥品,在首個適應癥上市并進入醫保目錄時,照常規思路是可以也應該獲取相對較高的定價,以作為對創新價值的認可和激勵;但另一方面,如果以后該藥品擴展到多個適應癥、乃至多種聯合使用,其使用數量會比較多,則會產生更多的醫療費用,從而對醫保基金產生更大的壓力。而反過來說,如果為了緩解未來的費用壓力而在PD-1/L1藥物首個適應癥進入醫保目錄時就制定較低的支付標準,則又不符合創新支持和價值購買的醫保理念。
為解決上述矛盾,需要探討適宜的醫保定價和支付制度安排,這其中一個可考慮的方法是:采用PD-1/L1藥物多適應癥醫保支付標準聯動的機制。具體而言,在PD-1/L1藥物首個適應癥準入時,可以參照其他腫瘤創新治療藥物的定價方式確定適宜的醫保支付標準。由于PD-1/L1藥物互相之間的類似性,該支付標準可適用于全部PD-1/L1藥物在該適應癥中的定價支付。而當該PD-1/L1藥物擴展到其他適應癥時,就可以把新舊適應癥的PD-1/L1藥物醫保支付標準進行比較,統一為較低的那個標準。如此,就會把PD-1/L1藥物治療腫瘤的支付價向低位引導,在適應癥和使用人數擴展的同時,可防止醫療費用的過快上漲。
從相反角度講,在上述醫保支付機制下,如果醫藥廠商為了維持首發適應癥的支付標準而選擇不擴展適應癥,選擇專注于某個治療領域,那么PD-1/L1藥物的適應癥擴展就會比較少,其醫療費用占用會較低。此時即使首發適應癥的支付標準較高,也不會對醫保基金產生太大壓力。
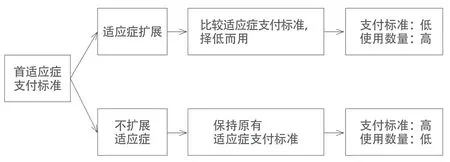
圖1 支付標準聯動的PD-1/L1藥物醫保支付標準機制示意圖
綜上所述,在支付標準聯動的機制下,如果PD-1/L1藥物大量擴展適應癥將導致支付標準普遍降低,而若廠商選擇不擴展適應癥以維持較高的支付標準,則能防止使用數量和費用的過快增長。這樣的機制可以兼顧對創新的支持和對醫保基金的保護,示意圖請見圖1。
4 討論和結論
PD-1/L1藥物是創新性腫瘤治療技術,有著廣泛的使用潛力,這意味著需要為其制定適宜的定價支付機制,以協調創新支持和醫保基金安全兩方面的需求。為達到上述目的,有很多策略方法可以探討,本文則提出了支付標準聯動的定價機制:允許PD-1/L1藥物進入首個適應癥時有較高定價,而當出現適應癥擴展時就低下調醫保支付標準,從而降低醫保基金占用。在有限資源的前提下有效支持醫藥技術創新,這種均衡多方利益的政策考量是有必要的。
當然,要建立完全適宜的醫保支付標準機制是非常困難的,本文中提出的方法也還有很多具體的問題需要權衡思考。例如,對于同一適應癥的不同PD-1/L1藥物建立統一支付標準,就有可能抹殺了具體藥品的差異性價值:同一適應癥的不同原研藥以及同樣成分的原研藥與其生物類似物之間,由于抗體的重鏈和輕鏈的序列不同及生產工藝的不同,其質量和療效也可能有較大差異,因此會產生不同的相對價值和不同的醫保準入意義。此時,建立基于循證的具體產品具體決策協商機制,可能是必要的補充。再如,在支付標準聯動機制中,如果某些廠商采用極低支付標準首先進入某適應癥,從而在一段時間內排斥其他PD-1/L1藥物進入該適應癥,則該腫瘤的患者就可能暫時得不到其他更好的PD-1/L1藥物,并且還可能導致價格惡性競爭,從而影響我國生物醫藥產業的健康發展。此時,也需要對過低的定價保持警惕和綜合考慮。
綜上所述,PD-1/L1藥物是創新機制的腫瘤治療技術,具有廣譜、持久、安全、多聯用等特點,這既對腫瘤治療有利,也可能對醫保基金造成壓力甚至風險。因此,需要基于PD-1/L1藥物品的特點和醫保基金的承受能力,統籌考慮,對該類藥品的定價機制進行合理的設計,以兼顧各方利益,使有限的資源能夠發揮最大的效率,為患者人群帶來最優的健康收益。
社會醫療保險的戰略購買需要建立在三個基本原則的基礎上:
1 與國家經濟發展水平相適應的前提原則
基本醫療保險必須充分考慮國家的整體經濟發展水平,注意國民經濟和社會資源的承受能力,考慮GDP、衛生總費用、藥品總費用年增長率的水平,在盡可能滿足人們對于醫療健康需求的同時,防止超前消費,防止人們的過高預期,防止醫保保障水平超出可持續發展的水平。
2 堅持醫保社會公平性的指導原則
基本醫保必須充分考慮社會公平的原則。在醫療服務領域,社會公平具體體現在兩個方面:一是多數原則,滿足大多數人可以享有到的醫療服務。盡管在醫療保險上應該考慮按需分配,但是如果醫保只支付重大疾病,而對于多數人需要的日常醫療服務不予支付,社會醫療將無法獲得多數人的支持,有失社會公平性。二是需要原則,滿足對于影響生命安全的醫療需要。人的生命只有一次,如果在生命安全上不能得到保障,任何其他社會公平將失去意義。生命安全的公平是最重要的社會公平。而對那些未滿足的需要則應根據醫保基金的可承受性逐步得到體現。
3 以提升價值(性價比、成本效益)為核心原則
在經濟發展水平和社會公平原則的框架下,在對于具體醫療服務項目、具體醫療技術手段的選擇上,價值原則是最為核心的指導原則。需要對各種醫療服務、各種醫療技術手段,建立價值評估的機制和評價結果,同時需要做動態調整。價值原則落實到醫保的戰略購買上,體現為對于性價比高的藥品、醫療服務項目和醫療技術手段,可以優先考慮支付,或者提高醫保支付的水平。
——摘自蔡江南《6個方面,談談如何實現醫療保險的戰略性購買》(“中國醫療保險”微信公眾平臺2019年6月21日)

