氣體作為電子供體的硫酸鹽還原菌研究進展
祝傳靜 李柳青 黃建洪 田森林 胡學偉
(昆明理工大學環境科學與工程學院,昆明 650500)
礦山開采、化工、制藥、煙氣脫硫等生產過程都會產生大量含硫酸鹽廢水,其不僅導致設備結垢,還會在厭氧條件下生成硫化氫等生物毒性組分,傳統處理方法(如化學沉淀法等)存在設備腐蝕結垢、藥劑消耗大及廢渣產量大等問題[1-2]。硫酸鹽還原菌(Sulphate reducing bacteria,SRB)在電子供體充足情況下可實現對硫酸鹽的生化轉化,其具有反應條件溫和、固廢產量小及回收硫資源等優點[3-4]而受到廣泛關注。傳統SRB常以醇類、有機酸類和糖類等為電子供體[5],但該類可溶性有機電子供體投加量大、運行成本高、出水殘留有機物濃度高,而需要后續深度處理[6],因此尋求新型SRB電子供體具有重要的現實意義。
自Widdel等[7]發現合成氣(H2/CO2/CO)可供微生物利用,Dupreez等[8]證明合成氣可用作生物硫酸鹽還原的電子供體,加之合成氣具有來源廣泛、價格低廉、單位質量供電子量大、出水殘留COD濃度較低等顯著優勢,在硫酸鹽廢水處理領域受到持續關注。本文主要綜述SRB利用氣體作為電子供體時的反應機理和影響因素(環境因子、氣體傳質、涉硫組分和供體競爭)、氣體特性及代謝轉化對硫酸鹽還原的影響,以期對后續深入研究奠定基礎。
1 以氣體為電子供體的反應機理
SRB以氣體作為電子供體,其通過對分子氫的直接利用,氫擴散穿過細胞質膜,在氫化酶及色素C3作用下,膜轉移用于細胞質的電子受體還原,利用過程如圖1所示。在該還原過程中,SRB消耗電子供體的量受電子受體的分子量及形態影響,如電子受體較消耗的供體H2少[見等式(1)和(2)],且的代謝中間產物在H2氛圍下會歧化生成硫酸鹽和硫化物[見等式(3)和(4)]。
以H2/CO2作為電子供體/碳源,在SRB生化還原中的反應:

由于CO具有毒性,大多數SRB只能在較低的CO濃度條件下生長且它們生長代謝存在差異。部分SRB(如Desulfotomaculum carboxydivorans)能直接利用CO作為電子供體進行硫酸鹽還原產生硫化物[12];存在著部分厭氧菌(如Carboxydothermu hydrogenoformans)可將CO代謝轉化為H2和CO2[13-14],CO2易溶于水生成 HCO3-,SRB可利用該類厭氧菌產生的H2和CO2進行硫酸鹽還原;大部分SRB( 如D. kuznetsovii和D. thermobenzoicumsubsp.thermosyntrophicum)利用CO時會受到CO抑制影響[15]。
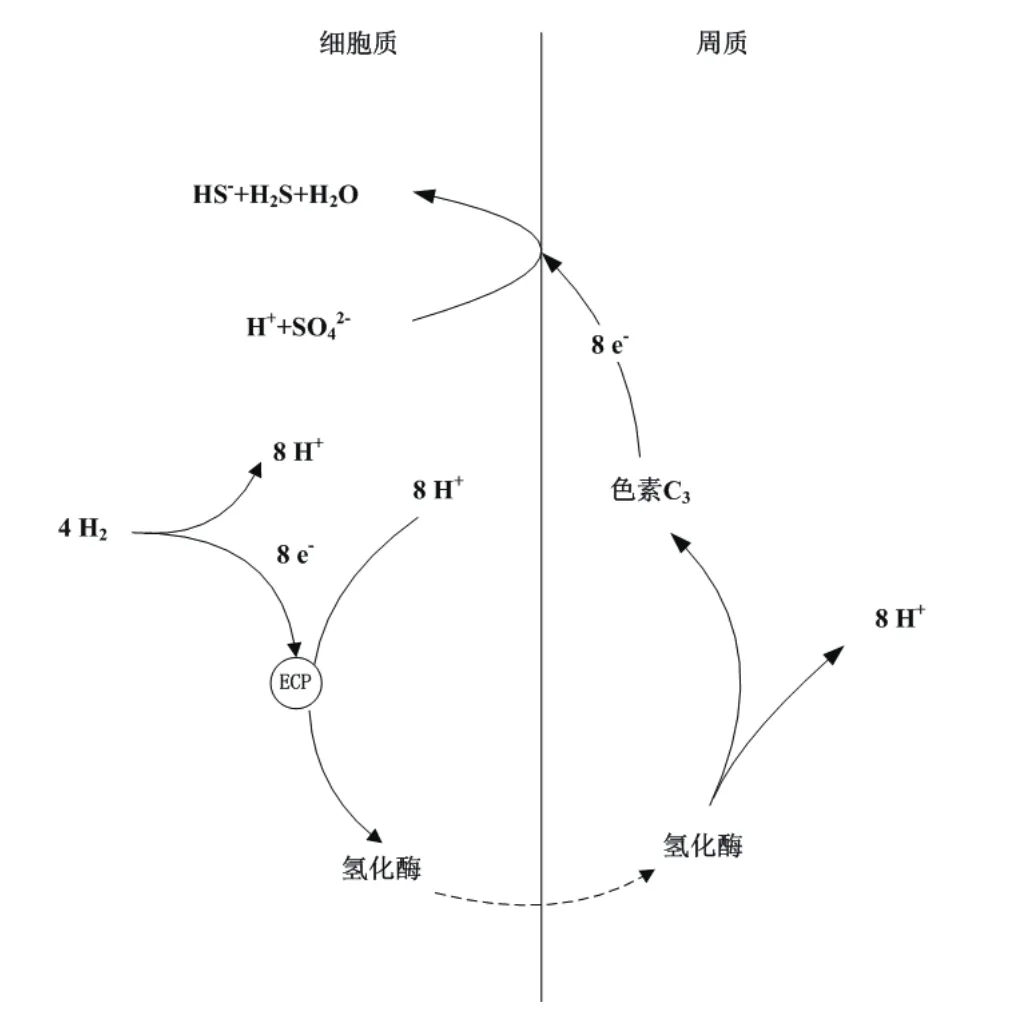
圖1 SRB利用氣體為電子供體的酶定位、氫循環示意圖
以CO作為電子供體,在SRB生化還原中的反應:
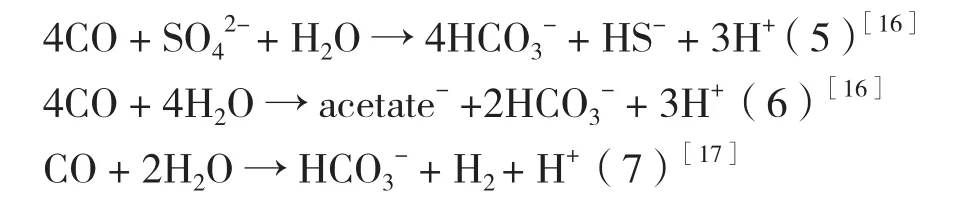
能夠進行無機化學營養生長的細菌屬于自養型。通常,能利用H2作為電子供體進行產能代謝的自養型SRB具有兩種不同類型的氫化酶,一種是在細胞質里的氫化酶用于吸收H2,另一種是膜結合氫化酶用于產能作用。另外,能利用CO作為電子供體的SRB還需具有CO脫氫酶[16]。在自養型SRB代謝過程中,除氫化酶起重要作用外,細胞色素C3可起到傳遞電子的作用,對SRB還原活性的提高有幫助(表 1)。
自養型SRB通過利用H2/CO2、CO等電子供體進行代謝產生ATP、一些小分子的物質或分解代謝過程中的中間產物用于生物固碳合成細胞物質,其采用的固碳機制是還原型三羧酸循環(rTCA)和還原型乙酰輔酶 A 循環。rTCA 循環由 Evans 等[18]在1966 年提出,在rTCA 循環中兩分子的CO2可以合成一分子的乙酰輔酶 A,如圖2所示,rTCA循環中大多數酶(蘋果酸脫氫酶、延胡索酸水合酶、琥珀酰輔酶 A 合成酶、異檸檬酸脫氫酶以及烏頭酸水合酶)催化反應都是可逆的,其中延胡索酸還原酶、2-酮戊二酸合成酶以及檸檬酸裂解酶是 rTCA 循環特有的酶。Aoshima等[19]報道rTCA 循環中包括兩個羧化反應:2-酮戊二酸合成酶催化的琥珀酸輔酶 A轉化成 2-酮戊二酸;由異檸檬酸脫氫酶或酮戊二酸和草酰琥珀酸還原酶催化的羧基化反應(2-酮戊二酸羧基化為異檸檬酸)。ATP 依賴型檸檬酸裂解為乙酰輔酶 A 的反應被認為是 rTCA 循環中的關鍵反應,這個關鍵反應由 ATP 檸檬酸裂解酶單獨催化或者由檸檬酰輔酶 A 合成酶和檸檬酰輔酶 A 裂解酶共同催化。還原型乙酰輔酶 A 途徑最早由 Drake等[20]和Ljungdahl[21]團隊在產乙酸菌中發現,其反應途徑為兩分子CO2直接以非環化的方式合成乙酰輔酶 A,最終產物為乙酸,其中起作用的關鍵酶為CO脫氫酶。

表1 氫化酶和細胞色素C3對SRB的還原影響
2 以氣體為電子供體的影響因素
2.1 環境因子
環境因子的變化會影響SRB的生命活動,只有當環境條件適宜時,SRB的生命活動才能正常進行,否則其生命活動就會受到抑制、引起變異或死亡。SRB可在氯化鈉含量小于0.818%的環境中進行生長,大于2.45%時其生長受到完全抑制。pH不僅會影響SRB對硫酸鹽的轉化,還會導致微生物聚集體的變化,Van Houten等[23]以H2/CO2為電子供體及碳源進行硫酸鹽還原發現,當pH 7.0-7.5時,硫酸鹽轉化速率為16 g SO42-/(L·d),SRB 聚集體為不規則球狀;pH從7.5上升至8.0,硫酸鹽轉化速率較pH 7.5時降低,且聚集體表面變得更不規則;當pH降低至6.5時,硫酸鹽轉化速率及聚集體無明顯變化;pH繼續降至5.5時,總硫酸鹽轉化速率急劇下降至2 g SO42-/ L·d-1,聚集體由原來的球狀變為絲狀和螺旋狀。SRB作為嚴格的厭氧菌,其具有一定的抗氧能力[24],但其細胞內各種生物化學反應都需在特定的ORP范圍內完成,Chang等[25]和Neufeld等[26]發現 SRB只有在ORP<-100的條件下才能正常生長,隨著ORP的升高,SRB還原活性下降;徐慧緯等[27]研究表明在SRB反應過程中ORP<-350 mV時,與pH、SO42-濃度相比,ORP不再是影響硫酸鹽還原速率的主要因素。溫度是厭氧沉積物中硫酸鹽還原作用的主要環境參數,Van Houten等[23,28]在中溫(30℃)條件下獲得最大硫酸鹽轉化率30 g SO42-/(L·d);Nevatalo等[29]發現在 35℃時 HSRB的還原活性最強92 mmol/(gVSS·d),隨著溫度的降低,HSRB還原活性降低。
2.2 氣體傳質
氣體傳質主要是在壓力梯度驅動下的氣體流動傳質。氣體傳質限制會影響SRB的厭氧生化轉化,可通過加強生物反應器中的氣體傳質,來提高SRB還原效率。Van Houten等[28]通過改變反應器內H2濃度,驗證了硫酸鹽的穩態轉化是由于H2的傳質限制。Sipma等[17]發現脫硫腸狀菌屬D.carboxydivorans對CO的轉化受氣體傳質影響。
由于H2、CO在水中的溶解度較小,為增加該類氣體(電子供體)在水中的溶解濃度和傳質效果,有學者通過膜供應氣態底物、增大氣體壓力等方法來強化氣液傳質。Fedorovich等[30]利用微孔(0.45 μm)疏水性膜向反應器提供H2,得出氣體傳質和反應器液體不適當的混合不利于低濃度硫酸鹽還原。Tang等[31]發現復合中空纖維的氣體輸送率較單壁聚酯高,但其存在成本高、沉淀物易堵塞孔隙的缺點;Ontiveros-Valencia等[32-35]研究了硫酸鹽還原菌(Sulphate reducing bacteria,SRB)、反硝化菌(Denitrifying bacteria,DB)和高氯酸鹽還原菌(Perchlorate-reducing bacteria,PRB)的共存關系,發現氣體壓力的增加有助于硫酸鹽還原。針對氣體加壓存在能耗大、運行成本高、氣壓存在上限等問題,徐慧緯等[27]采用兩室型生物-電化學系統通過附加直流電的方式來供H2,得出當I =1.50 mA時,硫酸鹽平均還原速率最高。符詩雨和駱海萍等[36]利用雙極室微生物電解系統(Microbial electrolysis system,MES)供氫,外加電壓為0.8 V時,硫酸鹽的去除率較高,平均硫酸鹽還原速率可達73.2 mg/L·d。
2.3 涉硫組分
在中性pH 7時,硫酸鹽還原產物是等量的H2S和HS-[等式(5)(9)]。在pH 5時,約99%的產物是 H2S[等式(8)(10)],如下列等式[38]:
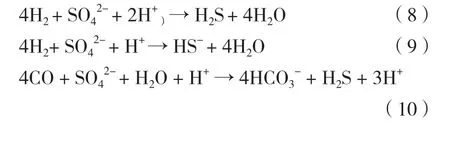
H2S 是 pH <7 時抑制作用最強的硫化物[38-39],但H2S對微生物的抑制機理尚未明確。其中一種假說認為H2S可自由穿過細胞膜,一旦進入細胞質,就假定硫化物與細胞色素中的鐵、其他細胞內含鐵化合物結合,從而抑制細菌生長甚至死亡[40]。另一種假說則認為在偏酸性條件下,硫酸鹽還原產生的大量H2S穿過細胞膜后,在細胞質中解離并釋放出質子,使質子動力不穩定,從而抑制ATP的生成,并且SRB所獲得的大部分能量被用于pH穩態而不是細菌生長,最終導致細胞死亡[41]。Bijmans等[39]研究了pH為5的高硫酸鹽SRB反應器中硫化物的去除對反應器性能和微生物群落的影響,發現硫化物的去除提高了硫酸鹽的轉化,若未去除硫化物,不僅硫酸鹽轉化率急劇降低,而且反應器內生物多樣性也會大幅度減少。然而,在硫化物存在的情況下SRB的活性較產甲烷菌(Methanogenic bacteria,MPB)高,是由于絮狀厭氧污泥比顆粒污泥對硫化物的抑制更敏感[42];Sipma等[43]發現體系中硫化物的增加,MPB活性逐漸消失,而SRB仍具有電子供體的利用能力,其中MPB活性消失的原因是硫化物的毒性抑制。
2.4 供體競爭
在低ORP的環境中,SRB和其他微生物之間存在電子供體競爭關系,包括MPB和產乙酸菌(Acetogenic bacteria,AB),這些競爭關系中一些重要方程式列于表2中。當硫酸鹽過量的情況下,SRB比MPB有較優的生長速率、底物親和力、細胞產率。Meulepas等[44]發現SRB對氫的親和力高于MPB,即使在低氫分壓下SRB的活性也強于MPB;任榮等[45]發現反應系統中ORP的降低,可提高MPB對SRB的H2競爭。
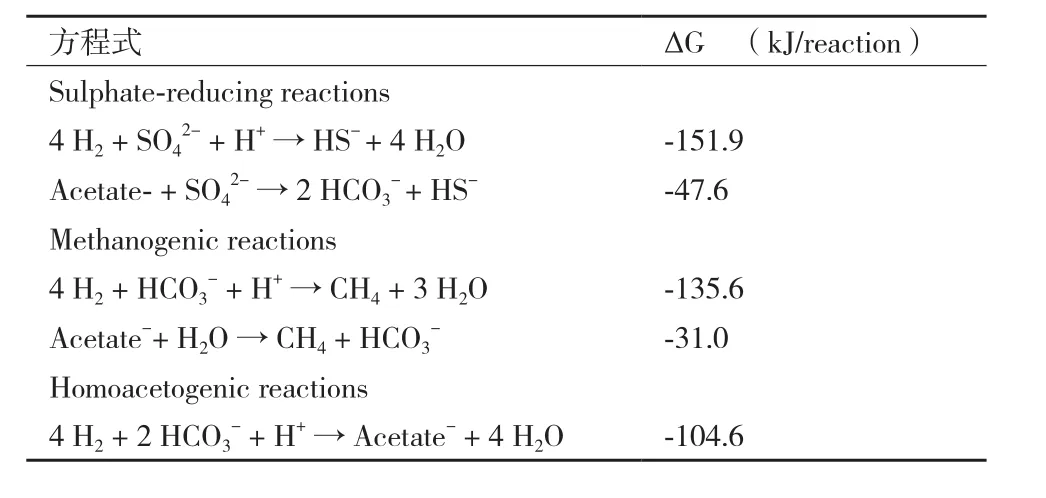
表2 硫酸鹽還原、甲烷產生及產乙酸鹽反應方程式[46]
在以H2/CO2為電子供體時,污泥停留時間(Sludge retention time,SRT)對厭氧污泥中SRB、MPB和AB之間H2競爭有影響。Weijma等[47]認為增加SRT會影響SRB與MPB的H2競爭,且較長的SRT會使AB 和SRB的共生形式比MPB更具有優勢;Sipma 等[43]研究發現增加SRT僅推遲MPB與SRB的競爭,而不影響最終的競爭結果,且較長的SRT對MPB、SRB和AB無顯著影響。
在以CO為能源時,水力停留時間(Hydraulic retention time,HRT)將決定SRB在反應中競爭H2的優勢。Sipma等[48]發現較長的HRT不利于SRB電子供體的競爭。在控制HRT為3 h時,SRB較MPB占優勢,硫酸鹽還原速率為17 mmol·L-1d-1,超過87%的H2生產用于硫酸鹽還原;4 h時,其能夠消耗反應器內95%的H2,硫酸鹽還原速率較3 h時高;當HRT上升至49 h時,MPB成為H2消耗的主導[49],而SRB得不到足夠的電子供體,導致硫酸鹽還原速率下降。然而較短的HRT會使反應器內SRB生物量降低,這顯然會導致電子供體利用率、硫酸鹽轉化速率降低,表明足夠的生物量是實現更高的硫酸鹽轉化速率的先決條件[28,49]。Van Houten等[28]向反應器中添加浮石顆粒等載體材料促使SRB生物量增加,但MPB在載體中的附著能力也強。
3 氣體特性及代謝轉化行為
3.1 CO毒性抑制
CO具有毒性會抑制SRB的生長。Van Houten等[23,28]以H2/CO2/CO的氣體混合物作為電子供體和碳源來評估CO對SRB的影響發現,在H2/CO2培養下,生物聚集體的外表面具有“毛狀”結構,當加入CO后外表面上的毛狀結構消失且變得光滑,微生物的附著能力、生長速率、硫酸鹽還原能力降低。Pandelia和Greco等[50-51]研究發現在CO培養下的厭氧菌存在氫化酶抑制作用。Parshina等[16,52]發現當CO濃度達20%以上時,SRB氧化H2電子供體所需的時間增加,表明CO對SRB氫化酶存在抑制作用。然而Sipma等[43]發現SRB生化反應器內CO濃度的增加,乙酸鹽不斷生成,但氫化酶在乙酸生成中起著核心作用,表明CO對氫化酶的抑制不太可能是SRB受CO抑制的唯一原因。
3.2 CO代謝轉化
由于CO對SRB具有毒性抑制,因此能利用CO為唯一電子供體的微生物較少。Van Houten等[28]、Sokolova等[14]研究表明SRB 在較高CO 濃度下不能在聚集體的外部區域存活,且能利用CO生長的微生物數量較少。然而Parshina等[16]發現硫酸鹽還原菌D.kuznetsovii和D.thermobenzoicumsubsp.thermosyntrophicum均能在較高CO濃度下生長。D.kuznetsovii能耐受20% CO濃度,當超過20%CO進入系統時,其硫酸鹽轉化率、H2S產量顯著下降,體系中乙酸鹽隨著CO濃度的增加而增加;D.thermosyntrophicum能耐受高達70% CO濃度,當CO濃度超過70%時,其硫酸鹽轉化率、H2S產量降低,體系中乙酸鹽先增加后降低(表3)是由于CO濃度的增加,硫酸鹽還原受到抑制而產生大量乙酸鹽,受到CO毒性抑制的D.thermobenzoicum不能轉化和利用CO,導致其利用體系中的乙酸鹽進行還原反應。
部分微生物可直接利用CO進行生長。Parshina等[15]報道Carboxydothermu hydrogenoformans將 CO代謝轉化為H2進行生長,其不具有硫酸鹽還原能力;SRB可與這種微生物共培養來降低CO的毒性抑制(表 3)。Parshina和 Sipma等[16,52-53]發現脫硫腸狀菌屬D.carboxydivorans不僅能進行硫酸鹽還原,還能實現對CO的代謝轉化。當存在硫酸鹽的情況下,D.carboxydivorans將CO代謝轉化為H2,該H2又被用于硫酸鹽還原且最大硫酸鹽還原速率為0.3 mmol/h;當不存在硫酸鹽時,該菌屬仍能實現對CO的代謝轉化[12,53]。
3.3 代謝轉化產物
CO由厭氧污泥內產氫群體(如D.carboxydivorans)代謝轉化為H2和CO2,H2的存在會降低CO轉化率。據Sipma等[53]發現CO/H2比率決定著SRB對CO的代謝轉化,H2的增加會降低CO被代謝轉化的速率。CO被代謝轉化成的H2在厭氧污泥中也存在著競爭關系。Sipma等[43]發現在CO存在情況下,厭氧污泥中MPB對H2的競爭強于SRB,而AB的競爭能力弱于SRB。當硫酸鹽還原或產甲烷作用占H2消耗主導時,能被AB利用的氫電子流通常很小,以致于AB不能與MPB或SRB競爭,產生這種競爭結果的原因可能是產乙酸作用需要相對較長的時間[42,53],當HRT遠低于AB的倍增時間時,反應器內AB活性低、H2競爭能力弱。在CO培養的厭氧污泥中,需盡量減少MPB對電子供體的消耗來提高硫酸鹽還原。Sipma等[17]發現在較高溫度(60和65℃)下,SRB活性比MPB強,但溫度較高會影響污泥中產氫群體對CO的代謝轉化;Vallero等[49]發現在高鹽度情況下,MPB比SRB的H2競爭能力強;Parshina等[52]發現當pH低于5.8時,SRB的H2競爭能力較MPB強,但轉化CO的產氫菌屬將不能生長。
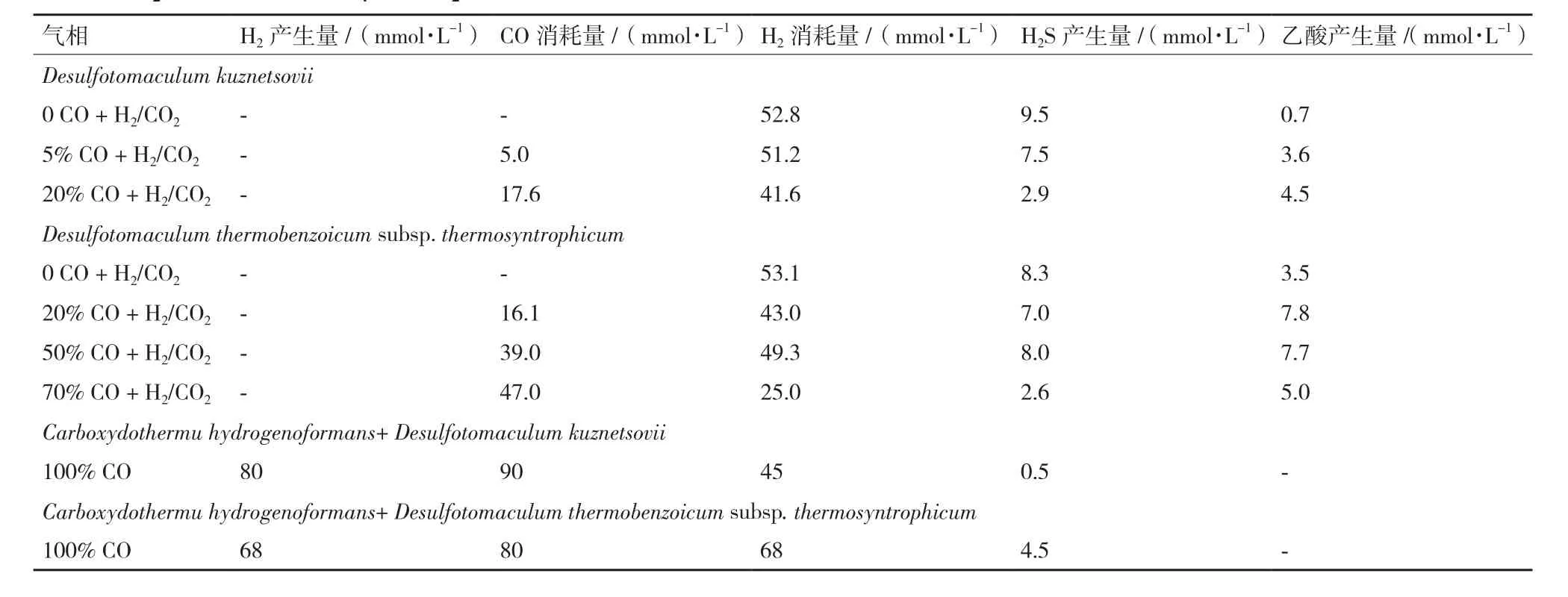
表3 D.kuznetsovii和D.thermobenzoicum subsp. thermosyntrophicum對不同濃度的一氧化碳(CO)+氫/二氧化碳(H2/CO2)+硫酸鹽(SO4)的H2S轉化
4 小結
含硫酸鹽廢水的生化處理較傳統物化處理具有多重優勢,而氣體作為SRB代謝過程的電子供體相較傳統有機碳源也具有顯著優勢。綜上所述,氣體作為SRB電子供體在代謝機理、影響因素、毒性氣體(CO)的還原轉化等方面已有相應的研究,其具有重要的理論意義和指導價值。但氣體作為電子供體在含硫酸鹽廢水的生化處理工程應用中仍有諸多難題亟待解決。氣體傳質對于SRB還原能力的提升至關重要,而H2、CO為難溶性氣體,其溶于水體供SRB利用的效率較低,因此難溶性氣體在生化系統中的傳質阻力及效率提升還需深入研究,新型增溶擴散膜材料及電解產氫電極材料可能是有潛力的技術方向。CO可作為SRB良好的電子供體,其具有較強毒性導致大多數SRB受抑制而未能發揮還原能力,且CO對生化代謝過程的毒性抑制機理尚不明確,其抑制機理及解除策略還有待深入研究。在代謝反應過程中,SRB存在生物增殖、競爭能力減弱等問題,為有力促進SRB在含硫酸鹽廢水處理中的工程應用,可考慮SRB的高效增殖、代謝活性保持、目標代謝產物的定向調控等研究。

