錫蘭鉤蟲HPI基因的原核表達與生物信息學分析
黃 岳,劉云秋, 顏欣欣, 杭建雄, 冉榮坤, 孫永祥, 李國清
鉤蟲是一類被忽視的人獸共患的寄生蟲,不僅影響著犬、貓等伴侶動物的生長發育,更是嚴重危害人類的健康。1990年世界衛生組織首次采用傷殘調整生命年(disability-adjusted life years,DALY)來評估鉤蟲病對人類健康的影響程度,2010年本病導致的缺鐵性貧血至少損失了320萬DALY[1]。在熱帶和亞熱帶貧困地區,大約有7.4億人正在受到此病的困擾[2]。目前,鉤蟲的抗凝血機制已經引起了人們的關注,并從一些鉤蟲分離出具有抗凝血活性的多肽即抗凝肽(anticoagulant peptides),如犬鉤蟲的AcaNAP10、錫蘭鉤蟲的AceAP1和十二指腸鉤蟲的AduNAP4[3-5]。然而,關于鉤蟲抑制宿主血小板功能的機制尚不清楚。Valle等[6]雖然在犬鉤蟲中分離出HPI(hookworm platelet inhibitor)蛋白,但對其生物學功能知之甚少。
本研究從錫蘭鉤蟲的cDNA中克隆出AceHPI基因,將其在E.coliBL21(DE3)菌株中進行原核表達,經His標簽蛋白純化試劑盒(Ni-NTA 柱親和層析法)純化該融合蛋白,并且通過生物信息學分析預測了該蛋白的生物學特性。
1 材料與方法
1.1 材 料
1.1.1實驗蟲株 錫蘭鉤蟲成蟲由華南農業大學獸醫學院臨床外科教研室提供。
1.1.2主要試劑 pET-28a原核表達載體由本實驗室保存。pMD-19T克隆載體、T4 DNA 連接酶、BamHI和NotI購自寶生物工程(大連)有限公司。BCA蛋白濃度測定試劑盒、E.coliBL21(DE3)工程菌、鼠抗His標簽抗體和兔抗鼠IgG-HPR抗體購自生工生物工程(上海)股份有限公司。MicroElute Total RNA Kit和M-MLV First Strand cDNA Synthesis Kit和Gel Extraction Kit D2500購自廣州飛揚生物工程有限公司。His標簽純化試劑盒購自碧云天生物技術(上海)公司。
1.2 方 法
1.2.1總RNA提取及反轉錄 取錫蘭鉤蟲新鮮蟲體,依據MicroElute Total RNA Kit試劑盒說明書提取RNA,用紫外分光光度計檢測總 RNA濃度,并檢測其純度。參照M-MLV First Strand cDNA Synthesis Kit試劑盒的操作說明書合成第一鏈cDNA,取總RNA 1 μg、oligo(dT)1 μL,10 mmol/L dNTP mix 1 μL,加DEPC水至18 μL,70 ℃孵育5 min后冰上急速冷卻;再依次加入5×反應緩沖液5 μL、RNA酶抑制劑1 μL和逆轉錄酶1 μL,輕輕混勻并短暫離心后42 ℃孵育60 min,-80 ℃保存備用。
1.2.2AceHPI基因的擴增 參考已知的犬鉤蟲HPI(AcaHPI)基因序列(No. AF399709.1),從其ORF 兩端設計特異性引物HPI-F和HPI-R,擴增目的基因;再設計上下游引物XL-F2和XL-R2去除目的基因信號肽序列(表1)。反應條件:94 ℃預變性5 min;94 ℃變性30 s,58 ℃退火30 s,72 ℃延伸80 s,共35個循環;最后72 ℃延伸8 min。
表1 RT-PCR引物序列
Tab.1 Sequences of the primers for RT-PCR

NameSequenceProduct length /bpHPI-F5′-ATGAGCTCTTATCTTCTGGT-3′603HPI-R5′-TCAGTGACCAATGCAGAGCAAAT-3′XL-F25′-CGGGATCCGAAGGTGACTATTCGC-TATGCCAGC-3′568XL-R25′-TGGCGGCCGCGTGACCAATG-CAGAGCAAATTCT-3′
The underlined parts are the restriction enzyme sites ofBamHI andNotI
1.2.3原核表達載體的構建 采用BamHI、NotI雙酶切質粒pET-28a和目的基因PCR產物,對其酶切產物純化回收并用T4連接酶連接, 轉化感受態E.coliBL21(DE3), 挑取單菌落, 在卡那霉素抗性LB 液體培養基中培養, 取1 μL菌液進行PCR 驗證, 將其陽性克隆送去生工生物工程(上海)股份有限公司測序。
1.2.4融合蛋白的表達與純化 將含有重組質粒pET28a-AceHPI的大腸桿菌E.coliBL21(DE3)接種于10 mL卡那霉素(50 μg/mL)的LB培養基中培養過夜, 再按1∶100比例轉接于200 mL卡那霉素液體培養基中,37 ℃, 185 r/min擴大培養。待菌液OD 值達到0.4~0.6時,加入終濃度為 0.1 mmol/L的IPTG, 在28 ℃、165 r/min誘導6~10 h。離心收集菌體后, 再用10 mL PBS 懸浮菌體。菌液冰浴、超聲波破碎,所得細胞裂解液在12 000×g下離心10 min。收集上清液采用His標簽蛋白純化試劑盒進行純化。純化后的重組蛋白使用BCA蛋白濃度測定試劑盒測定其濃度。
1.2.5融合蛋白的Western-blot鑒定 將重組菌裂解上清液進行SDS-PAGE電泳,在轉膜儀上15V處將其轉移到硝化纖維膜上,在含0.5%脫脂奶粉的TBST(含0.05%吐溫-20的TBS)中封閉2 h,再用鼠抗His標記單克隆抗體(1∶6 000)和辣根過氧化物酶(HRP)結合兔抗鼠IgG(1∶20 000)孵育。采用Dab法檢測AceHPI融合蛋白的反應原性。
1.2.6AceHPI的生物信息學分析 根據錫蘭鉤蟲AceHPI基因核苷酸序列推測其蛋白的氨基酸序列,用DNAMAN軟件將其與犬鉤蟲AcaHPI的氨基酸序列進行同源性比對。用DNAStar 軟件分析AceHPI蛋白的分子質量、等電點等理化性質。用ProtScale 軟件(http://web.expasy.org/cgi-bin/protscale/protscale.pl)分析AceHPI蛋白的疏/親水性;用在線工具SignaIP4.1(http://www.cbs.dtu.dk/services/SignalP/)分析AceHPI信號肽序列;用在線軟件(http://www.cbs.dtu.dk/services/TMHMM/)對AceHPI 氨基酸序列進行跨膜結構域分析;用SWISS-MODEL三級結構預測軟件(http://swissmodel.expasy.org/)建立該蛋白的三維結構預測模型。
2 結 果
2.1目的基因PCR擴增與重組質粒的鑒定 以錫蘭鉤蟲cDNA為模板進行PCR 擴增、克隆和測序,獲得了全長為603 bp的基因序列(No. MK087839)。重組質粒pET28a-AceHPI用BamHI和NotI酶切后,獲得了大小約為603 bp的AceHPI片段,與預期目的片段大小一致(圖1)。
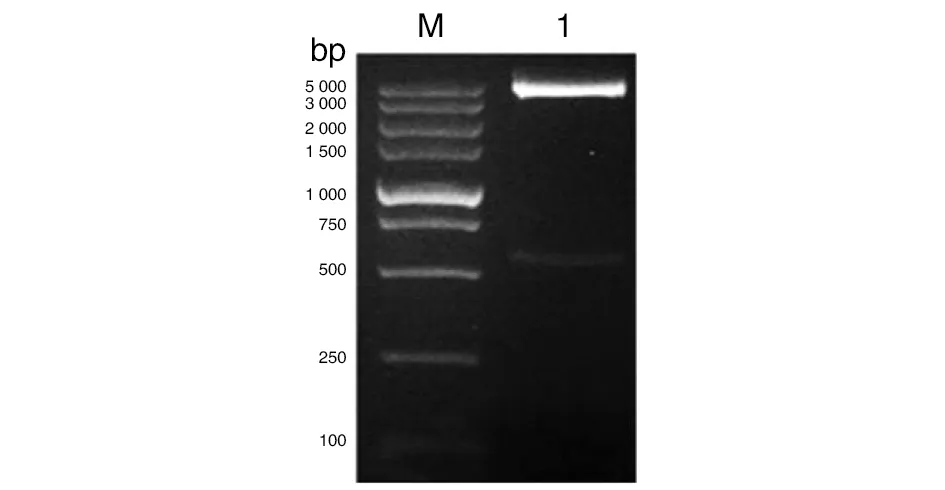
M: DNA marker; 1: Products from pET28a-AceHPI digested with BamHI and Not I.圖1 重組質粒pET28a-AceHPI雙酶切鑒定Fig.1 Double enzyme digestion identification of pET28a-AceHPI
2.2融合蛋白的表達與鑒定 陽性質粒pET28a-AceHPI轉化E.coliBL21(DE3)菌株后,在IPTG誘導下其融合蛋白得到了有效表達。經SDS-PAGE分析,該融合蛋白的分子量約為26 kDa。采用50 mmol/L的洗脫緩沖液洗脫,該融合蛋白產率約為1.1 mg/mL(圖2A)。經Western blot分析,與抗HIS標簽抗體結合的蛋白約為26 kDa(圖2B),其大小與AceHPI融合蛋白的理論值一致。
2.3AceHPI蛋白同源性與生物信息學分析 測序結果顯示,AceHPI基因長度為603 bp,共編碼200個氨基酸(圖3)。通過DNAMAN軟件比對,AceHPI與AcaHPI蛋白氨基酸序列同源性高達91%。
利用在線軟件對其氨基酸序列進行生物信息學分析,結果顯示,該蛋白分子質量和等電點分別為22.5 kDa和7.0;疏水性平均系數(GRAVY)大于0,推測為疏水性蛋白(4A);無跨膜結構域(4B),且該蛋白前17個氨基酸為信號肽序列(4C);其三維結構模型(4D)的全球性模型質量估測值(GMQE值)為0.88,表明其建模質量良好。
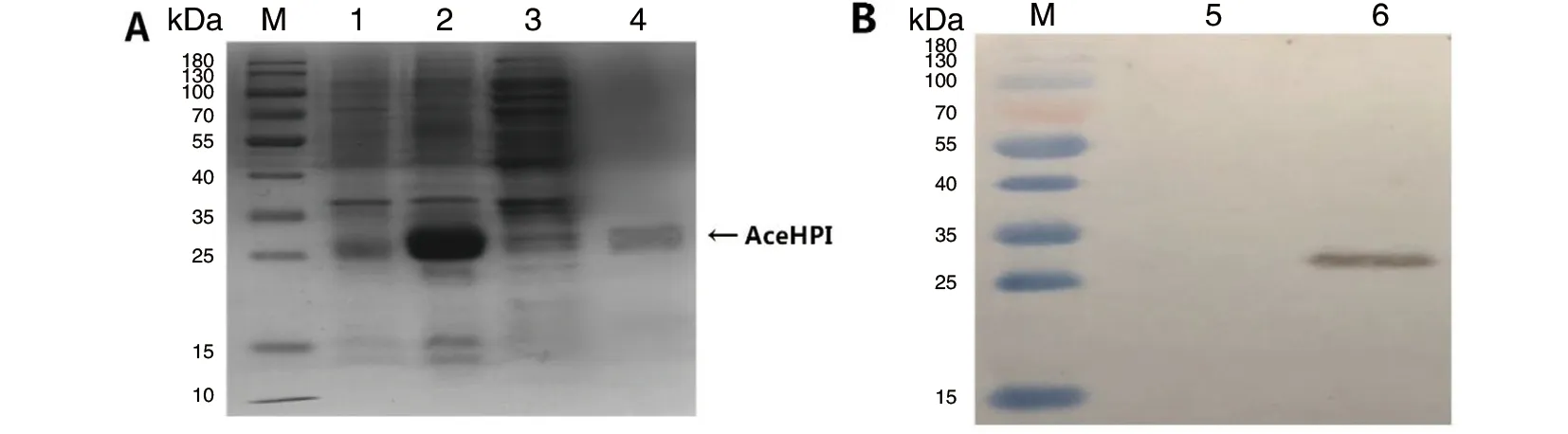
M: protein molecular weight marker; 1: product from induced pET28a-AceHPI; 2: precipitate of bacteria lysate;3: supernatant of bacteria lysate; 4: purified recombinant protein; 5: blank control; 6: recombinant proteins from pET-28a-AceHPI identified with the anti-His monoclonal antibody.圖2 重組蛋白AceHPI的SDS-PAGE(A)和Western-blot(B)分析Fig.2 SDS-PAGE (A) and Western-blot (B)analysis of the expression product of pET28a-AceHPI

圖3 AceHPI氨基酸序列的同源性比對Fig.3 Homology alignment of the amino acid sequence of AceHPI
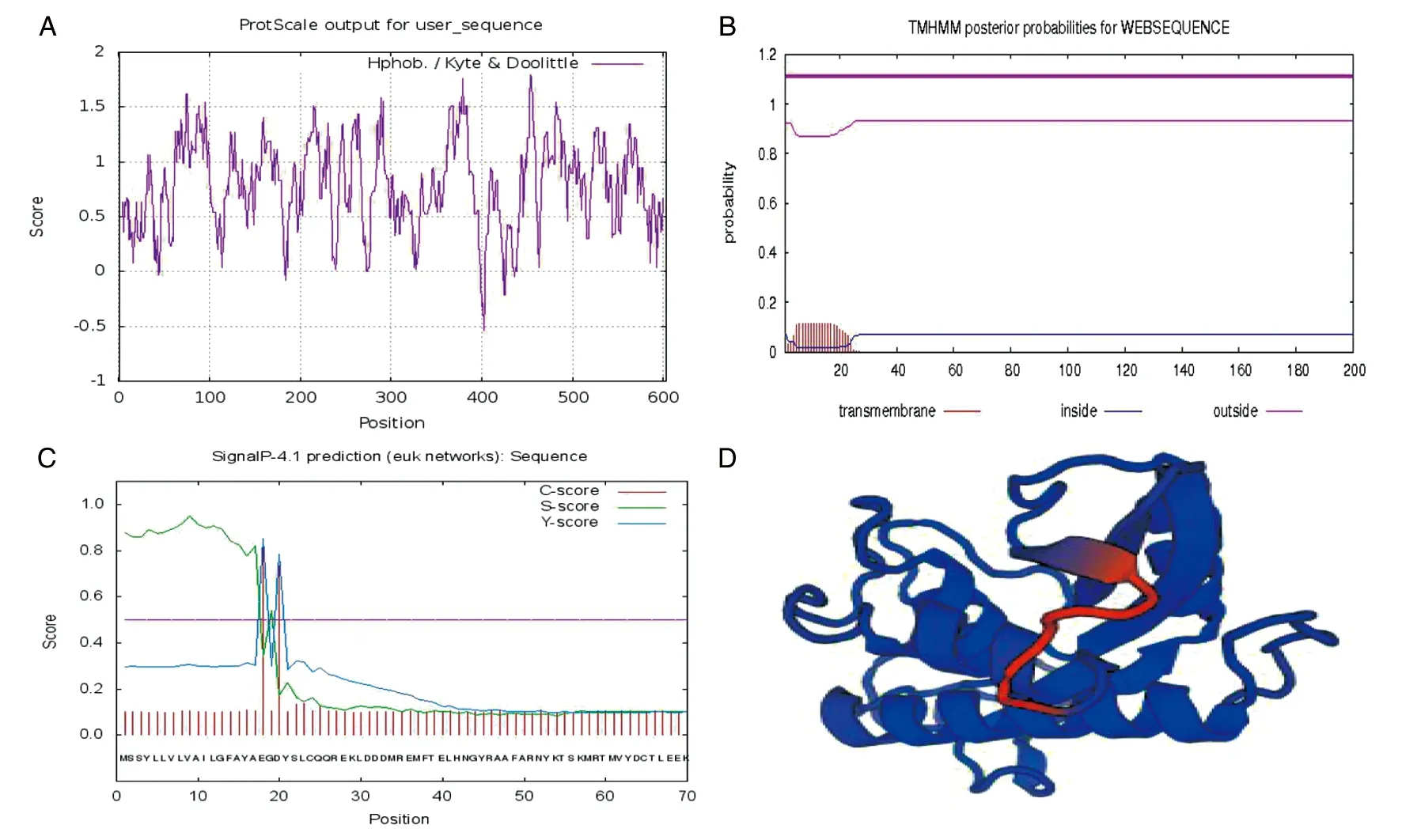
A: hydrophilicity analysis of AceHPI; B: prediction of transmembrane helices in AceHPI; C: signal peptide analysis of AceHPI; D: prediction of tertiary structure of AceHPI.圖4 AceHPI蛋白的生物信息學分析Fig.4 Bioinformatics analysis of AceHPI protein
3 討 論
鉤蟲病是一種以貧血為主的慢性消耗性疾病,對人類和伴侶動物(如犬、貓)的健康具有潛在威脅。錫蘭鉤蟲是唯一一種可以在人體內發育為成蟲且可導致人重度感染的動物源性鉤蟲。由于它可以感染金黃倉鼠,常作為鉤蟲病研究的動物模型。鉤蟲血小板抑制劑的研究始于犬鉤蟲和美洲鉤蟲,最早發現其成蟲的可溶性蛋白提取物和分泌排泄產物具有抑制二磷酸腺苷與纖維蛋白原誘導血小板聚集的功能[7-9],后續研究表明該抑制劑可以阻斷GPIIb/IIIA和GPIA/IIA受體與各自配體的結合從而抑制血小板聚集[10-11]。據此Valle等[6]采用RP-HPLC技術從犬鉤蟲成蟲體內分離出具有上述阻斷功能的兩種鉤蟲血小板抑制劑,并用RACE-PCR技術首次擴增出AcaHPI。分析AcaHPI蛋白結構后,發現其具有不完全保守的CAP1至CAP 4序列,被認為是CAP超家族成員[12],具有作為鉤蟲疫苗候選分子的潛力。
本研究首次報道了錫蘭鉤蟲AceHPI基因的原核表達。由于該蛋白序列N端存在真核生物的信號肽序列,因而在E.coliBL21(DE3)菌株中表達量很低。為了提高該蛋白的表達量,隨后設計了一對去除信號肽序列的引物,避免了真核生物蛋白在原核表達時產生的不兼容性。由于HPI蛋白為疏水性蛋白,前人對犬鉤蟲血小板抑制劑的研究一直未能采用原核表達系統對該蛋白進行可溶性表達。雖然Ma等[12]對其原核表達的融合蛋白包涵體進行了復性,但復性后的蛋白并不能保證其正確折疊且具有生物學活性。為了獲得可溶性AceHPI融合蛋白,本研究嘗試在低溫、低IPTG濃度和低轉速下誘導表達,結果在28 ℃、0.1 mmol/L濃度的IPTG和165 r/min的轉速下,可溶性融合蛋白的表達量明顯增加。本研究發現錫蘭鉤蟲AceHPI與犬鉤蟲AcaHPI的同源性為91%。利用相關軟件對其蛋白的親/疏水性、跨膜結構域、信號肽序列和二級結構進行了分析并繪制其三維結構模型,表明其為疏水蛋白,無跨膜結構域,具有信號肽序列且位于前17個氨基酸,這些信息將有助于進一步研究該蛋白的結構特性。
本研究成功克隆了錫蘭鉤蟲AceHPI基因,構建了其重組表達質粒并進行了原核表達,對其編碼的氨基酸序列進行了生物信息學分析。上述研究為深入探究錫蘭鉤蟲HPI在感染宿主體內的作用機制奠定了基礎。
利益沖突:無

