真菌漆酶的性質、生產、純化及固定化研究進展
吳怡 馬鴻飛 曹永佳 司靜 崔寶凱
(北京林業大學生態與自然保護學院,北京 100083)
近年來,酶在工業應用中占據了極其重要的位置,漆酶就是其中之一。漆酶(Laccase,EC1.10.3.2)是多酚氧化酶中一種含銅的糖蛋白氧化酶,與植物抗壞血酸氧化酶和哺乳動物血漿銅藍蛋白同屬藍色多銅氧化酶家族,是研究最早最多的酶系統之一[1]。1883年,日本學者吉田首次在日本紫膠漆樹(Rhus verniciflua)漆液中發現了一種可以使汁液氧化變硬、催化漆固化過程的蛋白質[2],1894年Bertrand等[3]將這種蛋白質命名為漆酶。
漆酶按其來源可分為植物漆酶、動物漆酶和微生物漆酶3類。目前,已發現漆樹、木蠟樹、羅漢松、巴勒斯坦黃連木、七葉樹及連翹等樹種中均有漆酶存在,在水稻、棉花、茶、煙草等農作物,芒果、香蕉、葡萄等水果中也發現了漆酶[4]。不同來源的漆酶,其性質存在顯著差異。即使同屬漆樹漆酶,產于中國、日本的漆樹(Rhus vernicifera)酶和產于越南的漆樹(Rhus succedanea)酶在生物學性質上也有很大差別。一直以來,關于動物漆酶的研究都相對較少,僅在麻蠅、煙草天蛾、綠頭蒼蠅、蚊子和蝗蟲等昆蟲中發現有微量的漆酶活性[5-6]。有學者猜測,動物中的漆酶可能并不是準確意義上的漆酶,而是某些具有類似催化性能的多酚氧化酶,因此還需進一步研究確定[7]。
微生物漆酶在自然界中分布最為廣泛,在大量落葉覆蓋的林區土壤中、造紙廠的木質纖維廢水及水稻等作物的根部均有發現,按其來源可分為真菌漆酶和細菌漆酶[8-16]。其中真菌漆酶是自然界中漆酶的主要來源,具有單電子氧化還原電位高、催化活性強等特性,同時,真菌漆酶不僅能催化底物的氧化聚合反應還能對木質素進行氧化轉化,具有十分廣闊的應用前景和非常重要的研究價值。目前,該類漆酶的研究涉及到60多種真菌,主要以擔子菌和子囊菌為主,其中擔子菌中的白腐真菌是唯一能夠利用自身氧化酶系統將木質纖維素轉化為二氧化碳的一類真菌[17],被認為是主要的真菌漆酶生產者和研究對象。
漆酶能夠利用分子氧為電子受體催化氧化6大類250余種底物,包括酚及其衍生物、羧酸及其衍生物、芳胺及其衍生物、金屬化合物和其他非酚類底物等[18-19]。在過去的幾十年中,由于其良好的催化氧化能力及對復雜環境污染物的降解能力而受到了研究者的極大關注,使得漆酶被廣泛應用于紙漿漂白、環境治理、生物檢測、食品加工、有機合成以及生物能源等多個領域[20-24]。本文對近年來真菌漆酶的生物學性質、生產、純化及固定化等方面的最新研究進展進行概述,以期為該領域的研究提供參考。
1 真菌漆酶的生物學性質
1.1 結構特征
漆酶結構中最重要的部分就是銅原子,其參與漆酶活性中心的架構和組成,結合底物并直接參與鍵的斷裂與形成,決定漆酶的活力和特異性,使漆酶具有氧化還原功能。典型的漆酶有4個銅原子及3個銅原子結合位點,根據磁學和光譜學性質不同可將4個銅原子分為3類[25]。T1銅原子相對獨立,與兩個組氨酸(His)的N和一個半胱氨酸(Cys)的S配位,形成扭曲的四面體結構。其中共價鍵Cu-S(Cys)的配位是還原態底物的結合位點,漆酶在此附近接受來自底物的電子轉移,進而將底物徹底氧化,使得T1銅原子在614 nm(ε = 5 300 M-1cm-1)處產生強烈的藍色特征吸收帶[26],因此也稱漆酶為銅藍蛋白。T2銅原子無特殊吸收峰,具有電子順磁共振效應(Electron paramagnetic resonance,EPR)性質,其與T3銅原子緊密相連形成一個三核中心,是漆酶的催化活性中心。該三核中心與8個His配位結合,其中T2銅原子結合2個His,T3銅原子結合6個His。T3銅原子由兩個銅原子組成,由于其偶聯作用導致T3銅原子的EPR性質消失,但在330 nm處有寬的吸收峰[27]。同時,由于一些反應中間體如過氧中間體的吸收,導致T3銅原子在400/420-460 nm之間也存在一些小的吸收帶[28]。圖1顯示了漆酶具體的活性中心結構。
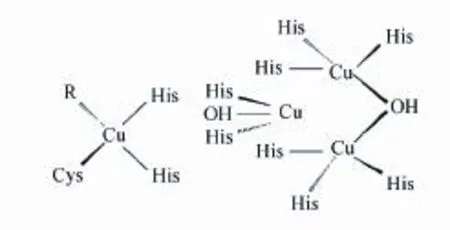
圖1 漆酶的活性中心結構[29]
1.2 催化作用
漆酶作為一種氧化酶,其作用底物十分廣泛,能催化氧化木質素、酚類化合物、非酚類化合物等多種物質。簡單而言,漆酶的催化氧化作用機理主要表現在底物自由基中間體的產生和分子氧還原成水兩個方面[29]。首先,反應底物與處于酶活性中心的T1銅原子位點相結合,T1銅原子接受來自還原態底物的電子轉移,同時該底物被氧化形成自由基;其次,T1銅原子將單個電子通過Cys-His途徑傳遞到由T2和T3銅原子構成的三核中心上,分子氧在此處接受電子,被還原成水。
由于漆酶的分子量較大,很難進入細胞間隙,且氧化還原電勢大多在0.5-0.8 V之間,而非酚型芳香族化合物的氧化還原電勢在1.5 V左右,這使得漆酶不能夠直接氧化非酚型芳香族化合物[30]。介體是能夠被漆酶高效氧化的低分子量有機化合物,它能夠進入細胞間隙,通過氧化作用形成的中間產物而高效氧化該介體介導的底物,且氧化態產物不對漆酶起抑制作用,還可以被二級底物還原,實現反復利用。漆酶對非酚型芳香族化合物的催化氧化大多是依靠介體完成的,因此,尋找天然、有效、廉價的介體是目前漆酶應用的一個研究熱點。
1.3 理化性質
1.3.1 溫度 真菌漆酶是一種適宜在溫和環境條件下發揮作用的氧化酶。其反應的最適溫度范圍較窄,通常在25-50℃之間。過高或過低的溫度都會抑制漆酶活性,尤其是高溫,對漆酶活力的破壞比較嚴重。但不同來源的漆酶反應最適溫度也存在顯著差異。據報道,從廣州地區分離的木霉(Trichoderma)中得到的漆酶具有耐高溫特性,這可能是由于其所處的地理環境所致,其最適反應溫度為65℃,在70℃保溫60 min后殘余酶活保留60%以上[31]。漆酶的重組也可能使其最適溫度發生變化,葛飛等[32]通過響應面法測得刺芹側耳(Pleurotus eryngii)所產漆酶的最適溫度為27.6℃,而夏文靜等[33]對P.eryngii漆酶進行了重組,發現該重組酶在20-60℃范圍內隨溫度增加漆酶的活性不斷升高,最適溫度為60℃。
1.3.2 pH 真菌漆酶的最適反應pH通常為3.5-6.0[34],如云芝栓孔菌(Trametes versicolor)所產漆酶的最適 pH 為 3.8[35],多孔菌(Polyporus)為 4.2[36],硬毛粗蓋孔菌(Funalia trogii)為 6.0[37]。在漆酶的生產過程中,最適pH的確定不僅要保證漆酶的高活性,還要考慮漆酶的穩定性,如白腐真菌糙皮側耳(Pleurotus ostreatus)所產漆酶在pH為3.0的高酸性環境下活性較強,但漆酶穩定性保持效果較差,而pH呈中性至堿性時,漆酶穩定性較強但活性非常低,綜合考慮,該漆酶最佳反應pH為5.0[38]。此外,研究發現通過改變漆酶的pH可以使其作用發生變化,張楠等[39]發現漆酶對玉米秸稈木質素同時兼具解聚和聚合作用,pH較高時綜合表現為解聚作用,pH較低時則表現為聚合作用。
1.3.3 金屬離子 多種金屬離子如K+、Ag+、Cu2+、Mg2+、Ca2+、Zn2+、Pb2+、Pd2+、Hg2+、Co2+、Ba2+、Fe2+和Fe3+等對漆酶活性也可產生重要的影響。一般而言,一定濃度的Cu2+會促進漆酶活性的增加。Zhuo等[40]研究了幾種金屬離子對P. ostreatusHAUCC 162漆酶活性的影響,10 d后發現Cu2+、Fe2+、Mn2+、Cd2+均使胞外漆酶活性有所增加,其中Cu2+效果最為顯著。也有一些金屬離子對漆酶活性產生抑制作用。研究發現,Co2+、Ni2+、Cd2+、Fe3+、Ag+等對漆酶活性的抑制作用很強,其原因可能是反應過程中,這些金屬離子占據了漆酶的活性中心,改變了漆酶的結構,使底物不能與漆酶相結合,從而抑制了酶活[41]。也有報道稱,Co2+、Mn2+、Ca2+、Fe2+和Hg2+會使雙孢蘑菇(Agaricus bisporus)漆酶活性下降,其中Hg2+對其酶活顯示出了較強的抑制作用[42]。此外,部分金屬離子對漆酶降解染料的能力會產生促進作用,Cu2+和Cr6+使從白腐真菌歐洲靈芝(Ganoderma lucidum)中獲得的漆酶對濃度為50.0 mg/L的兩種染料雷瑪唑黑5(Remazol Black 5,RB5)和雷瑪唑亮藍R(Remazol brilliant blue R,RBBR)的脫色效果顯著增強,其中1.0 mmol/L Cu2+的添加使漆酶在1 h內對RB5和RBBR的脫色率分別達到94% 和 35.5%[43]。
2 真菌漆酶的生產
2.1 漆酶高產菌株的篩選
真菌漆酶在紙漿漂白、環境治理、生物檢測、食品加工、有機合成以及生物能源等多個工業領域具有較高的應用價值及潛力[44-51],但不同真菌產漆酶的能力不同,因此,篩選高產漆酶的真菌菌株就顯得尤其重要,這將為漆酶高產菌株的選育和工業等領域的進一步應用奠定基礎[52]。目前,高產漆酶的真菌菌株主要集中于小薄孔菌屬(Antrodiella)、黑木耳(Auricularia heimuer)、毛木耳(Auricularia polytricha)、黑管孔菌屬(Bjerkandera)、蠟孔菌屬(Ceriporia)、擬蠟孔菌屬(Ceriporiopsis)、齒毛菌屬(Cerrena)、金針菇(Flammulina velutipes)、木蹄層孔菌(Fomes fomentarius)、粗蓋孔菌屬(Funalia)、靈 芝 屬(Ganoderma)、 深 褐 褶 菌(Gloeophyllum sepiarium)、灰樹花孔菌(Grifola frondosa)、猴頭菌屬(Hericium)、纖孔菌屬(Inonotus)、囊耙齒菌屬(Irpex)、榮氏孔菌屬(Junghuhnia)、香菇(Lentinus edodes)、巨孔菌屬(Megasporia)、銳孔菌屬(Oxyporus)、多年臥孔菌屬(Perenniporia)、木層孔菌屬(Phellinus)、側耳屬(Pleurotus)、Polyporus、鮮紅密孔菌(Pycnoporus cinnabarinus)、血紅密孔菌(Pycnoporus sanguineus)、硬孔菌屬(Rigidoporus)、桑黃屬(Sanghuangporus)、裂褶菌(Schizophyllum commune)和栓孔菌屬(Trametes)等[34,53-54]。真菌漆酶的篩選主要是通過愈創木酚平板法初篩和液體發酵復篩。其中,愈創木酚能夠被漆酶氧化產生茶褐色物質,進而利用氧化變色圈與菌絲直徑的比值初步判斷是否有漆酶產生[55]。劉家揚等[56]在干枯的木頭中通過愈創木酚PDA平板法初篩得到6株產漆酶活力較高的菌株。除愈創木酚法外,陳瓊華等[57]還通過α-萘酚的PDA平板法對43株大型真菌進行篩選,通過12 d對菌株生長狀況的觀察及菌絲圈與紫色氧化圈直徑的測量,篩選出21株氧化圈直徑與菌絲圈直徑比值較大的菌株,具有較高的漆酶活性。
液體發酵復篩法通常是對菌株進行液體搖瓶培養后,用紫外分光光度計檢測420 nm波長處吸光度的變化。王玉俊等[58]用液體發酵復篩的方法對P.cinnabarinus、F. fomentarius、一色齒毛菌(Cerrena unicolor)、輪紋韌革菌(Stereum ostrea)和寬鱗多孔菌(Polyporus squamosus)5種白腐真菌的產漆酶能力進行篩選,發現P. cinnabarinus所產漆酶活性最高。
2.2 培養條件
培養條件的選擇是真菌發酵生產漆酶的關鍵一環,可以通過單因子和正交實驗或響應面設計的方法確定真菌產漆酶的最佳培養基及條件,主要涉及到碳源、氮源、溫度、pH、轉速等因素[59]。一般來說,真菌生產漆酶的最適溫度為25-35℃,轉速為140-200 r/min,偏酸性條件會促進真菌的發酵,在氮源相對較少時形成的“氮饑餓”狀態會使漆酶的產量增加。王書超等[60]以樹舌靈芝(Ganoderma applanatum)為實驗材料,通過單因素實驗和Plackett-Burman設計對漆酶的生產條件進行了優化,發現由20 g/L玉米粉和5 g/L豆粕組成、pH為5.5的培養基中,28℃搖瓶培養7 d時漆酶活性最高。鄭飛等[61]將白腐真菌東方栓孔菌(Trametes orientalis)接種在兩種營養條件不同的液體培養基中,發現該菌在缺營養條件下對部分次級代謝產物的分泌能力較強,且具有較好的適應能力,而在復雜的培養基中生產漆酶水平較高。
此外,發酵罐法通過旋轉攪拌增加了氧氣含量,使培養基得到充足的養分,通氣效果較好,解決了搖瓶培養中菌液不均勻等問題,受到了研究者的極大關注[62]。近年來,對發酵罐生產漆酶的研究越來越多,其中包括黃孢原毛平革菌(Phanerochaete chrysosporium)、韋伯靈芝(Ganoderma weberianum)、疣孢漆斑菌(Myrothecium verrucaria)等。陳瓊華等[63]將G. weberianum漆酶置于50 L發酵罐中進行發酵,實驗結果顯示,漆酶活性達到27 667.7 U/L,是搖瓶發酵水平的2.5倍。然而,發酵罐法使用成本較高,對于實驗是否需要發酵罐及對發酵罐大小的選擇要綜合考慮,對于發酵罐未來是否會達到普遍使用的狀態還有待觀察。
2.3 漆酶的誘導生產
在真菌培養過程中適當添加誘導劑可以大大提高漆酶的產量和活性。誘導劑的種類多樣,可以分為化學誘導劑、生物誘導劑和物理誘導劑等。化學誘導劑主要是愈創木酚、金屬離子、芳香族化合物、酚類化合物等,其中銅和阿魏酸是G. lucidum產漆酶最好的誘導劑[64],金屬離子(Fe2+、Cu2+)與芳香族化合物(香草酸、肉桂酸和阿魏酸)的協同刺激使P. ostreatus產漆酶的能力進一步提升[40]。同一類誘導劑的復合誘導作用通常比使用單一誘導劑效果要好,不同類誘導劑間的協同作用也會是提高漆酶產量和活性的有效誘導方法[65]。目前研究的生物誘導劑主要包括木屑、玉米芯、棉籽殼、麥麩、麥稈等。安琪等[66]在富含簡單碳/氮源的培養基中添加堿性木質素作為生物誘導劑,使P. ostreatus的菌絲生物量和漆酶活性均有顯著提高。Couto等[67]在對半固態條件下T. versicolor產漆酶能力的研究中發現,二甲苯胺是最好的誘導劑,可以使漆酶活性達到1 700 U/L,但是在以大麥麩為基質的情況下,能夠使T. versicolor所產的漆酶活性進一步提高,達到2 000 U/L。與生物和化學誘導方法相比,物理誘導并不常見,主要是通過紫外處理、超高壓處理、輻射處理等方式。研究發現,使用紫外誘導的方法處理G. lucidum,所產漆酶活力是未處理菌株的2.83倍,發酵時間也縮短了1 d[68]。
3 真菌漆酶的純化
漆酶是一種酶蛋白,常常與其它物質復雜地混合在一起,在實際的工業流程中,對漆酶適應極端環境的要求極高,因此開發和研究具有特殊性質的酶蛋白,對于工業化發展尤為重要[69]。而工業生產過程中往往需要更加耐高溫和耐酸堿性的抗性酶,為評估漆酶在工業應用中的適合度,需要對其理化性質、作用機理和生物學功能進行深入地研究和測定,因此,漆酶的分離純化和性質分析已經成為漆酶研究的重點[70]。據報道,胞外酶是真菌漆酶的主要種類,與胞內酶相比,其提取分離純化的過程更加簡單容易,且穩定性也較好,可適于多種工業應用[34]。截至目前,全世界被純化和分析性質的真菌漆酶已經有上百種[71]。
漆酶的分離純化方法有透析、超濾、電泳、等電點沉淀、鹽析、離子交換柱層析、親和層析和疏水層析等,通常需要采用幾種方法相結合才能將漆酶從復雜的體系中分離出來。Ramírez-Cavazos等[70]對P. sanguineusCS43的兩種熱穩定性漆酶通過超濾、離子交換柱層析和疏水作用層析進行純化,得到其比活力近285 U/mg。他們還發現這兩種漆酶在50℃和60℃都顯示出很高的氨基酸序列相似性(91%)和熱穩定性。性質分析主要是研究其催化系數、最適pH、熱穩定性、光譜性質、分子量、底物特異性等,并探索金屬離子、螯合劑和無機化合物等對漆酶活性和穩定性的影響。菌株來源不同的漆酶,其穩定性、最適pH、最適溫度、分子量、作用底物及動力學特征等都不盡相同[72],使用不同的純化方法,漆酶的比活力和回收率也不盡相同。Manavalan等[73]用交聯葡聚糖G-100和DEAE-纖維素柱層析純化G.lucidum漆酶,獲得的漆酶分子量為38.3 kD,活性回收率為32%,以2,2'-連氮-雙(3-乙基苯并噻唑-6-磺酸)(2,2'-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)為底物、pH 5.0、溫度為55℃時,漆酶活性最高。而Wang等[74]以白腐真菌C. unicolorGSM-01中獲得的具有較強染料脫色能力的漆酶為材料,通過3個離子交換柱層析和一個凝膠過濾層析進行純化,得到的漆酶是一種單體蛋白,分子量為63.2 kD,活性回收率為33.9%,最適pH和溫度分別為2.6和45℃。此外,還發現Fe3+和Fe2+是C. unicolorGSM-01漆酶最有效的抑制劑,Mn2+可低幅度提高3.8%-10.5%漆酶活性。Zheng等[75]從T.orientalis中發現了一種新型漆酶,并對其通過硫酸銨分級沉淀、DEAE-cellulose DE52陰離子交換柱層析和Sephrose CL-6B瓊脂糖凝膠柱層析進行純化,發現得到的漆酶是一種單體蛋白質,分子量為44.0 kD,回收率為47.33%,最佳pH和溫度分別為4.0和80℃,Mn2+對提高漆酶活性有較好的效果。
近年來,漆酶的純化方法更新變化不大,在今后的研究中,應當注重探索和開發純化效率更高、操作更加簡單易行的新型純化方法,為漆酶性質的研究及進一步工業化應用提供技術支持。
4 真菌漆酶的固定化
漆酶是一類具有生物催化功能的蛋白質,其能夠在溫和條件下高效地催化生物反應,對作用底物的選擇具有專一性,且反應后酶自身的數量和性質不發生改變,具有無污染、環境友好等特點,符合當今工業化生產的環保要求[76]。但游離的漆酶穩定性差,在環境中易受溫度、pH、酸堿性等因素的影響,且不易分離提純進行重復性使用,這在一定程度上限制了漆酶的工業化應用。
1966年,Tosa等[77]通過固定化處理使氨基酰化酶在工業上實現了連續化生產,提高了酶的利用率,從此,酶的固定化研究激發了學者們的廣泛興趣。固定化酶是指利用物理或化學手段將酶固定在載體上或者束縛在一定范圍內、同時保持了催化活性、并能連續反應和反復使用的酶制劑[78]。將固定化技術應用于漆酶,使其易從反應體系中分離出來,實現了重復利用,同時可以簡化產物的提純工藝,增強游離漆酶的化學穩定性及對周圍環境的適應能力,且保持了最初的催化特性和催化效率,大大提升了對酶反應過程的操控范圍,為漆酶的產業化發展和進一步應用開拓了更廣闊的前景[79-88]。
目前,漆酶固定化的方法已經相對成熟,常用的固定化方法可分為物理法和化學法,物理法包括吸附法和包埋法等,化學法包括共價法和交聯法等。固定化載體的選擇范圍相對較廣,研究人員也在不斷探索和發現新的固定化載體并將其應用到漆酶的固定化中[89-91],載體的選擇是漆酶能否實現固定化及固定化效果好壞的關鍵,表1總結了幾種載體的優勢、固定化方法、固定化效果及應用。
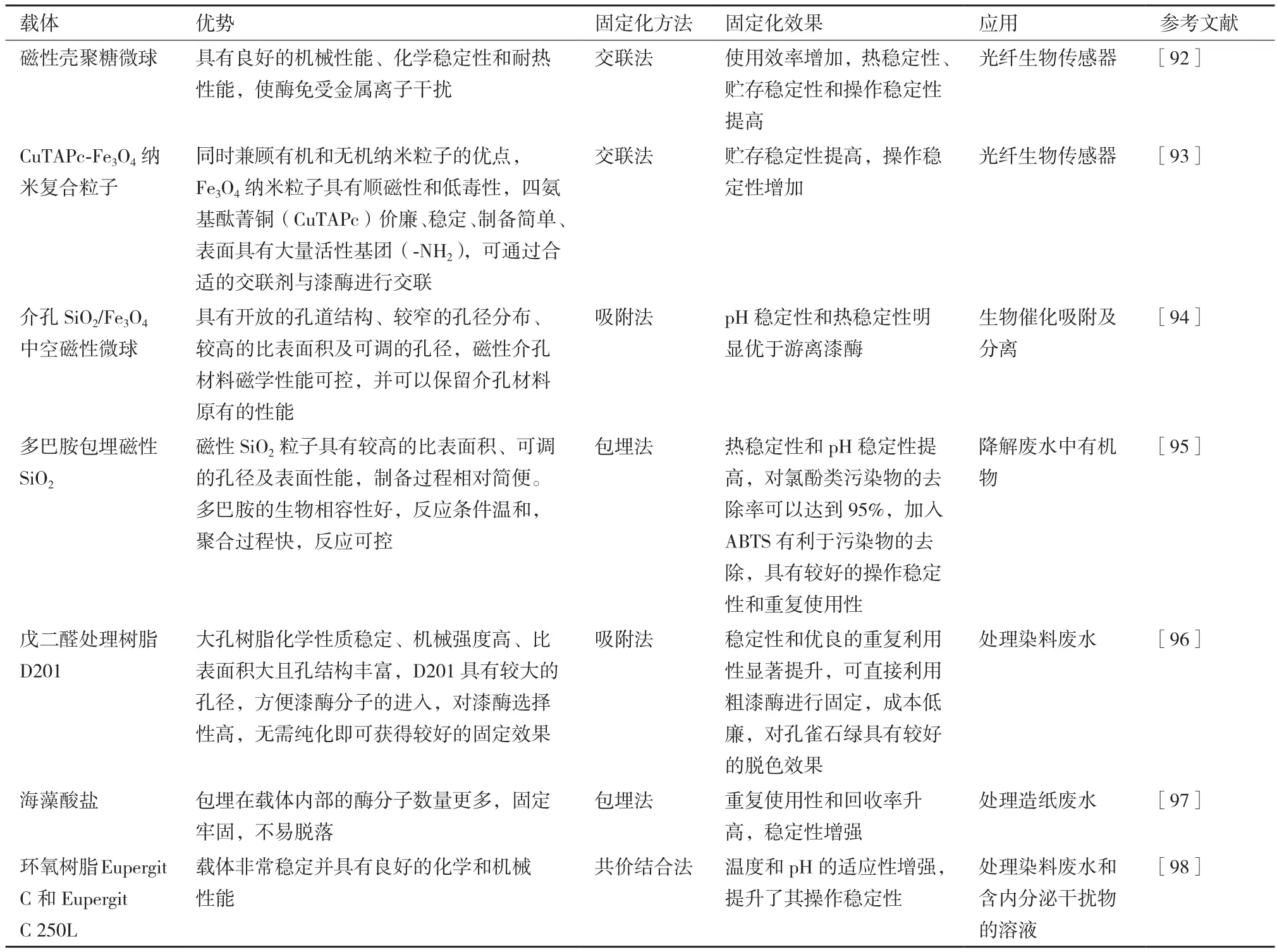
表1 幾種固定化載體的比較
近年來,有關磁性載體的研究越來越多,其能夠顯著提升漆酶的熱穩定性、pH穩定性和貯存穩定性,同時也增加了酶的回收率和可操作性[99],但使用磁性載體固定的漆酶活性并不十分穩定。因此,開發優良、穩定的漆酶固定化載體將成為今后研究的熱點方向。除載體的選擇外,合適的固定化方法也是決定漆酶固定化效果的關鍵,適合的固定化方法結合高效、穩定的載體將會使漆酶的使用效率顯著提升。然而,很多關于固定化漆酶的研究目前仍處于實驗室階段,投入到工業大規模生產的案例少之又少,還需進一步研究。
5 小結
漆酶是一種含銅的多酚氧化酶,廣泛存在于各種真菌、植物和細菌中,真菌漆酶的研究最多也最深入。為提高真菌漆酶活性,進行了大量生物學特性及優化生產條件的相關研究,并取得了一些進展。漆酶的生產是工業化應用的基礎,發掘性質優良的漆酶并提高其活性,將是今后不斷研究的重點。
漆酶本質上是一種環保型酵素,具有獨特的降解機理,對性質優良的漆酶進行純化和固定化,提高其穩定性和使用效率,實現多次重復利用,是目前研究的熱點方向。尋找適合的純化及固定化方法、穩定及機械性能優異的酶固定化載體將是漆酶今后實現大規模工業化應用的關鍵。

