薄膜過濾法在中藥常山散微生物限度檢查中的應用研究
王 玲,郭志廷,楊 峰,魏小娟,李宏勝,周緒正,劉龍海
(中國農業科學院蘭州畜牧與獸藥研究所 農業部獸用藥物創制重點實驗室,甘肅 蘭州730050)
中藥常山(Dichroa febrifuga Lour.)為目前國內常用的抗球蟲中藥材,可單獨使用或以復方制劑的主藥用于抗球蟲治療藥物[1]。常山散口服制劑是通過現代中藥分離技術,提取常山生藥根中的有效活性成分常山總生物堿制得,可用于防控雞球蟲病。口服制劑中微生物污染狀況的控制是藥品質量控制的重要指標,而中藥口服制劑因藥材來源及生產工藝的特殊性,尤其易受到微生物的污染。薄膜過濾法是對細菌微生物量測試的有效方法,同時也是微生物限度檢驗中的方法之一[2],該法在無菌檢查中可以快速集菌,在藥品微生物限度檢查中可以去除藥品中某些成分的抑菌作用。同時,也可作為制藥微生物回收和醫藥制劑中微生物驗證的一種試驗驗證方法,所以薄膜過濾法在藥品檢驗中的應用越來越被重視。為保證檢驗結果的真實性、有效性,在進行常山散的微生物限度檢查時需先考慮去除藥物有可能存在的的抑菌活性,以使回收率達到要求。故應從供試液的制備、取樣量、沖洗液的體積、濾膜的選用等方面進行考察,采用適當的方法消除口服散劑中有可能存在的抑菌活性,再對常山散進行微生物限度的檢查。因目前尚未見有關中藥常山散微生物限度檢查方法的報道,本試驗參照2010 版《中國獸藥典》微生物限度檢查法,對常山散進行細菌、真菌及酵母計數方法及加菌回收率的建立和驗證,對中藥提取物常山散的質量控制、研發和申報抗球蟲新獸藥有著積極的現實意義。
1 材料與方法
1.1 供試藥品 常山散(批號:20150725、20150812、20150822,河北正道生物科技有限公司生產)。供試液的制備:取常山散10 g,加pH 值7.0無菌氯化鈉-蛋白胨緩沖液稀釋至100 mL,混勻,作為1∶10 的供試液。
1.2 培養基和緩沖液 營養瓊脂培養基、營養肉湯培養基、改良馬丁培養基、改良馬丁瓊脂培養基、硫乙醇酸鹽流體培養基、麥康凱瓊脂培養基、哥倫比亞瓊脂培養基,以上培養基由廣東環凱微生物科技有限公司提供。膽鹽乳糖培養基、膽鹽硫乳瓊脂培養基、曙紅亞甲藍瓊脂培養基、乳糖膽鹽發酵培養基、四硫磺酸鈉亮綠培養基、溴化十六烷基三甲胺瓊脂培養基、綠膿菌素測定用培養基、亞碲酸鹽肉湯培養基、卵黃氯化鈉瓊脂培養基、梭菌增菌培養基、沙氏葡萄糖液體培養基、沙氏葡萄糖瓊脂培養基、4-甲基傘形酮葡糖苷酸(MUG)培養基、念珠菌顯色培養基,上述培養基由青島高科園海博生物技術有限公司提供。pH 值7.0 無菌氯化鈉-蛋白胨緩沖液、pH 值7.2 無菌磷酸鹽緩沖液、無菌生理鹽水,參照《中國獸藥典》2010 版無菌檢查法配制。所用試劑均為分析純。
1.3 試驗儀器 生物安全柜(上海力申科學儀器有限公司,型號HPsafe-1200LC),隔水式培養箱(上海一恒科學儀器有限公司,型號GHP-9160),全溫振蕩培養箱(上海精宏實驗設備有限公司,HZP-250);電熱鼓風干燥箱(上海一恒科學儀器有限公司,型號DHG-9240A);立式超低溫保存箱(青島海爾特種電器有限公司,型號DW-86L338);漩渦混合(美國SCILOGEX,MX-S);立式壓力蒸汽滅菌器(上海申安醫療器械廠,型號LDZX-30KBS);AP-01P 真空泵(天津奧特賽恩斯儀器有限公司);薄膜過濾器(杭州泰林生物技術設備有限公司,孔徑0.45 μm,直徑50 mm)。
1.4 菌液制備、計數及菌液稀釋度的確定 細菌、真菌和酵母計數及回收率測定,選用菌株為金黃色葡萄球菌[CMCC(B)26003]、大腸埃希菌[CMCC(B)44102]、枯草芽孢桿菌[CMCC(B)63501]、白色念珠菌[CMCC(F)98001]、黑曲霉(Aspergillus niger)[CMCC(F)98003]。另生孢梭菌(Clostridium sporogenes)[CMCC(B)64941]、乙型副傷寒沙門菌(B)[CMCC(B)50094]、銅綠假單胞菌[CMCC(B)10104],用于方法驗證試驗、控制菌的檢查及供試品的無菌檢查。均購自中國普通微生物菌種保藏管理中心,具有ATCC 官方授權。菌種要求不得超過5 代。
1.4.1 細菌組菌液 將金黃色葡萄球菌、大腸埃希菌、銅綠假單胞菌、乙型副傷寒沙門菌、枯草芽孢桿菌的新鮮培養物接種至5 mL 營養肉湯中,在35 ℃~37 ℃下培養18~24 h,制得菌液。取上述菌液用0.9%無菌氯化鈉溶液依次10 倍稀釋至10-4~10-7稀釋度,每個稀釋度各吸取200 μL 菌液對號接種至不同稀釋度編號的營養瓊脂平板上(10-5~10-7稀釋度各設2 個重復),將菌液在平板上涂布均勻,在35 ℃-37℃下倒置培養18~24 h,計數,以確定菌懸液濃度約為50~100 CFU/mL 的最佳稀釋度。
1.4.2 真菌組菌液 將白色念珠菌的新鮮培養物接種至改良馬丁液體培養基中,在27 ℃下培養24~28 h,制得菌液。取上述菌液用0.9%無菌氯化鈉溶液依次10 倍稀釋至10-4~10-6稀釋度,分別吸取各稀釋度菌液200 μL 接種至玫瑰紅鈉瓊脂培養基平板或改良馬丁瓊脂培養基平板上,每個稀釋度2個重復,將菌液在平板上涂布均勻,27 ℃下倒置培養48~72 h,計數,確定菌懸液濃度約為50~100 CFU/mL 的最佳稀釋度。
將黑曲霉的新鮮培養物接種至改良馬丁瓊脂斜面培養基上,在27 ℃下培養5 d 左右,用無菌棉簽、0.9%無菌氯化鈉溶液(含0.05%聚山梨酯80)將孢子洗脫。吸出孢子懸液至無菌試管內,用0.9%無菌氯化鈉溶液將孢子懸液依次10 倍稀釋至10-3~10-5稀釋度,分別吸取各稀釋度孢子懸液200 μL 接種至玫瑰紅鈉瓊脂培養基平板上,每個稀釋度2 個重復,將孢子懸液在平板上涂布均勻,27 ℃下培養3~5 d,計數,確定孢子懸液濃度約為50~100 CFU/mL 的稀釋度。
1.4.3 取各菌液培養物按10 倍稀釋法,用0.9%無菌生理鹽水溶液制成含菌<100 CFU/ mL 的供試菌液。菌液制備后保存在2 ℃~8 ℃,應在24 h內使用。黑曲霉孢子懸液可保存在2 ℃~8 ℃,在驗證過的貯存期內使用。
1.5 方法驗證試驗 按照《中國獸藥典》2010 年版有關微生物限度檢查法驗證進行,驗證試驗至少應進行3 次獨立的平行實驗,驗證采用薄膜過濾法進行[3]。
1.6 菌落計數及回收率測定(薄膜過濾法)[5-9]試驗組 采用濾膜孔徑0.45 μm、直徑50 mm 的親水混合纖維素膜酯濾膜。取1∶10 供試液10 mL(相當于含供試品1 g)加至100 mL 稀釋液中,混勻,過濾,并用pH 值7.2 無菌磷酸鹽緩沖液分3 次進行過濾、沖洗,每張濾膜沖洗量為100 mL×3 次,泵速160 r/min。在最后一次的沖洗液中加入50~100 CFU 試驗菌,濾干后取出濾膜,菌面朝上貼于已凝固的營養瓊脂平板(用于大腸埃希菌、金黃色葡萄球菌、枯草芽孢桿菌)或玫瑰紅鈉瓊脂平板(用于白色念珠菌、黑曲霉),每株試驗菌平行制備2 張濾膜。培養條件和計數方法同常規法。
菌液組:濾膜用pH 值7.2 的無菌磷酸鹽緩沖液分3 次進行過濾、沖洗,每張濾膜沖洗量為100 mL×3 次,在最后一次的沖洗液中加入50~100 CFU 試驗菌,濾干后將接有細菌的濾膜取出,菌面朝上貼于已凝固的瓊脂平板上,每株試驗菌平行制備2 張濾膜。計數平板、培養條件及菌落計數同上。
供試品對照組:取1∶10 供試液10 mL 加至100 mL 稀釋液中,混勻,過濾,并用pH 值7.2 無菌磷酸鹽緩沖液分3 次進行過濾、沖洗,每張濾膜沖洗量為100 mL×3 次,濾干后取出濾膜,接觸樣品的粗糙面朝上貼于已凝固的瓊脂平板上,每株試驗菌平行制備2 張濾膜。計數平板、培養條件及菌落計數同上。
稀釋劑對照組:取pH 值7.0 氯化鈉-蛋白胨緩沖液1 mL 加至100 mL 稀釋液中混勻,過濾,并用pH 值7.2 無菌磷酸鹽緩沖液分3 次進行過濾、沖洗,每張濾膜沖洗量為100 mL×3 次,在最后一次的沖洗液中加入50~100 CFU 試驗菌,濾干后取出濾膜,菌面朝上貼于已凝固的瓊脂平板上,每株試驗菌平行制備2 張濾膜。計數平板、培養條件及菌落計數同上。
陰性對照組:取試驗用的稀釋液1 mL(pH 值7.0 氯化鈉-蛋白胨緩沖液),加至第一次的100 mL 沖洗液中,混勻,過濾,濾膜用pH 值7.2 的無菌磷酸鹽緩沖液分3 次進行過濾、沖洗,每張濾膜沖洗量為100 mL×3 次。濾干后取出濾膜,接觸樣品面朝上貼于已凝固的瓊脂平板上,每種培養基至少制備2 張濾膜。計數平板、培養條件及菌落計數同上。
計算方法:
稀釋劑對照組的菌回收率=稀釋劑對照組的平均菌落數÷菌落組的平均菌落數×100%
試驗組的菌回收率=(試驗組的平均菌落數-稀釋劑對照組的平均菌落數)÷菌落組的平均菌落數×100%
1.7 控制菌檢查方法 按照《中國獸藥典》等文獻[2,10-12]的相關要求,中藥提取物固體口服給藥制劑應對大腸埃希菌、沙門菌、金黃色葡萄球菌、銅綠假單胞菌進行控制菌檢查。驗證試驗與供試品的控制菌檢查同時進行,參照《中國獸藥典》2010 年版等相關文獻有關微生物限度控制菌的檢查方法[3,13-15]。
試驗組:取1∶10 供試液10 mL(相當于供試品1.0 g),加至100 mL 的pH 值7.2 無菌磷酸鹽緩沖液中混勻,過濾,并用pH 值7.2 無菌磷酸鹽緩沖液分3次進行過濾、沖洗,每張濾膜沖洗量為100 mL×3 次,10~100 CFU 試驗菌加在最后一次沖洗液中,濾干后,將接有細菌的濾膜取出接種至相應的100 mL 增菌培養基中,依相應的控制菌檢查法進行檢查。
供試液組:取1∶10 供試液10 mL,過濾,沖洗,沖洗液分3 次進行過濾、沖洗,每張濾膜沖洗量為100 mL×3 次,濾干后取出濾膜接入相應的100 mL增菌培養基中,依相應的控制菌檢查法進行檢查。
陽性對照:濾膜用pH 值7.2 的無菌磷酸鹽緩沖液分3 次進行過濾、沖洗,每張濾膜沖洗量為100 mL×3 次,在最后一次的沖洗液中加入10~100 CFU 試驗菌,濾干后將接有細菌的濾膜取出,接入相應的100 mL 增菌培養基中,依相應的控制菌檢查法進行檢查。
陰性對照:取試驗用的稀釋液10 mL(pH 值7.0氯化鈉-蛋白胨緩沖液),加至100 mL 的pH 值7.2無菌磷酸鹽緩沖液中,混勻,過濾,并用pH 值7.2無菌磷酸鹽緩沖液分3 次進行過濾、沖洗,每張濾膜沖洗量為100 mL×3 次,濾干后,將接有稀釋液的濾膜取出接入相應的100 mL 增菌培養基中,依相應的控制菌檢查法進行檢查。
1.8 供試品的微生物限度檢查 依據驗證試驗結果,對不同批次份常山散(批號:20150725、20150812、20150822,河北正道生物科技有限公司生產)進行微生物限度的檢查。細菌、真菌及酵母的總數計數,大腸埃希菌、金黃色葡萄球菌、乙型副傷寒沙門菌及銅綠假單胞菌的檢查均采用經驗證的薄膜過濾法進行,具體參照2010 年版《中國獸藥典》有關微生物限度控制菌的檢查方法[2]。
2 結果與分析
2.1 方法驗證結果 所有含供試品的錐形瓶內各試驗菌均生長良好,證實供試品在該檢驗條件下無抑菌作用或其抑菌作用可以忽略不計(采用濾膜孔徑0.45 μm、直徑50 mm 的親水混合纖維素膜酯濾膜。取1∶10 供試液10 mL(相當于含供試品1 g)加至100 mL 稀釋液中,混勻,過濾,并用pH 值7.2 無菌磷酸鹽緩沖液分3 次進行過濾、沖洗,每張濾膜沖洗量為100 mL×3 次,泵速160 r/min。在最后1 次的沖洗液中加入50~100 CFU 試驗菌,可采用薄膜過濾法建立檢查方法。
2.2 回收率的測定結果 見表1。結果表明,供試液對大腸埃希菌、金黃色葡萄球菌、枯草芽孢桿菌、白色念珠菌及黑曲霉的回收率均大于70%,其次供試品和所用稀釋劑對此結果無干擾。證實該試驗方法和條件下,供試品常山散對細菌和真菌無抑菌活性或其抑菌作用極其微弱,薄膜過濾法可用于對該供試品進行細菌、真菌及酵母的檢查。
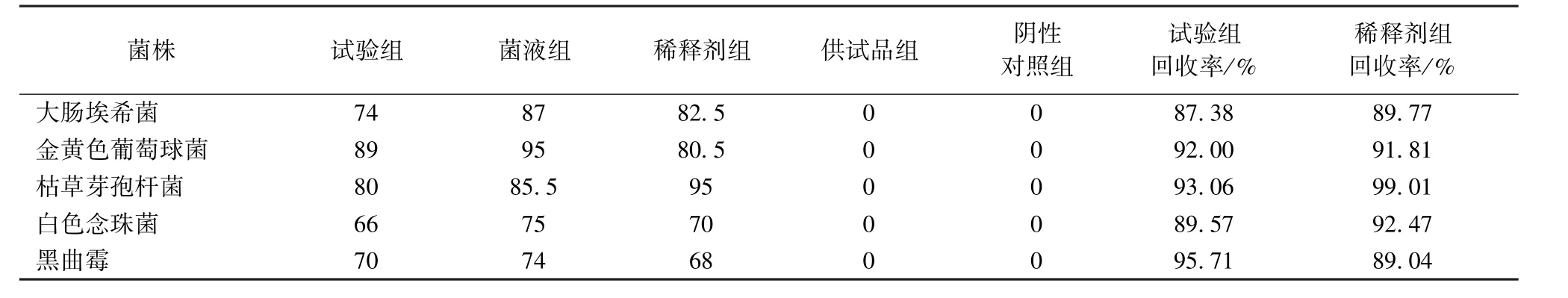
表1 薄膜過濾法回收率測定結果 (CFU/g,n=3)
2.3 控制菌檢查結果 見表2。結果表明,試驗組、陽性對照組均檢出相應的試驗菌,而陰性對照組和陰性對照組均未檢出相應的試驗菌。證實薄膜過濾法可用于常山散的控制菌檢查,此方法成立。
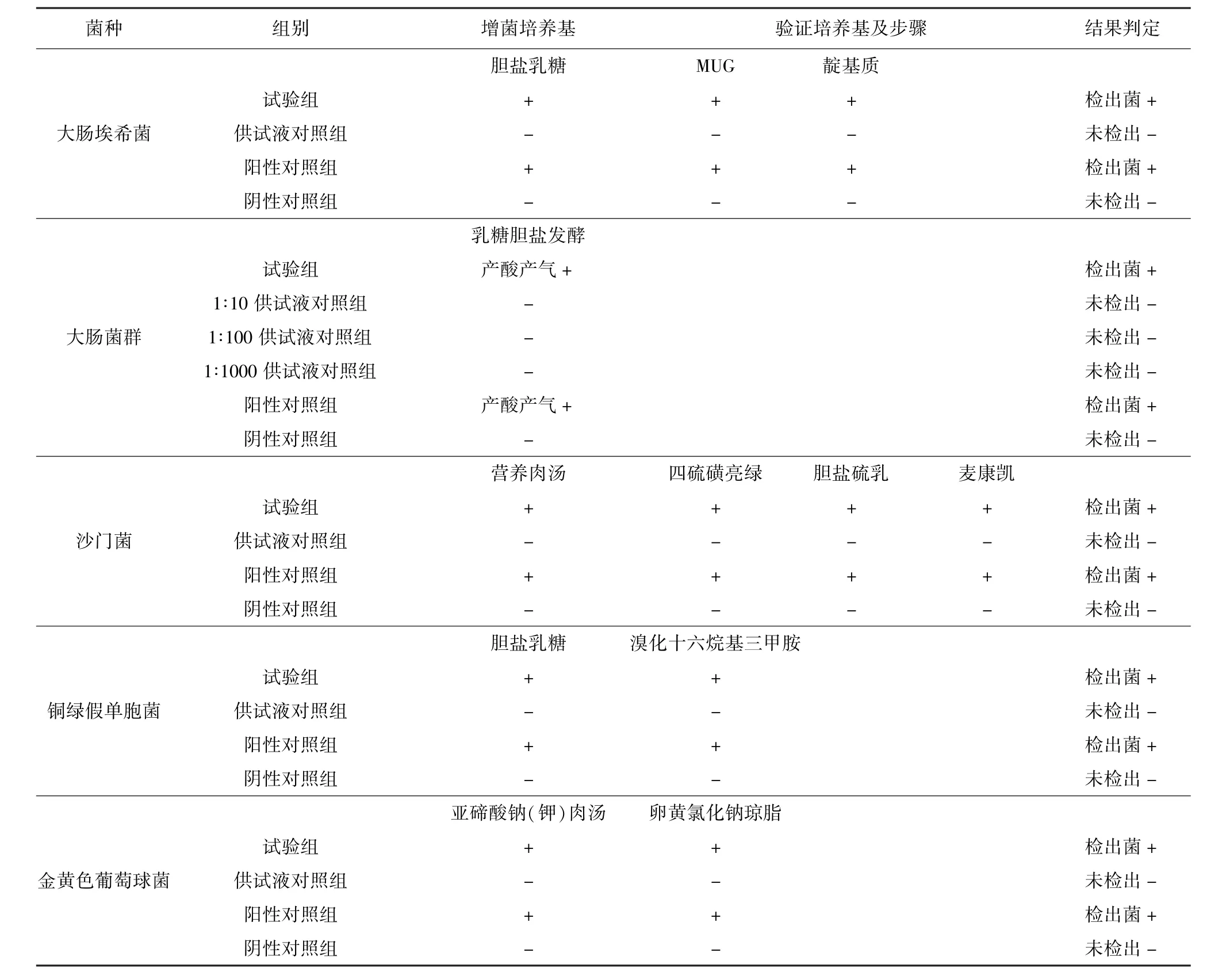
表2 控制菌檢查方法驗證結果(薄膜過濾法)
2.4 微生物限度檢查結果 見表3。結果表明,采用經驗證的薄膜過濾法對不同批次的常山散進行微生物限度檢查,結果判定供試品符合口服固體制劑規定。

表3 不同批次中藥常山散的微生物限度檢查結果
3 討論
藥品的微生物污染控制是藥品質量控制的重要指標,與化學藥品相比,中藥口服制劑的所用的原料藥材、生產工藝具有特殊性,對制劑微生物限度檢查結果的準確性有可能產生重要影響。因此作為中藥口服制劑質量標準的重要組成部分,藥品的微生物限度檢查是微生物學質量與評價的重要依據。通過對藥物制劑進行方法學驗證,才可確保微生物檢查方法的可靠性和檢查結果的準確性[9-10,13]。微生物限度檢查法可用于判斷非規定滅菌制劑是否符合獸藥典的規定,也可用于指導制劑的微生物質量標準制定,及指導生產過程中間產品微生物質量的監控[3]。薄膜過濾法作為藥物檢驗技術的一種方法,因其具有操作簡單、快速、數據準確的特點,而被應用于多種藥品的微生物檢驗。除此之外,薄膜過濾法還可以作為微生物的回收和檢驗方法。該法在無菌檢查中可以快速集菌,在藥品微生物限度檢查中可以去除藥品中某些成分的抑菌作用,例如,應用開放式的過濾器將貼膜法與過濾法進行結合應用,可以消除藥物的抗菌活性,大大提升菌落的回收率,使得回收率達到理想值,所以薄膜過濾法在藥品檢驗中的應用越來越被重視[2]。 從常山散的方法學驗證試驗結果可以看出,取中藥常山散10 g,用pH值7.0 無菌氯化鈉-蛋白胨緩沖液加至100 mL,將其制備成1 ∶10 的供試液,經過薄膜過濾法方法驗證試驗,處理后的供試液對大腸埃希菌、金黃色葡萄球菌、枯草芽孢桿菌、白色念珠菌、黑曲霉的加菌回收率均大于70%。表明常山散在此試驗方法和條件下無抑菌作用或抑菌作用極微弱,可使加菌回收率達到滿意效果,且供試品、稀釋劑對此結果無干擾。另外,控制菌檢查的試驗組、陽性對照組均檢出相應的試驗菌,而陰性對照組和空白對照組均未檢出相應的試驗菌。 表明中藥常山散的控制菌檢查可采用薄膜過濾法進行,且結果可靠。
綜上,供試品中藥常山散的細菌、真菌和酵母計數方法和控制菌檢查方法均可采用薄膜過濾法進行。本次試驗供試品的細菌數、真菌和酵母數、控制菌3 項檢查結果均符合該品種項下的規定,通過對3 個批號常山散進行微生物限度檢查,均符合要求,表明常山散已達口服固體給藥制劑的標準。其次,本次微生物限度檢查方法的建立可為水溶性差的中藥提取物制劑在進行同類試驗時提供技術理論上的參考,而且根據驗證結果選擇準確可靠、可操作性高的試驗方法及條件,方可更好的滿足企業要求,從而共同提高藥品質量。通過有效的微生物學質量控制與檢驗,可全面了解藥品的微生物污染現狀與整體生產水平,并將其作為制定該藥品微生物限度檢查項和限值的參考,防止微生物的污染。

