非編碼RNA 在牙源性干細(xì)胞成牙本質(zhì)向分化中作用的研究進(jìn)展
張凱瑩 房付春,2 吳補(bǔ)領(lǐng),2
1.南方醫(yī)科大學(xué)南方醫(yī)院口腔科 廣州 510515;
2.南方醫(yī)科大學(xué)口腔醫(yī)學(xué)院 廣州 510515
牙源性干細(xì)胞是從口腔組織中分離出來的成體干細(xì)胞,包括牙髓干細(xì)胞(dental pulp stem cell,DPSC)、脫落乳牙干細(xì)胞(stem cell from human exfoliated deciduous teeth,SHED)、根尖乳頭干細(xì)胞(apical papilla stem cell,SCAP)、牙囊前體細(xì)胞(dental follicle progenitor cell,DFPC)、牙周膜干細(xì)胞(periodontal ligament stem cell,PDLSC)等,具有自我更新和多向分化的潛能[1]。在某些生物因素影響下,或當(dāng)牙體組織受到創(chuàng)傷和不可逆性的齲病損害時(shí),牙源性干細(xì)胞(尤其是DPSC)能分化為新的成牙本質(zhì)細(xì)胞,分泌牙本質(zhì)基質(zhì),進(jìn)而形成修復(fù)性牙本質(zhì)。
在體外特定條件下,培養(yǎng)的牙源性干細(xì)胞能分化為成牙本質(zhì)樣細(xì)胞,具有高的克隆、增殖和形成致密鈣化克隆團(tuán)甚至是鈣化結(jié)節(jié)的能力,此過程被稱為成牙本質(zhì)向分化[2]。此過程涉及多種轉(zhuǎn)錄水平以及轉(zhuǎn)錄后水平調(diào)控機(jī)制[3]。研究牙源性干細(xì)胞成牙本質(zhì)向分化機(jī)制為組織工程和再生醫(yī)學(xué)提供了新思路。
非編碼RNA(non-coding RNA,ncRNA)是指不編碼蛋白質(zhì)對細(xì)胞生命過程起調(diào)控作用的RNA,目前研究較多的ncRNA包括了長鏈非編碼RNA(long noncoding RNA,lncRNA)、微小RNA(microRNA,miRNA/miR)、環(huán)狀RNA(circle RNA,circ-RNA)、Piwi-interacting RNA(piRNA)等。其共同點(diǎn)是能從基因組上轉(zhuǎn)錄而來,但是不翻譯成蛋白質(zhì),在RNA水平上行使各自的生物學(xué)功能[4]。近年來,關(guān)于ncRNA在膀胱、直腸等組織器官的作用機(jī)制的研究開展得比較廣泛,特別是在癌癥的發(fā)生和發(fā)展方面研究得比較深入[5-6]。雖然ncRNA在牙源性干細(xì)胞中功能和機(jī)制的探討較少,但事實(shí)上ncRNA在牙源性干細(xì)胞成牙本質(zhì)向分化作用中發(fā)揮了重要作用,其往往通過成牙本質(zhì)相關(guān)基因或相關(guān)通路發(fā)揮調(diào)控作用(表1)。
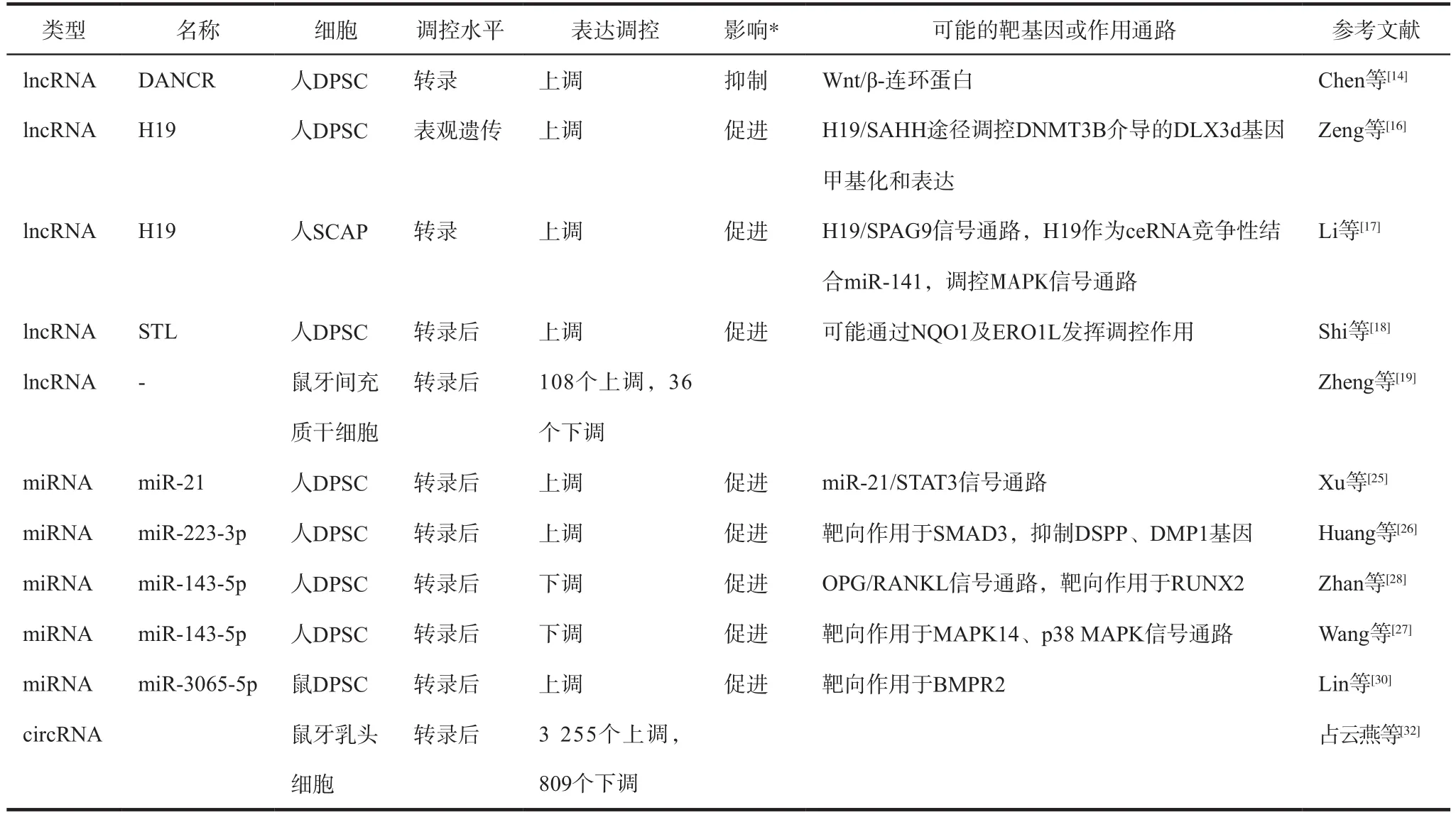
表1 ncRNA參與牙源性干細(xì)胞成牙本質(zhì)向分化調(diào)控Tab 1 Regulation of ncRNAs on odontoblastic differentiation of dental tissue-derived stem cells
1 lncRNA在牙源性干細(xì)胞成牙本質(zhì)向分化中的作用
lncRNA轉(zhuǎn)錄本長度超過200核苷酸(nucleotide,nt),有的甚至超過10 000 nt,數(shù)量占ncRNA的80%以上。lncRNA通過與DNA/RNA或者與蛋白質(zhì)結(jié)合,在轉(zhuǎn)錄及轉(zhuǎn)錄后水平上調(diào)節(jié)編碼蛋白質(zhì)的基因的表達(dá)[7-8],改變干細(xì)胞多向分化的能力,最終影響細(xì)胞的增殖、分化,乃至機(jī)體的生長、發(fā)育、衰老、死亡等重要生命活動(dòng)以及疾病的發(fā)生和發(fā)展[9]。
在細(xì)胞質(zhì)中,lncRNA的功能和潛在機(jī)制包括:調(diào)節(jié)信使RNA(messenger RNA,mRNA)的穩(wěn)定性,調(diào)節(jié)翻譯過程,作為競爭性內(nèi)源RNA,作為miRNA的前體,調(diào)節(jié)蛋白質(zhì)修飾過程[10]。
在細(xì)胞核中,lncRNA的調(diào)節(jié)機(jī)制包括:作為轉(zhuǎn)錄因子等調(diào)節(jié)蛋白的誘餌,作為RNA蛋白復(fù)合物的支架,通過招募染色質(zhì)修飾因子成為表觀遺傳調(diào)控因子[11]。
1.1 lncRNA在人牙源性干細(xì)胞成牙本質(zhì)向分化中的作用
2012年,Kretz等[12]發(fā)現(xiàn)了一種lncRNA,在人外胚層細(xì)胞分化時(shí)下調(diào),并且需要保持外胚層干細(xì)胞或成骨細(xì)胞處于未分化的狀態(tài),將其命名為反分化非編碼RNA(antidifferentiation non-protein coding RNA,ANCR),后更名為拮抗分化非編碼RNA(differentiation antagonizing non-protein coding RNA,DANCR)。Zhu等[13]發(fā)現(xiàn),下調(diào)的DANCR可通過作用于靶基因果蠅zeste基因增強(qiáng)子同源物2(enhancer of zestehomolog 2,EZH2)以及調(diào)控RUNT相關(guān)轉(zhuǎn)錄因子2(runt-related transcription factor 2,RUNX2)的表達(dá)來促進(jìn)成骨分化。Chen等[14]進(jìn)一步研究發(fā)現(xiàn),上調(diào)的DANCR顯著降低了糖原合成酶激酶3β的絲氨酸磷酸化(Ser9 phosphorylation of glycogen synthase kinase 3β,p-GSK-3β)和β-連環(huán)蛋白(β-catenin)的表達(dá),提示DANCR可通過抑制Wnt/β-連環(huán)蛋白通路的活性進(jìn)而抑制成牙本質(zhì)向分化。
另外,lncRNA H19是轉(zhuǎn)錄自人類染色體11p15.5的H19/lgf2基因族的lncRNA,在細(xì)胞核和細(xì)胞質(zhì)中均發(fā)揮多種功能活性[15]。Zeng等[16]研究發(fā)現(xiàn),lncRNA H19可以與S-腺苷同型半胱氨酸水解酶(S-adenosylhomocysteine hydrolase,SAHH)作用,H19/SAHH途徑調(diào)控DNA甲基轉(zhuǎn)移酶(DNA methyltransferase,DNMT)3B介導(dǎo)的同源盒轉(zhuǎn)錄因子(distal-less homeobox,DLX)3的基因甲基化和表達(dá),從而在表觀遺傳水平促進(jìn)DPSC成牙本質(zhì)向分化。而Li等[17]發(fā)現(xiàn),lncRNA H19可競爭性結(jié)合miR-141,并阻止精子相關(guān)抗原(spermassociated antigen,SPAG)9發(fā)生miR-141介導(dǎo)的降解,從而提高p38和c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)磷酸化水平,進(jìn)而促進(jìn)人SCAP成骨/成牙本質(zhì)向分化。
此外,也有學(xué)者[18]發(fā)現(xiàn),在缺氧條件下,人DPSC成骨/成牙本質(zhì)向分化下調(diào);進(jìn)行ncRNA表達(dá)譜生物學(xué)分析,結(jié)果顯示20個(gè)lncRNA表達(dá)上調(diào),27個(gè)lncRNA表達(dá)下調(diào);構(gòu)建lncRNA和mRNA共表達(dá)網(wǎng)絡(luò),篩選出關(guān)鍵lncRNA 6-12白血病分子(six-twelve leukemia,STL),驗(yàn)證了沉默STL將抑制成骨/成牙本質(zhì)向分化,并可能通過醌還原型煙酰胺腺嘌呤二核苷酸脫氫酶[nicotinamide adenine dinucleotide (NADH): quinone oxidoreductase,NQO]1及內(nèi)質(zhì)網(wǎng)氧化還原酶(endoplasmic reticulum oxido re ductin,ERO)1發(fā)揮作用。
因此,lncRNA在人牙組織來源干細(xì)胞分化過程中的調(diào)控機(jī)制以及調(diào)控的多條途徑之間的關(guān)聯(lián)可能成為今后的研究熱點(diǎn)。
1.2 lncRNA在小鼠牙間充質(zhì)干細(xì)胞成牙本質(zhì)向分化中的作用
2016年,Zheng等[19]研究了與小鼠牙間充質(zhì)干細(xì)胞成牙本質(zhì)向分化相關(guān)的lncRNA,利用RNA測序比較新鮮分離的與培養(yǎng)的牙髓間充質(zhì)干細(xì)胞的lncRNA表達(dá)譜,對差異表達(dá)的lncRNA與編碼RNA進(jìn)行共表達(dá)分析,發(fā)現(xiàn)在新鮮分離的牙髓間充質(zhì)干細(xì)胞中,共有108個(gè)lncRNA上調(diào)表達(dá),36個(gè)lncRNA下調(diào)表達(dá)。通過實(shí)時(shí)熒光定量聚合酶鏈?zhǔn)椒磻?yīng)(quantitative real-time polymerase chain reaction,qRT-PCR)測定可知,培養(yǎng)的與新分離的牙髓間充質(zhì)干細(xì)胞相比,在培養(yǎng)的牙髓間充質(zhì)干細(xì)胞中,母系印記基因3(maternally imprinted genes 3,Meg3)、肺癌轉(zhuǎn)移相關(guān)轉(zhuǎn)錄本1(metastasis-asso ciated lung adenocarcinoma transcript 1,Malat1)、 X(染色體)失活特異性轉(zhuǎn)錄物(X-inactive specific transcript,Xist)和反義遠(yuǎn)端同源盒轉(zhuǎn)錄因子1(distal-less homeobox 1 antisense,Dlx1as)等與成牙本質(zhì)向分化相關(guān)的基因顯著下調(diào),而在具有較強(qiáng)成牙本質(zhì)向分化潛能的牙源性牙髓間充質(zhì)組織中表達(dá)上調(diào)。提示lncRNA失調(diào)可能與牙間充質(zhì)干細(xì)胞培養(yǎng)過程中成牙本質(zhì)向分化潛能的喪失有關(guān)。此外,Dlx1上游生長因子成纖維細(xì)胞生長因子(fibroblast growth factor,F(xiàn)GF)8可誘導(dǎo)牙髓間充質(zhì)干細(xì)胞中Dlx1as的下調(diào)和Dlx1的上調(diào),這表明Dlx1as與牙髓間充質(zhì)干細(xì)胞中的Dlx1含量呈負(fù)相關(guān),因此Dlx1和Dlx1as的表達(dá)可能存在相反的功能表型。
2 miRNA在牙源性干細(xì)胞成牙本質(zhì)向分化中的作用
miRNA是一類廣泛存在于真核生物基因組,長度為20~24 nt的內(nèi)源性非編碼蛋白質(zhì)的單鏈小分子RNA[20]。在產(chǎn)生miRNA的經(jīng)典途徑中,存在于細(xì)胞核中的原始miRNA(pri-miRNA)能被核糖核酸酶Ⅲ Drosha和狄喬治氏綜合征相關(guān)蛋白8抗體(DiGeorge syndrome-related proteins 8 antibody,DGCR8)識別并裂解為前體miRNA(pre-miRNA),經(jīng)RNA酶ⅢDicer進(jìn)一步處理成為成熟miRNA[21]。研究[22]顯示,成熟miRNA通過與靶基因mRNA的3’端非翻譯區(qū)堿基互補(bǔ)配對結(jié)合,導(dǎo)致mRNA降解或者翻譯過程受到抑制,從而負(fù)調(diào)控靶基因的表達(dá)。在人類基因組中,大約1 000種miRNA被鑒別出,人類多達(dá)30%的基因受miRNA所調(diào)節(jié)[23-24]。
2.1 miRNA在人牙源性干細(xì)胞成牙本質(zhì)向分化中的作用
近年已有研究表明部分miRNA可促進(jìn)人牙源性干細(xì)胞成牙本質(zhì)向分化。Xu等[25]研究在低濃度腫瘤壞死因子(tumor necrosis factor,TNF)-α介導(dǎo)下,miR-21和信號轉(zhuǎn)導(dǎo)與轉(zhuǎn)錄激活因子(transducer and activator of transcription,STAT)3表達(dá)上調(diào),上調(diào)的miR-21協(xié)同STAT3來調(diào)控人DPSC成牙本質(zhì)向分化,構(gòu)成miR-21/STAT3信號通路。也有研究[26]發(fā)現(xiàn),miR-223-3p與骨形態(tài)發(fā)生蛋白(bone morphogenetic protein,BMP)4發(fā)生解離,從而抑制轉(zhuǎn)化生長因子(transforming growth factor,TGF)-β信號通路的細(xì)胞內(nèi)效應(yīng)器Smad3,進(jìn)而促進(jìn)人DPSC成牙本質(zhì)向分化。
此外,部分miRNA在牙源性干細(xì)胞成牙本質(zhì)向分化過程中表達(dá)下調(diào)。有學(xué)者研究miR-143-5p抑制成牙本質(zhì)向分化的相關(guān)機(jī)制。Wang等[27]發(fā)現(xiàn),下調(diào)的miR-143-5p可降低與絲裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)14的結(jié)合,促進(jìn)MAPK14表達(dá),激活p38 MAPK信號通路以促進(jìn)成牙本質(zhì)向分化。Zhang等[28]探究miR-143-5p在人DPSC成牙本質(zhì)向分化中通過骨保護(hù)蛋白(osteoprotegerin,OPG)/核因子-κB受體活化因子配體(receptor activator of nuclear factorκB ligand,RANKL)信號通路直接作用于RUNX2的機(jī)制。雙熒光酶素報(bào)告顯示,RUNX2是miR-143-5p的直接作用靶基因;進(jìn)一步實(shí)驗(yàn)顯示,在轉(zhuǎn)染了pMIR-miR-143-5p抑制體質(zhì)粒的人DPSC中,堿性磷酸酶(alkaline phosphatase,ALP)表達(dá)活力增強(qiáng),鈣化結(jié)節(jié)形成增多,牙本質(zhì)磷蛋白(dentin phosphoprotein,DPP)、牙本質(zhì)涎蛋白(dentin sialoprotein,DSP)、牙本質(zhì)基質(zhì)蛋白(dentin matrix protein,DMP)1、骨橋蛋白(osteopontin,OPN)、骨唾液酸蛋白(bone sialoprotein,BSP)、骨鈣蛋白(osteocalcin,OCN)、RUNX2和OPG表達(dá)上調(diào),而RANKL表達(dá)下調(diào),細(xì)胞侵襲遷移能力以及黏附能力增強(qiáng),提示下調(diào)的miR-143-5p通過OPG/RANKL信號通路上調(diào)RUNX2的表達(dá),進(jìn)而促進(jìn)人DPSC成牙本質(zhì)向分化。此外,在IGF1處理的人SCAP中,hsa-let-7c可通過胰島素樣生長因子(insulin like growth factor,IGF)-1/胰島素樣生長因子-1受體(insulin like growth factor-1 receptor,IGF-1R)/hsa-let-7c軸,抑制JNK和p38 MAPK信號通路,進(jìn)而抑制成牙本質(zhì)向分化[29]。
2.2 miRNA在小鼠牙間充質(zhì)干細(xì)胞成牙本質(zhì)向分化中的作用
在小鼠模型中,Li等[30]發(fā)現(xiàn)miR-3065-5p在成牙本質(zhì)向分化過程中上調(diào)。雙熒光酶素報(bào)告顯示,miR-3065-5p與骨形態(tài)發(fā)生蛋白受體Ⅱ型(bone mor phogenetic protein receptor type Ⅱ,BMPR2)的3’端相結(jié)合,BMPR2在成牙本質(zhì)向分化早期表達(dá)增多,而在晚期則表達(dá)劇烈下降。由此證實(shí)了小鼠模型中miR-3065-5p可部分通過BMPR2調(diào)控成牙本質(zhì)向分化。
3 circRNA在牙源性干細(xì)胞成牙本質(zhì)向分化中的作用
circRNA是一類特殊的ncRNA分子,大量存在于真核細(xì)胞中,是由前體mRNA通過特殊的選擇性剪切產(chǎn)生的,與傳統(tǒng)線型RNA不同,呈封閉環(huán)狀結(jié)構(gòu),不易被核酸外切酶RNaseR降解,比線性RNA更穩(wěn)定,因此成為新的生物學(xué)標(biāo)記物[31]。
目前關(guān)于circRNA在人DPSC成牙本質(zhì)向分化中的功能及機(jī)制的探討較少,尚停留在小鼠模型上,且多以基因芯片和生物信息學(xué)分析為主,但伴隨著新的研究技術(shù)體系的建立,circRNA在人DPSC成牙本質(zhì)向分化中的機(jī)制將進(jìn)一步得以闡明。占云燕等[32]對小鼠牙乳頭細(xì)胞向成牙本質(zhì)細(xì)胞分化過程中的circRNA的表達(dá)譜進(jìn)行了研究,發(fā)現(xiàn)在經(jīng)礦化誘導(dǎo)的牙乳頭細(xì)胞中,差異表達(dá)的circRNA共4 064條,其中3 255條上調(diào)表達(dá),809條下調(diào)表達(dá)。分析其中上調(diào)circRNA來源基因,發(fā)現(xiàn)很多基因與牙的發(fā)育過程及硬組織礦化相關(guān)。
4 ncRNA在牙源性干細(xì)胞成牙本質(zhì)向分化中的研究展望
綜上所述,牙源性干細(xì)胞的成牙本質(zhì)向分化會受到多種ncRNA的調(diào)控,兼有抑制或促進(jìn)效應(yīng),其機(jī)制既包括直接作用于成牙本質(zhì)向分化相關(guān)轉(zhuǎn)錄因子,也有間接作用于轉(zhuǎn)錄因子相關(guān)因素,甚至構(gòu)成反饋環(huán)路發(fā)揮調(diào)控作用。lncRNA、miRNA和circRNA關(guān)系密切,它們彼此相互作用,在人體內(nèi)構(gòu)成一個(gè)復(fù)雜而精準(zhǔn)的網(wǎng)絡(luò)調(diào)控體系。近年來關(guān)于內(nèi)源性競爭RNA(competitive endogenous RNA,ceRNA)的作用機(jī)制探討較多,lncRNA和circRNA甚至某些miRNA均可發(fā)揮miRNA分子海綿作用,調(diào)控宿主基因表達(dá)[31,33-34]。筆者認(rèn)為,關(guān)于ncRNA對成牙本質(zhì)向分化的相關(guān)調(diào)控因素作用方面的研究,不僅有助于深入探究ncRNA這一參與許多重要生命活動(dòng)的調(diào)控因子,也將有利于為牙源性干細(xì)胞的再生治療提供新的思路和方法。另外,關(guān)于尋找ncRNA結(jié)構(gòu)和功能的更高效的研究方法,也將會成為ncRNA今后的研究熱點(diǎn)和重點(diǎn)。

