大腸癌的脂質代謝與天然產物的防治研究進展*
張 莉,聞曉東
中國藥科大學 天然藥物活性組分與藥效國家重點實驗室,南京 210009
大腸癌又稱為結直腸癌,是臨床上常見的消化道惡性腫瘤,具有較高的發病率和致死率,每年約有140萬人被確診為大腸癌,預計到2035年確診人數將會達到240萬[1]。流行病學研究發現,飲食、肥胖和糖尿病是大腸癌發病的危險因素[1]。近年來的研究表明,脂質代謝紊亂與大腸癌的發生與發展密切相關[2]。
脂質(Lipids)是一類存在于自然界中不溶于水的小極性化合物,根據酮酰基和異戊二烯基的位置不同,將脂質分為8 類:脂肪酸類(fatty acyls)、甘油酯類(glycerolipids)、甘油磷脂類(glycerophospholipids)、鞘脂類(sphingolipids)、固醇脂類(sterol lipids)、孕烯醇酮酯類(prenol lipids)、糖脂類(saccharolipids)和聚酮類(polyketides)[3]。研究表明,脂質代謝紊亂與腫瘤的發生發展密切相關,在腫瘤細胞中有大量的脂質合成:一方面為快速增殖的腫瘤細胞提供物質基礎和能量供應;另一方面脂代謝產物如前列腺素E2(prostaglandin E2)、磷脂酸 (phosphatidic acid)、類 花 生 酸 (eicosanoids)等脂質(lipids)作為第二信使參與細胞的增殖與存活。而固醇調節原件結合蛋白 (Sterol regulatory element-binding protein transcription factors,SREBPs)是調控脂質合成的關鍵轉錄因子,研究表明,SREBP-1在結腸癌中高水平表達,促進腫瘤的發生與進展[4]。而SREBP-1抑制劑樺木醇(betulin)、考來烯胺(fatostatin)等可以顯著地抑制腫瘤細胞的增殖、侵襲和遷移,誘導腫瘤細胞凋亡。此外,敲除SREBP-1可以顯著抑制大腸癌細胞的增殖與侵襲。因此,開發出高效、低毒、選擇性調控脂質代謝以達到抗腫瘤作用的天然化合物具有較好的臨床應用前景。
1 SREBPs:脂質合成的關鍵調節因子
脂質代謝紊亂是腫瘤的一個典型特征,其最顯著的變化為脂質從頭合成增加。研究表明,脂質從頭合成主要生成飽和/單 不 飽 和 脂 肪 酸 SAFA (saturated fatty acids)、MUFA(mono-unsaturated fatty acids),以磷脂(phospholipids)為主要最終產物[5]。首先,檸檬酸(citrate)依次在ATP檸檬酸裂解酶(ATP-citrate lyase,ACLY)、乙酰輔酶 A 羧化酶(acetyl-CoA carboxylase,ACC) 和脂肪酸合酶 (fatty acid synthase,FASN)的作用下生成SAFA,然后在去飽和酶SCD(stearoyl-CoA desaturase)、FADS(fatty acid desaturase)和加長酶(fatty acid elongase,ELOVL)的作用下生成MUFA和多不飽和脂肪酸(polyunsaturated fatty acids,PUFA),進而生成飽和或單不飽和磷脂 (saturated phospholipids;mono-unsaturated phospholipids)。
眾所周知,磷脂(phospholipids)是細胞膜的主要成分之一,其在細胞的生長和增殖方面發揮著重要的作用:一方面維持細胞膜的穩態;另一方面進行細胞膜的信息傳遞[6]。此外,新合成的脂肪酸在乙酰輔酶A合成酶(acetyl-CoA synthetase,ACS)的作用下進行活化,進而在轉移酶GPAT(glycerol-3-phosphate acyltransferase)、AGPAT(1-acylglycerol-3-phosphate O-acyltransferase)、DGAT (diacylglycerol O-acyltransferase)和磷脂酸磷酸酶(phosphatidic acid phosphatase,PAP)的作用下生成甘油三脂(triglyceride,TG)。過量的TG以脂滴的形式存在于細胞中,為細胞提供能量供應和膜合成物質基礎;新近研究表明,腫瘤細胞中脂滴的堆積與細胞耐藥密切相關[7-9]。同時,乙酰輔酶A(acetyl-CoA)可通過甲羥戊酸途徑生成膽固醇(cholesterol),而細胞內膽固醇(cholesterol)的堆積可以刺激巨噬細胞和其他免疫細胞,進而引起炎癥反應;同時血清中膽固醇(cholesterol)的含量與腫瘤的發生發展密切相關[10-12]。見圖 1[13]。

圖1 細胞內脂質合成通路
SREBPs是調節脂質平衡的關鍵轉錄因子,其主要有3種亞型:固醇調節原件結合蛋白-1a(SREBP-1a)、固醇調節原件結合蛋白-1c(SREBP-1c)和固醇調節原件結合蛋白-2(SREBP-2)。研究表明,SREBP-1a和 SREBP-1c主要調控脂肪酸代謝,而SREBP-2是膽固醇代謝的主要調控因子[14,15]。但新合成的SREBPs以一種無活性前體形式存在,與SREBP裂解活化蛋白(SREBP cleavage-activating protein,SCAP)形成二聚體,而SCAP可以可逆性地與胰島素誘導基因蛋白(insulin-induced gene proteins,INSIG)結合,在正常情況下三者以復合物的形式鉚定在內質網上。當細胞中甾醇(sterols)含量降低時,INSIG與SCAP不再結合,SCAP構型發生改變,牽引SREBP-1經包被蛋白Ⅱ (coated proteinⅡ,COPⅡ)包被小泡轉移至高爾基體膜,并依次由蛋白酶(membrane-bound transcription factor site-1 protease,S1P;membrane-bound transcription factor site-2 protease,S2P)切割釋放活性N端,遷移到細胞核內與相應的靶基因啟動子/增強子的膽固醇結合元件SRE結合,促進其下游FASN、ACC、ACLY、SCD-l和3-羥基3-甲基戊二酰輔酶A還原酶(3-hydroxy-3-methylglutaryl-CoA reductase,HMGCR) 等基因轉錄,從而調節膽固醇(cholesterol)及脂肪酸(fatty acids,FAs)的合成[16,17]。
研究表明,SREBPs的激活不僅受細胞內甾醇(sterols)的影響,多種細胞信號通路對其的成熟也具有調控作用(見圖2)[17]。胰島素細胞信號通路在脂質的合成中扮演者重要的角色,胰島素(insulin)可以通過 PI3K-AKT-mTORC1-S6K1信號通路激活SREBP-1的表達,進而加速FAs的從頭合成[18]。雷帕霉素靶蛋白 (mammalian target of rapamycin,mTOR)具有兩種亞型,即 mTORC1和 mTORC2。Hagiwara A等[19]研究表明,在肝臟中mTORC2同樣可以通過AKT-SREBP-1c通路促進FAs的合成。此外,在黑色素瘤細胞中,表皮生長因子(epidermal growth factor receptor,EGFR)抑制劑拉帕替尼可通過PI3K-Akt通路抑制SREBP-1的表達,表明EGFR同樣可以通過調控脂肪酸合成關鍵轉錄因子SREBP-1而影響黑色素瘤細胞中的脂質代謝[20]。糖原合成酶激酶-3(Glycogen synthase kinase 3,GSK3)是 AKT的下游,AKT可抑制 GSK3的表達,進而促進SREBP-1c的磷酸化,抑制SREBP-1c的表達[21]。腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)作為細胞內調控能量代謝的關鍵分子,在調節肝臟脂質代謝中起著重要作用。Yang J等[22]的研究結果顯示,AMPK可以通過抑制內源性的肝X配體的產生而抑制SREBP-1c的轉錄,同時,AMPK表達升高可抑制mTORC1介導的SREBP-1c的表達[23]。P53是腫瘤中常見的突變基因,Freed-Pastor W等[24]的研究顯示,p53可以刺激SREBP-2的轉錄,進而加速膽固醇(cholesterol)的合成,刺激細胞的生長。此外,mTORC1的激活不僅可以促進SREBP-1的表達,同時可以激活SREBP-2的表達[25]。而第10號染色體缺失的磷酸酶和張力蛋白同源物(phosphatase and tensin homolog,PTEN)基因可通過PI3K-AKT-mTORC-SREBP通路調控脂質的合成[26]。
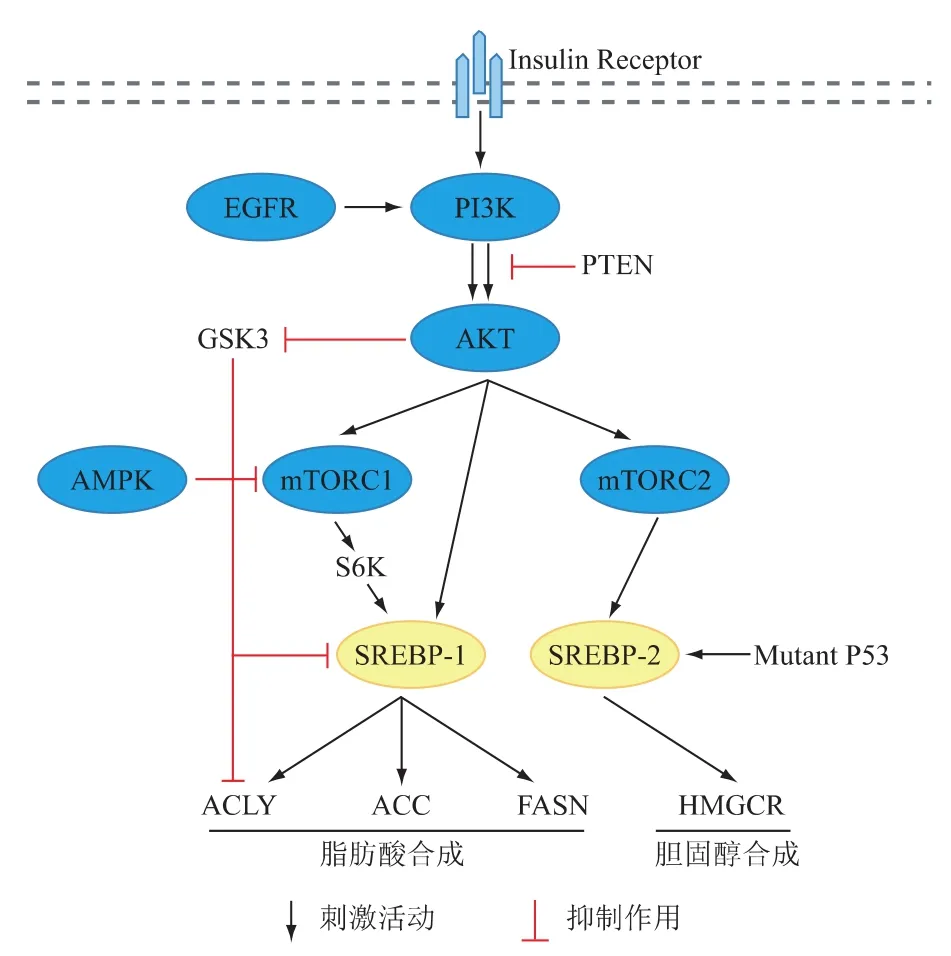
圖2 調控SREBPs的細胞信號通路
2 脂質代謝紊亂介導大腸癌的發生發展
脂質代謝異常與腫瘤的發生發展密切相關。Wen YA等[4]研究表明,敲除SREBPs可以顯著地抑制大腸癌細胞的增殖,降低大腸癌細胞的增殖能力,且抑制大腸癌移植瘤的生長。FASN是SREBP-1調控的脂肪酸從頭合成的下游關鍵因子,其在原發性大腸癌和肝轉移大腸癌組織中表達顯著升高,其一方面通過增強細胞的呼吸作用、維持細胞內的能量穩態;另一方面可以通過Wnt信號通路促進大腸癌的侵襲與轉移,從而縮短患者的生存期[27,28]。此外,奧利司他(FASN抑制劑)可以激活半胱氨酸蛋白酶-3(caspase-3),加速大腸癌細胞的凋亡[29]。研究表明,脂質代謝產物可能會干預大腸癌的發生與發展,Pyne NJ等[30]的研究顯示,鞘脂代謝物1-磷酸鞘氨醇(sphingosine 1-phosphate)可通過激活 NF-κB/IL-6/STAT3信號通路,促進結腸炎轉化為結腸癌。
磷脂酰膽堿(phosphatidylcholine,PC)是甘油磷脂家族的成分之一,其可以合成磷脂酰絲氨酸(phosphatidylserine)、鞘磷脂(sphingomyelin)等其他磷脂(phospholipids),是細胞膜的主要成分之一。研究表明,在結直腸癌組織中,PC的含量顯著升高,促進結直腸細胞的生長,調節細胞內的信號通路[31]。此外,磷脂酶 A2(Phospholipase A2,PLA2)是 PC水解成溶血磷脂酰膽堿(lysophosphatidylcholine,LPC)的關鍵酶,在潰瘍性結腸炎中PLA2的表達顯著升高[32]。PC在PLA2的作用下水解生成LPC,激活巨噬細胞,使巨噬細胞停留在M1型,進而產生IL-12、IL-1β、TNF-α和IL-6等促炎因子,增強炎癥反應,進而引起大腸癌的發生[33,34]。
FAs主要分為SAFA、MUFA和PUFA3類,由于其結構的不同,在腫瘤的發生發展中扮演著不同的角色。研究表明,油酸(oleic acid)、軟脂酸(palmitic acid)和亞油酸(linoleic acid)可以降低大腸癌發生的風險,而花生四烯酸(arachidonic acid,AA)和硬脂酸(octadecanoic acid)可以顯著增加結直腸癌發生的風險[35]。游離的AA可生成PGE2、前列腺素D2(prostaglandin D2)、血栓素(thromboxanes),其中 PGE2 在大腸腫瘤中的含量豐富,通過上調β-連環蛋白(β-catenin)、激活PI3K、AKT激酶致癌基因和RAS-絲裂原活化蛋白激酶(RAS-mitogen-activated protein kinase)通路,促進大腸癌的發生[36]。
TG是人體含量最豐富的脂質之一,研究表明,血清中的TG的含量與大腸腺瘤的發病率呈正相關[37]。TG是合成脂滴的原料,Xiao L等[38]研究顯示,在人的結直腸癌組織中脂滴的堆積顯著升高;但TG與結腸癌發病之間的機制尚待進一步的研究。
脂質代謝紊亂不僅可以促進炎癥反應,進而引起大腸癌變,還可促進大腸癌的侵襲與轉移。
3 天然產物通過靶向脂質代謝通路作為大腸癌的預防和治療藥物
脂質代謝紊亂引發炎癥反應,進而加速癌癥的發生與發展,細胞內膽固醇(cholesterol)的堆積可以激活免疫細胞,進而引起炎癥反應[39]。HMGCR是膽固醇(cholesterol)合成過程中的關鍵酶,研究表明,天然產物洛伐他汀(lovastatin)和α-細辛腦(α-asarone)等化合物,可以抑制HMGCR的活性,進而抑制膽固醇(Cholesterol)的合成,因此有望開發成為預防大腸癌的天然藥物[40,41]。AA在炎癥反應中扮演著重要的角色:它在環氧合酶-2(cyclooxygenase-2,COX-2)和脂氧合酶-5 (lipoxygenase-5,5-LOX)的作用下,生成前列腺素(prostaglandins,PGs)、白三烯(leukotrienes,LTs)等促炎因子,因此干擾AA代謝可以有效地抑制炎癥反應,進而保護腸道健康。小檗堿(berberine)是一種存在于多種植物中的生物堿,Park JJ等[42]研究表明,小檗堿可以通過激活AMPK而抑制大腸癌細胞的遷移。Liu X等[43]研究也表明,小檗堿可抑制COX-2/PGE2的表達,進而抑制大腸癌細胞的侵襲與轉移。Lee YK等[44]研究表明,姜黃素 (curcumin)可通過影響AMPK-COX-2的表達而促進大腸癌細胞HT-29的凋亡,發揮抗大腸癌的作用。二烯丙基硫化物(diallyl sulfides)[45]、漆黃素(fisetin)[46]、茄紅素(lycopene)[47]和熊果酸(ursolic acid)[48]等化合物也可以抑制AA代謝物的產生,進而發揮抗炎、抑制大腸癌的作用。此外,研究表明,胞外多糖(extracellular polysaccharide,EPS1-1)可以增加大腸癌小鼠糞便中總短鏈脂肪酸(total short-chain fatty acids,SCFAs)的濃度,抑制氧化偶氮甲烷/右旋糖酐硫酸酯鈉(azoxymethane,AOM;dextran sodium sulfate,DSS)誘導的大腸癌的發生[49]。
蘆丁(Rutin)[50]、獐牙菜苦苷(swertiamarin)[51]、樺木醇(betulin)[52]、黃腐酚(xanthohumol)[53]和千層紙素 A(oroxylin A,OA)[54]可以抑制SREBP-1,進而抑制脂質的合成。Ni T等[54]研究表明,OA可以通過抑制SREBP-1及其下游基因的表達抑制大腸癌脂質代謝,進而抑制大腸癌細胞生長。RA-XII可下調SREBP-1的表達,抑制大腸癌的生長和轉移[55]。淺藍菌素(cerulenin)可抑制FASN的表達,抑制大腸癌細胞的增殖、促進大腸癌細胞的凋亡[56]。膳食纖維發酵產物丁酸鹽是一種治療腫瘤的候選物質,最新的研究結果表明,丁酸鈉(sodium butyrate,NaB)可激活誘導結直腸癌細胞自噬,其作用機制為激活AMPK、促進ACC的磷酸化,進而引起自噬蛋白表達升高[57]。n-3多不飽和脂肪酸(n-3PUFAs)存在于多種食物中,朱文勁等[58]研究表明,n-3PUFAs可以顯著的抑制N-甲基-N-亞硝基脲誘導的FASN的表達升高,進而降低大鼠大腸腫瘤的發生率。
貝母素乙(peiminine)是從浙貝母(Fritillaria thunbergii)中提取出的一種化合物,研究表明,其可以改變大腸癌細胞的脂質代謝,進而促進大腸癌細胞的凋亡[59]。木犀草素(luteolin)是一種黃酮類化合物,Manju V等[60]研究顯示,其可以通過抑制脂質過氧化反應,進而發揮預防和治療大腸癌作用。此外,聚戊烯醇(polyprenol)[61]、白藜蘆醇(resveratrol)[62]和冬青素A(ilexgenin A)[63]均具有顯著的降脂作用。靈芝提取物(Ganoderma tsugae)[64]能有效地抑制 SREBP-1 的活性,發揮抗癌效果。肉桂酸甲酯(methyl cinnamate)[65]可下調 SREBP-1的表達,進而抑制脂肪細胞的分化。上述這些化合物可能具有潛在的抗大腸癌作用。
4 總 結
脂質代謝已被證實參與到腫瘤細胞生物學的多種代謝途徑過程中,其生物合成、攝取及修飾不僅影響腫瘤細胞的增殖和存活,同時也通過更復雜的信號通路影響腫瘤細胞的遷移、侵襲及腫瘤血管生成等。目前,一些脂肪酸代謝酶和轉錄因子抑制劑,已開始了臨床前及臨床抗腫瘤治療研究,以腫瘤脂類異常代謝通路及相關酶為靶點的天然活性化合物的篩選及新藥的開發,也將為大腸癌的治療開拓新的領域。

