碘催化下磺酰肼對氧化吲哚的高區域選擇性硫醚化反應
王福祥,陳蔚林,申 雁,曹 泳
(安徽省化工研究院,安徽合肥230041)
氧化吲哚是一類重要的含氮雜環化合物,具有抗癌、抗艾滋、抗結核、抗瘧疾、調節孕酮受體等多種藥物活性[1]。對簡單氧化吲哚進行化學修飾可以改進其藥物性質,因而引起了很多化學家的關注。在此方面的一個重要研究方向是對氧化吲哚的C-5 位進行選擇性碳-氫鍵官能團化反應,已報道過直接酰化、烷基化、鹵化、硝化、羥基化、磺化和硫氰化[2-8]等反應。在此,我們報道一個氧化吲哚的高區域選擇性硫醚化反應。
硫醇、二硫化物、硫基氯、锍鹽、磺酰氯等傳統硫醚化試劑存在氣味惡臭、對空氣敏感、遇水分解、價格昂貴等缺點,在反應中常過量很多,適用底物范圍小,生成的副產物對環境不友好。2013 年,我們報道了磺酰肼與吲哚在碘的催化下于乙醇中進行高區域選擇性的硫醚化反應,副產物是水和氮氣,對環境友好[3]。這個反應也可以在離子液體/酸[4]或者水[5]中進行。由于肼基的存在,磺酰肼中硫原子價態的降低并不需要外加的還原劑。此外,磺酰肼價廉易得,通常以固體的形式存在,無惡臭氣味,對空氣和水穩定,易于實驗操作。基于上述優點,磺酰肼很快被多個研究組用于芳香胺[6]、芳基醚[7]、酚[12a,13]、芳烴[13]、苯并[b]呋喃[8]、吡唑啉酮[9]、咪唑并[1,2-a]吡啶[13a,10]、氨基吡唑[11]并[1,5-a]嘧啶[12]等芳香體系在多種反應條件下的硫醚化反應[13]。受到這些研究工作的鼓舞,我們希望能夠將磺酰肼用于氧化吲哚的硫醚化反應,為氧化吲哚的結構修飾提供新方法。
1 實驗步驟
磺酰肼與氧化吲哚的高區域選擇性硫醚化反應的實驗方法:在10 mL 的反應管中依次加入磁子、氧化吲哚1(0.20 mmol)和磺酰肼2(0.24 mmol),然后加入DCE(0.5 mL),最后加入碘(15.24 mg,0.06 mmol)加熱至90℃或120℃(油浴溫度)下攪拌28~72 h。反應結束冷卻后,用薄層色譜法進行分離,洗脫液極性為石油醚/乙酸乙酯(15∶1~3∶1),濃縮后得到純品3。
2 結果與討論
2.1 反應條件的優化
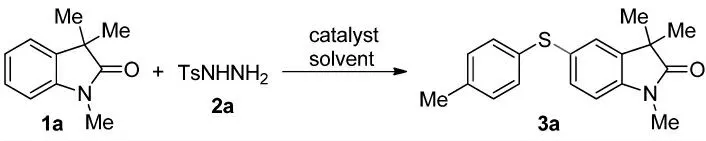
圖1 10 mol%碘催化磺酰肼2a 與氧化吲哚1a在1,2-二氯乙烷中的硫醚化反應
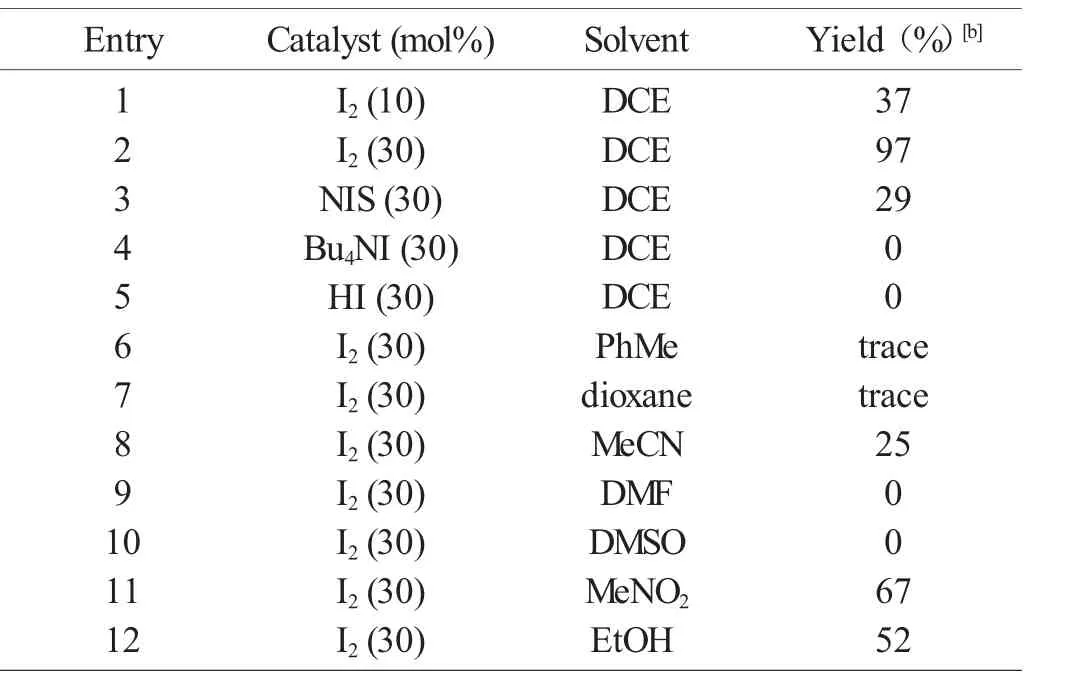
表1 反應條件的優化[a]
我們利用10 mol%碘催化磺酰肼2a 與氧化吲哚1a在1,2-二氯乙烷中的硫醚化反應(圖1),將溫度升高至90℃時可以得到預期產物,即二芳基硫醚3a,是單一區域異構體,但產率只有37%(表1,Entry 1)。將碘的用量提高到30 mol%時,產率可以提高到97%(表1,Entry 2)。換用NIS、Bu4NI 或者HI 作為催化劑時,得到很低的產率或者觀察不到預期產物的生成(表1,Entries 3~5)。我們還篩選了一些常見溶劑,但得到的產率很低,甚至在一些情況下沒有預期產物的生成(表1,Entries 6~12)。
2.2 氧化吲哚底物普適性的考查
在30 mol%碘的存在下,多個芳基磺酰肼可以與氧化吲哚1a 發生高區域選擇性的硫醚化反應,產率優秀(圖2,3a~3f)。但在同樣的反應條件下,烷基磺酰肼與氧化吲哚1a 不能生成相應的硫醚產物。盡管N-芳基氧化吲哚含有兩個N-酰基苯胺結構單元,我們只得到一個硫醚異構體產物(3 g),也沒有觀察到雙硫醚化產物。在氧化吲哚1a 中C-3 位引入五元螺環后,發生硫醚化反應的產率比較低;而引入六元螺環后,得到優秀的產率(3h 和3i)。將氧化吲哚1a 中C-3 位一個甲基更換為芳基硫甲基后,可以順利進行硫醚化反應,區域選擇性極高,產率優秀(3j)。在氧化吲哚1a 中C-3 位引入芳基后,反應活性降低,將反應溫度升高到120℃才能有效地發生硫醚化反應,得到極高的區域選擇性和良好的產率(3k 和3l)。

圖2 磺酰肼對氧化吲哚的硫醚化反應
上面用于合成二硫醚3j 的底物,即氧化吲哚1e,可由N-芳基丙烯酰胺4a 與磺酰肼在同樣的反應條件下制備[19i],于是我們設想:從N-芳基丙烯酰胺4a 出發,可以一鍋、兩步地合成二硫醚3j(圖3)。在實驗方面,我們將N-芳基丙烯酰胺4a 與兩當量磺酰肼2c 混合,在上述標準反應條件下以極高的區域選擇性和87%的產率得到二硫醚3j。

圖3 由N-芳基丙烯酰胺4a 合成二硫醚3j
在上述標準反應條件下,3,4-二氫-2(1H)-喹啉酮也能與磺酰肼發生高區域選擇性的硫醚化反應,產率中等(圖4)。然而,一些其他含有N-酰基苯胺結構單元的底物并不發生硫醚化反應。這些底物包括:在N-位無取代基的氧化吲哚(1h 和1i)、在C-3 位沒有兩個取代基的氧化吲哚(1j 和1k)、非環狀N-酰基苯胺(7a和7b)、菲啶-6(5H)-酮(8a)以及4,5-二氫-1H-苯并[b]氮雜-2(3H)-酮(9a)(圖5)。

圖4 嘗試的其他底物
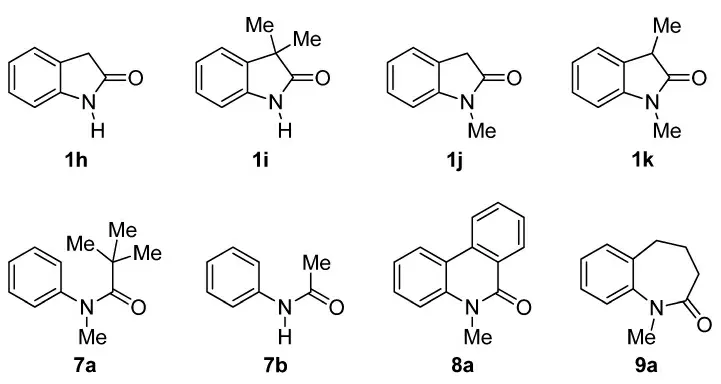
圖5 不發生硫醚化反應的底物
我們向磺酰肼2a 與氧化吲哚1a 的反應混合物中加 入1 當 量2,2,6,6- 四 甲 基哌 啶-1- 氧 自 由 基(TEMPO),能夠以84%的產率得到硫醚3a(式1)。這個結果允許我們推斷該反應不大可能按自由基機理進行。

根據實驗結果和以前的文獻報道[19-21],我們提出如下反應機理(圖6):首先磺酰肼在碘的作用下生成亞磺酸10 和硫基碘11,兩者發生取代反應而生成硫代磺酸酯12,再發生還原反應就轉化為二硫化物13[19i]。硫代磺酸酯12 發生逆反應,或者二硫化物13 與碘作用,都可以轉化為親電性更強的硫基碘11。氧化吲哚1 與硫基碘11 發生區域選擇性芳香親電取代反應,經由帶正電荷的中間體14 而生成硫醚3。能否生成硫醚3 及產率的高低取決于中間體14 的穩定性。可以增強中間體14穩定性的一些因數如下:①在底物N-位的烷基有推電子誘導作用,而在N-位的芳基有共軛作用;②在底物C-3 位的烷基通過碳-氫鍵與帶正電荷的芳環產生σ-π 超共軛作用[14];③在底物C-3 位的芳基與帶正電的芳環產生π-π 堆垛作用[15]。一些含有N-酰基苯胺結構單元的底物(圖4,1h~1k,7a,7b,8a 和9a)缺乏這些結構因數,從而不能與磺酰肼發生硫醚化反應。

圖6 推測的反應機理
3 結論
本文我們首次報道了磺酰肼對氧化吲哚的硫醚化反應。在30 mol%碘的存在下,一些N,3,3-三取代氧化吲哚可以與芳基磺酰肼發生硫醚化反應,區域選擇性極高。此外,該硫醚化反應條件成功地拓展到二氫喹啉酮,但不適于非環狀N-酰基苯胺。這些研究工作拓展了磺酰肼硫醚化反應的應用范圍,也為氧化吲哚的結構修飾提供了新方法。

