全自動QuEChERS樣品制備系統結合高效液相色譜-串聯 質譜法檢測植物源性食品中34種農藥殘留
陳 婷, 續艷麗, 張 文, 閆 君, 彭 濤
(蘭州市食品藥品檢驗所, 甘肅 蘭州 730050)
近年來,隨著科技的快速發展和人類生活水平的不斷提高,人們對食品安全問題越來越重視。我國作為農藥生產和使用大國,農藥在農作物的增產增收方面發揮著重要作用[1],但大量農藥的不合理應用,已對生態環境和人體健康造成極大威脅,農藥殘留作為食品安全中的突出問題[2,3],備受廣大民眾關注。一些國際組織,如國際食品法典委員會和歐盟也已制定了食品中農藥殘留的最大殘留限量(MRLs),并不斷開發新的技術方法加強對食品中農藥殘留的檢測工作[4,5],確保食品安全和保障人類健康。
農藥種類繁多、理化性質各異,涉及的樣品基質復雜,農藥殘留在測定之前,需經過萃取、凈化、濃縮等復雜的前處理步驟,因此建立一種高效、快速、安全、成本低廉的多殘留前處理方法具有重要意義。目前,農藥殘留檢測樣品的前處理方法主要有凝膠凈化色譜法(GPC)[6]、基質固相分散萃取法(MSPD)[7]、固相萃取法(SPE)[8]等,這些方法雖然有效,但是前處理過程消耗大量有機試劑,耗時且耗力,在檢驗檢測中的應用存在一定局限性。由Anastassiadas等[9]提出的QuEChERS技術,因其簡單、快速、高效等優點,已成為農藥殘留快速前處理技術的首選。目前相關研究主要集中在對QuEChERS技術的優化方面,如通過不斷優化提取溶劑、分散固相萃取凈化劑的種類和加入量等[10-13],充分實現操作的方便性和良好的重復性,而對改進QuEChERS前處理操作方式的研究較少。據統計,農藥殘留檢測樣品前處理的時間約占整個檢測時間的2/3[14],其中手動QuEChERS處理由于人員操作差異會加大實驗結果的不穩定性,影響檢驗結果的準確性,因此需要一種更為快速高效的操作方式來進行QuEChERS前處理。
因此,本文通過評估和驗證全自動QuEChERS樣品制備系統,建立植物源性食品中多種農藥殘留的前處理方法,并結合高效液相色譜-串聯質譜技術進行定性及定量檢測,對手動QuEChERS法和全自動QuEChERS法同時測定不同基質中多農藥殘留含量進行了比較,為植物源性食品安全評估檢測工作提供技術支持。
1 實驗部分
1.1 儀器、試劑與材料
Waters Iclass/Xevo TQD高效液相色譜-串聯質譜儀(配有電噴霧電離(ESI)源、三重四極桿線性離子阱質量分析器及MassLynx 4.1工作站,美國Waters公司); Centrifuge 5810R高速離心機(德國Eppendorf公司); VORTEX-5渦旋混勻器(海門市其林貝爾儀器制造有限公司); ME204/02電子天平(美國梅特勒公司); KS501搖床(德國IKA公司)。
SiO-6512 QuEChERS全自動樣品制備系統(配有渦流振動離心機、12位均質離心轉子、均質分離工作站)購自北京Ability公司。
乙腈、丙酮、甲醇(色譜純,德國Merck公司);實驗用水(美國Millipore公司);提取劑包(4.0 g無水硫酸鎂、1.0 g氯化鈉、1.0 g檸檬酸鈉、0.50 g檸檬酸二鈉)、無水硫酸鎂、N-丙基乙二胺(PSA)、石墨化炭黑(GCB)、聚丙烯整合管、ZrO2珠包(北京Ability公司); 34種農藥標準品(純度≥95%,德國Dr. Ehrenstorfer公司)。
1.2 標準溶液的配制
標準儲備液的配制:精密稱取10 mg(精確至0.01 mg)農藥標準品,分別置于10 mL容量瓶中,根據標準品的溶解性和測定的需要,選用丙酮或者甲醇稀釋并定容至刻度,于-18 ℃避光保存待用。
混合標準工作液:根據每種農藥在檢測器上的響應值,準確移取一定體積的農藥,分別置于25 mL容量瓶中,用甲醇稀釋并定容至刻度,配制成質量濃度為1~350 μg/L的混合標準工作液,于4 ℃避光保存。取陰性樣品制備空白基質溶液,過0.22 μm微孔濾膜后,于4 ℃保存備用。
1.3 實驗方法
1.3.1手動QuEChERS方法
準確稱取10 g試樣(含水量>10 g/100 g)或2 g試樣(含水量≤10 g/100 g)(精確至0.01 g),置于50 mL離心管中,加入10.0 mL乙腈、提取劑包、1顆陶瓷均質子,劇烈振蕩10 min,以3 900 r/min離心5 min,吸取6 mL上清液,置于內含凈化劑(通用凈化劑為0.6 g MgSO4、0.1 g PSA;茶葉等顏色較深的樣品凈化劑為0.6 g MgSO4、0.1 g PSA、0.02 g GCB)的QuEChERS凈化管中,渦旋混勻1 min,以3 900 r/min離心5 min,準確吸取1.0 mL上清液,過0.22 μm微孔濾膜,待LC-MS/MS測定。
1.3.2全自動QuEChERS方法
準確稱取10 g試樣(含水量>10 g/100 g)或2 g試樣(含水量≤10 g/100 g)(精確至0.01 g),置于整合管外管,依次加入5 mL超純水、ZrO2珠包(24粒)、10.0 mL乙腈、提取劑包。將裝有凈化劑(同1.3.1節)的內管置于整合管中,將整合管放入SiO-6512主機中,運行。運行方法為以1 100 r/min振動5 min;以4 000 r/min離心10 min;以1 100 r/min振動5 min;以4 000 r/min離心5 min。程序結束后取出整合管,準確吸取1.00 mL上清液,過0.22 μm微孔濾膜,待LC-MS/MS測定。
1.4 分析條件
1.4.1色譜條件
色譜柱:ACQUITY UPLC BEH C18柱(100 mm×2.1 mm, 1.7 μm);柱溫:30 ℃;流動相:(A)乙腈和(B)0.1%(v/v)甲酸水溶液;流速:0.3 mL/min。梯度洗脫:0~0.5 min, 5%A; 0.5~8.5 min, 5%A~95%A; 8.5~10.0 min, 95%A; 10.0~12.0 min, 5%A。進樣量:1.0 μL。
1.4.2質譜條件
離子源:ESI源,正離子模式;離子源溫度:150 ℃;掃描方式:多反應監測(MRM)模式;去溶氣溫度:400 ℃;去溶氣流速:850 L/h;毛細管電壓:3.00 kV;錐孔電壓:45 V;碰撞氣:高純氬氣(99.999%)。34種農藥的質譜參數見表1。
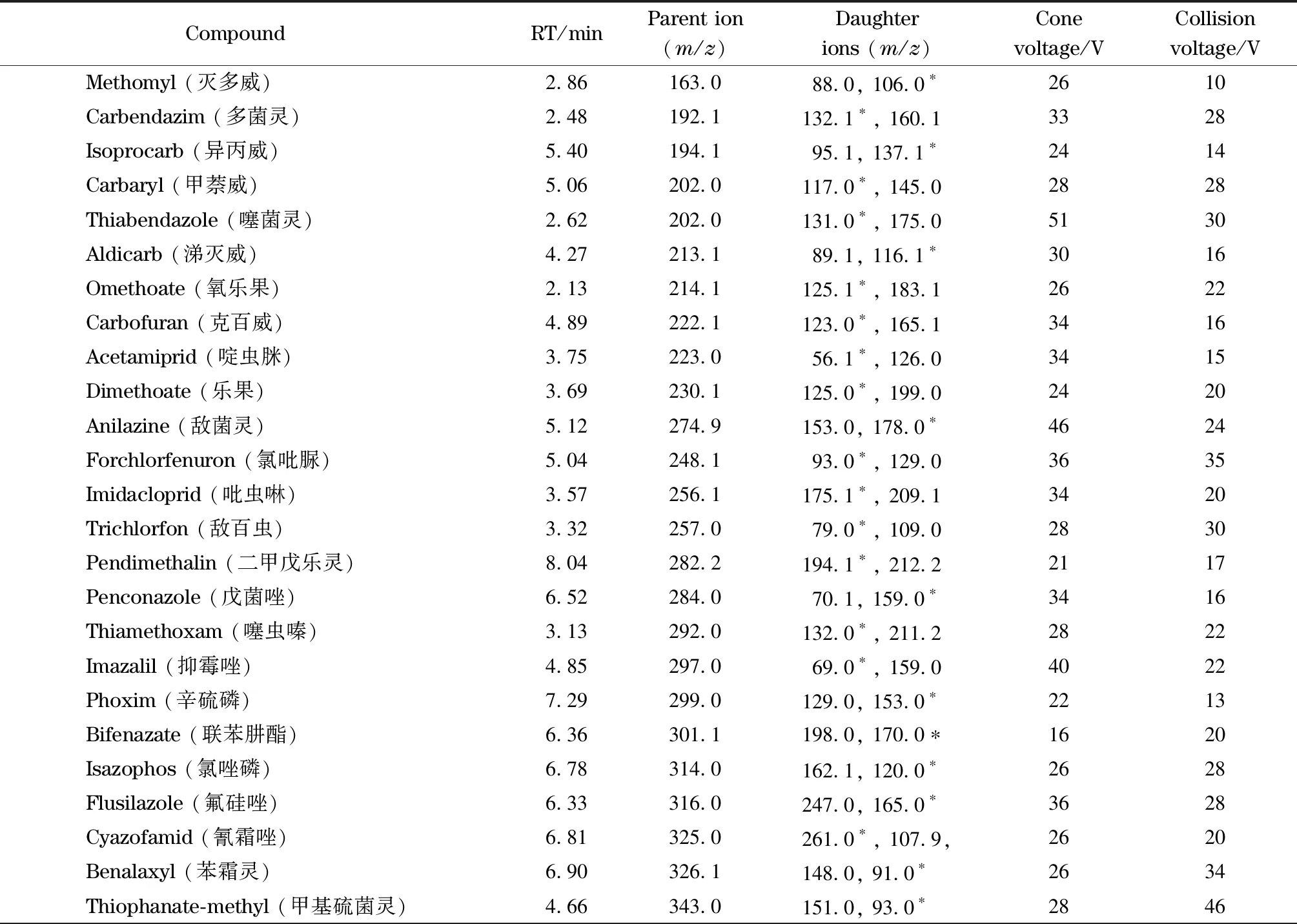
表 1 34種農藥的保留時間(RT)及質譜參數Table 1 Retention times (RTs) and MS parameters of the 34 pesticides
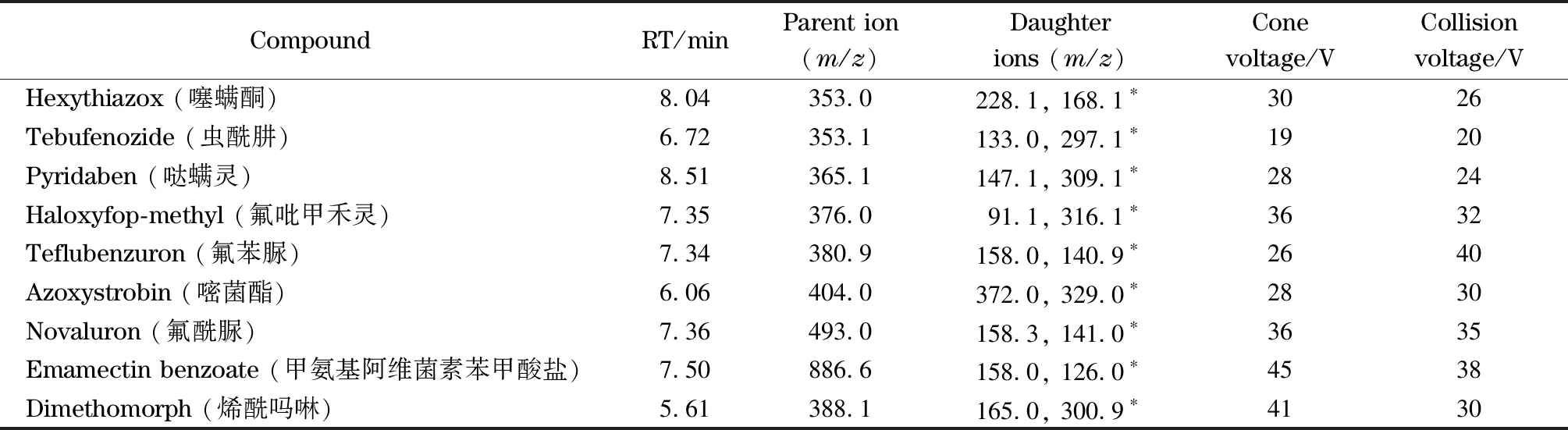
表 1 (續)Table 1 (Continued)
* Quantitative ion.

圖 1 采用不同流動相時34種農藥的總離子流色譜圖Fig. 1 Total ion chromatograms of the 34 pesticides with different mobile phasesa. methanol-water; b. methanol-0.1% (v/v) formic acid aqueous solution; c. acetonitrile-0.1% (v/v) formic acid aqueous solution.
2 結果與討論
2.1 流動相的選擇
比較了甲醇-水、甲醇-0.1%(v/v)甲酸水溶液和乙腈-0.1%(v/v)甲酸水溶液3種流動相對各化合物分離效果的影響(見圖1)。結果顯示:甲醇-水作為流動相時,抑霉唑、噻菌靈色譜峰拖尾,烯酰嗎啉、甲氨基阿維菌素苯甲酸鹽無響應,原因是水相條件下不利于目標化合物的電離,減弱了目標化合物在色譜柱上的保留性,從而降低了靈敏度;甲醇-0.1%(v/v)甲酸水溶液為流動相時,氧樂果、多菌靈分離效果較差,烯酰嗎啉響應明顯降低;乙腈-0.1%(v/v)甲酸水除個別化合物響應略低外,其余化合物與采用甲醇-0.1%(v/v)甲酸水時差別不大。甲酸的加入明顯提高了靈敏度,且乙腈與甲醇相比具有更強的反相洗脫能力,在保證目標化合物響應值和分離度的前提下優化了目標化合物的色譜峰形。因此本實驗選擇乙腈-0.1%(v/v)甲酸水作為流動相。
2.2 前處理條件的優化
2.2.1樣品加水量
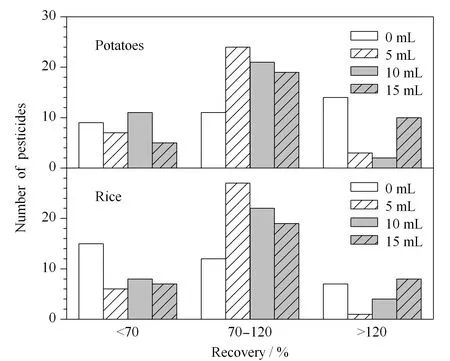
圖 2 不同加水量對馬鈴薯和大米中34種農藥回收率的影響Fig. 2 Effects of the different water addition on the recoveries of the 34 pesticides in potatoes and rice
依據歐洲標準[15]中采用QuEChERS法提取農藥時的含水量要求,適量的含水量有利于目標農藥的提取,可顯著提高被提取農藥的回收率。通過調整樣品加水量考察含水量對被測樣品檢測結果的影響。本實驗取陰性樣品馬鈴薯(含水量>10 g/100 g)10 g和大米(含水量≤10 g/100 g)2 g,分別加入0、5、10和15 mL水,按1.3.2節處理后進樣,并計算加標回收率(見圖2)。結果表明:不添加水時,馬鈴薯和大米試樣中各農藥組分加標回收率均不穩定,且含水量較少的大米試樣經處理后進入凈化管的上清液體積少于1 mL,不利于后續上機實驗;加水量為5 mL時,各農藥加標回收率在70%~120%范圍內的農藥數量明顯增多;當加水量超過5 mL時,會造成QuEChERS提取劑包過載,影響液液分配效率,導致回收率過高或過低。對于含水量較少的大米試樣,為達到較好的回收率,稱取10 g需相應提高加水量,但水量過高會造成整合管過載且不利于后續提取。因此,綜合考慮不同食品含水量的差異,對于含水量>10 g/100 g的試樣選擇每10 g試樣加水5 mL,含水量≤10 g/100 g的試樣選擇每2 g試樣加水5 mL,以保證所有農藥都能獲得較好的回收率。
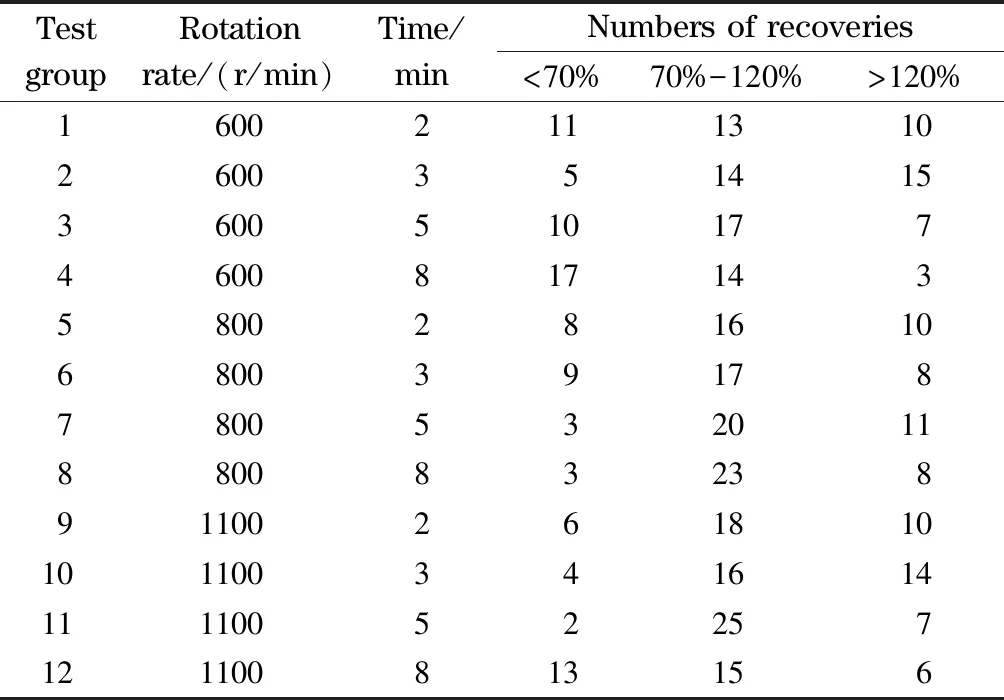
表 2 實驗方案設計Table 2 Experimentation design
2.2.2提取轉速與時間的優化
QuEChERS全自動樣品制備系統將提取、離心及凈化過程整合,使其在盡可能短的時間內從復雜的基質中高通量分析農藥殘留。實驗對第一階段振蕩轉速和提取時間進行了優化,選取振蕩轉速700、900和1 100 r/min,提取時間2、3、5和8 min,進行實驗組合處理(見表2),分析不同實驗組對各目標化合物回收率的影響。結果表明,當振蕩轉速為1 100 r/min時,提取5 min足以獲得滿意的回收率,當提取時間繼續增加后,回收率并沒有明顯的提高。因此選擇振蕩轉速1 100 r/min,振蕩時間5 min。
2.3 基質效應(ME)
本實驗通過比較橘子、茶葉、大米、馬鈴薯、洋蔥空白基質溶液配制的混合標準溶液與乙腈配制的混合標準溶液的斜率,評價基質效應[16]。公式為ME=(mmatrix-msolvent)/msolvent×100%。其中,mmatrix、msolvent分別為基質標準曲線和溶劑標準曲線的斜率。當|ME|<20%時可忽略不計;當|ME|為20%~50%時表示有基質效應;當|ME|>50%時表示基質效應較強。實驗結果可以看出,全自動QuEChERS法的基質效應與手動QuEChERS法差別較小,絕大多數農藥的ME值為負數,表現出基質抑制作用。在全自動QuEChERS法中,約70%的農藥表現出較低的或可忽略的基質效應,25%表現出中等強度基質效應,5%表現出較強基質效應;而手動QuEChERS法中,約60%的農藥表現出較低的或可忽略的基質效應,30%表現出中等強度基質效應,10%表現出較強基質效應。本實驗采用對應的基質配制標準曲線進行校正,一定程度上減弱了基質效應對目標化合物的影響。
2.4 方法的線性范圍、檢出限及定量限
本實驗用橘子陰性樣品基質配制不同質量濃度的混合標準溶液,以化合物的質量濃度為橫坐標(x, μg/L)、定量離子對的峰面積為縱坐標(y)建立標準曲線。向陰性樣品中添加標準曲線最低濃度的混合標準溶液,在本文優化的前處理方法和儀器條件下,通過調整各目標化合物的添加濃度,得到各目標化合物響應為3倍和10倍信噪比(S/N)時對應的含量,作為檢出限(LOD)和定量限(LOD)。結果顯示:目標化合物在一定范圍內具有良好的線性關系,手動QuEChERS法和全自動QuEChERS法相關系數(R2)均大于0.99。手動QuEChERS法LOD為0.81~3.90 μg/kg, LOQ為2.43~11.70 μg/kg;全自動QuEChERS法LOD為0.76~3.60 μg/kg, LOQ為2.28~10.80 μg/kg,相比手動QuEChERS法,全自動QuEChERS法的檢出限及定量限均低于手動QuEChERS法,結果見表3。
2.5 方法的回收率及精密度
采用全自動QuEChERS方法,選用不含待測農藥的陰性樣品馬鈴薯和大米,向其中添加10.0、50.0和100.0 μg/kg 3個水平的混合標準溶液,每個加標水平做5次平行試驗,計算樣品加標回收率,結果見表S1(詳見http://www.chrom-China.com)。各農藥回收率為53.0%~125.2%, RSD<15.9%。
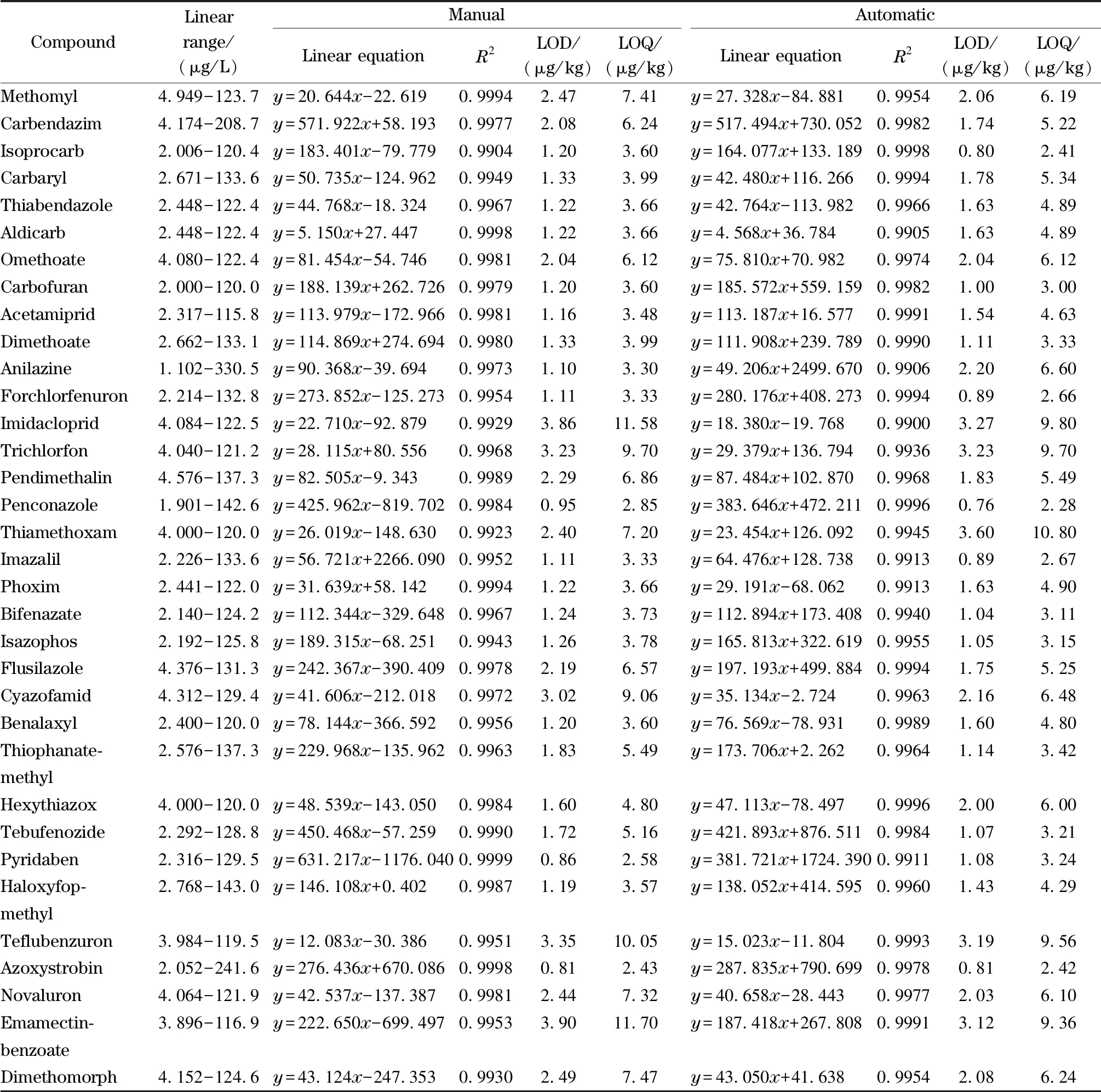
表 3 采用手動和全自動QuEChERS法時34種農藥的線性范圍、線性方程、相關系數、檢出限和定量限Table 3 Linear ranges, linear equations, correlation coefficients (R2), LODs and LOQs of the 34 pesticides by manual or automatic QuEChERS
y: peak area;x: mass concentration, μg/L.
為了驗證不同基質的回收率效果,選用不含待測農藥的陰性樣品(橘子、綠茶、大米、馬鈴薯、洋蔥),分別向其中添加50.0 μg/kg水平的混合標準溶液,對手動QuEChERS法和全自動QuEChERS法進行比較(見圖3)。結果表明,在橘子、大米、綠茶及洋蔥中,采用全自動QuEChERS法時農藥的回收率略高于手動QuEChERS法;而在馬鈴薯中,采用手動QuEChERS法時農藥的回收率略高于全自動QuEChERS法,可能是由于基質效應或含水量差異的影響。除噻蟲嗪外,全自動QuEChERS法與手動QuEChERS法相比大部分農藥的回收率差異不大,均能滿足回收率要求。相比手動QuEChERS法,全自動QuEChERS法在滿足實驗室日常檢測的同時能夠降低勞動強度,節約時間,提高檢驗效率。
2.6 實際樣品檢測
為了進一步驗證方法的可行性,應用所建立的全自動QuEChERS法對市售豇豆、芒果、大米等植物源性食品中34種農藥殘留進行了檢測。結果在豇豆、芒果、辣椒和芹菜中分別檢出多菌靈、氧樂果、克百威和烯酰嗎啉,且含量與手動QuEChERS法相近,相對誤差<17.3%(見表4)。
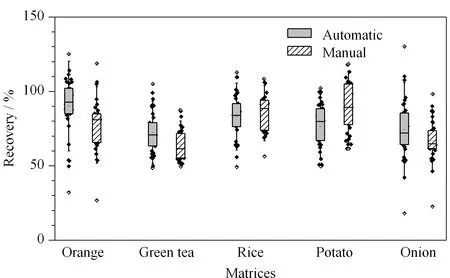
圖 3 采用全自動和手動QuEChERS法時5種基質中農藥(50.0 μg/kg)回收率的箱線圖Fig. 3 Boxplot of the recoveries of pesticides (50.0 μg/kg) in five matrices using the automated and manual QuEChERS method

表 4 實際樣品檢測結果Table 4 Test results of real samples
3 結論
本文利用全自動QuEChERS樣品制備系統結合LC-MS/MS,建立了針對植物源性食品中34種農藥的定性定量檢測方法,與手動QuEChERS法比較,大部分農藥回收率差異不大,但全自動QuEChERS方法實現了化合物提取與凈化一步完成,方法時間短、人為影響因素小,在保證檢驗結果準確性的同時大大提高了檢測效率。通過方法學考察和加標回收試驗,表明該方法具有良好的回收率和精密度,可作為農藥殘留檢測的參考方法應用于日常檢測中。

