XRCC4基因多態性與肝癌發生、發展的關系
胡建敏 譚桂花
肝癌(hepatocellular carcinoma,HCC)是當前比較危重的疾病,5年生存率不足5%,我國每年死亡病例接近60萬[1-2]。我國肝癌發病率東南沿海地區高于內地,且當前的發病率和死亡率均呈上升趨勢。肝癌預后差的主要原因是癌細胞增值快,且容易侵犯門靜脈導致肝內播散,出現肝內高轉移率[3-4]。肝癌的發病機制仍不清楚,臨床上認為該病是由遺傳和環境因素之間聯合作用引發的復雜疾病,具有很強的家族聚集性,有接近大約300余種肝癌的易感候選基因[5-6]。肝癌的發生與發展反映在基因及分子水平上主要與原癌基因的激活、抑癌基因的失活、DNA修復基因的改變等有關。DNA修復基因也稱為XRCC4(X線交叉互補基因-4)是涉及惡性腫瘤發生多個環節的重要基因[7]。XRCC4定位于人染色體5q13.q14,是DNA連接酶Ⅳ的輔助因子,能作用于非同源末端連接的連接點,在DNA雙鏈斷裂的完善修復中發揮關鍵的作用[8]。目前對XRCC4研究最為廣泛的單核苷酸多態性(single nucleotide polymorphisms,SNP)位點為Ale247Ser,已廣泛開展了XRCC4 Ale247Ser與乳腺癌、膀胱癌、肺癌、食管癌、胃癌、結腸癌的關聯性研究[9-11],但是與肝癌的發生與發展關系還無相關報道。本文具體探討了XRCC4基因多態性與肝癌發生、發展的關系,希望能為肝癌的流行病學研究提供病因線索。現總結報道如下。
1 資料與方法
1.1 研究對象
采用回顧性、病例-對照的研究方法,研究時間為2014年5月至2018年2月,選擇在我院腫瘤科進行診治的肝癌患者56例(肝癌組,肝癌診斷依據包括病理組織學/細胞學診斷、血清學定量檢測、肝臟影像學檢查等,乙肝病毒檢測陽性),同期選擇肝癌高危人群120例(高危組,有肝癌家族史,無臨床癥狀的乙肝病毒攜帶者)和健康人156例(對照組,健康獻血人員,乙肝病毒檢測陰性),納入標準:醫院倫理委員會批準了此次研究;臨床資料完整;年齡20~75歲;入選者簽署了知情同意書;未經放療、化療或生物治療等干預措施的處理。排除標準:心、肝功能不良者;妊娠、哺乳期者;患急性感染性疾病者;心腦血管意外患者。
1.2 XRCC4基因多態性檢測
所有入選者在晨起空腹取舒適體位,肘前靜脈無菌采血5~8 ml后,采用QIANGEN血液基因組DNA提取試劑盒提取外周血淋巴細胞的DNA。使用DNA MAN軟件設計待測多態性位點的PCR擴增引物及單堿基延伸引物,XRCC4 Ale247Ser引物序列為:正向引物:5‘-ACGTTGGATGAGGGCCCCAGTTTTTTAGAC-3’,反向引物:5‘-ACGTTGGATGCCCGGCCTCAACAAATGTAT-3’。探針和引物由大連TAKARA公司設計和提供,嚴格按照實驗說明進行操作。5 μl反應體系:2×Mix 2.5 μl,40×Mix Kit 0.115 μl,模板DNA 1 μl,ddH2O 1.385 μl,PCR條件:40個循環,95 ℃ 10 min,92 ℃ 15 s,60 ℃ 1 min。擴增產物片段長度為186 bp。
所有入選者的血糖、血脂指標由我院檢驗科統一檢測(奧林巴斯全自動生化分析儀),同時記錄所有入選者的性別、年齡、體重指數、HBsAg、吸煙、飲酒等資料。
1.3 統計方法

2 結果
2.1 基本特征對比
三組入選者的性別、年齡、體重指數、血糖、血脂等對比差異無統計學意義(P>0.05),肝癌組的吸煙、飲酒比例高于高危組與對照組,高危組高于對照組,對比差異都有統計學意義(P<0.05),見表1。
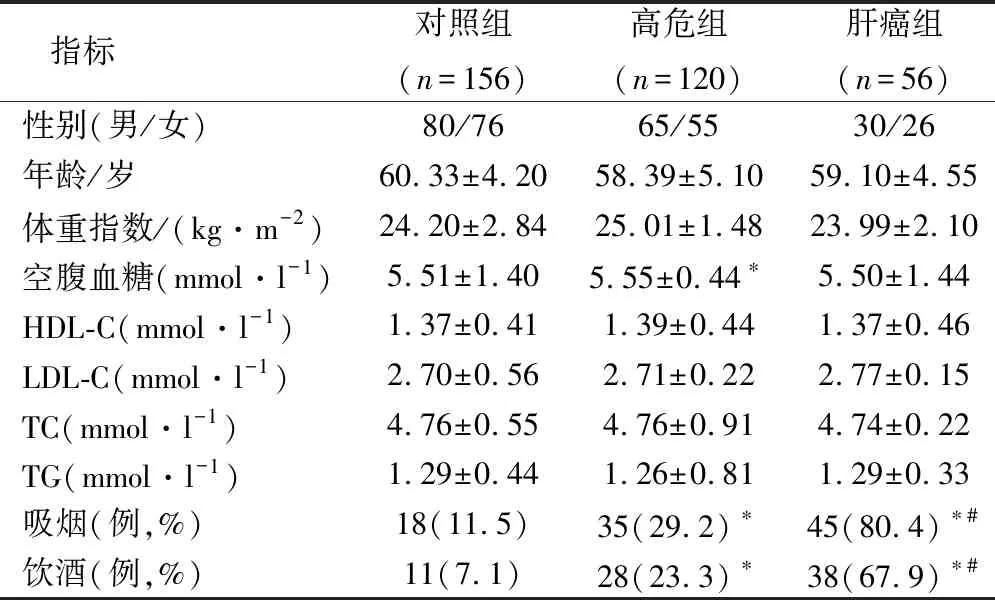
表1 三組入選者的基本特征對比
注:*與對照組對比,P<0.05;與高危組對比,#為P<0.05。
2.2 XRCC4基因型與等位基因分布
三組入選者的基因型分布均符合Hardy-Weinberg 遺傳平衡(P>0.05),Ale247Ser位點的3種基因型CC、CT、TT和等位基因C、T在肝癌組、對照組、高危組之間的頻率分布差異無統計學意義(P>0.05)。見表2。
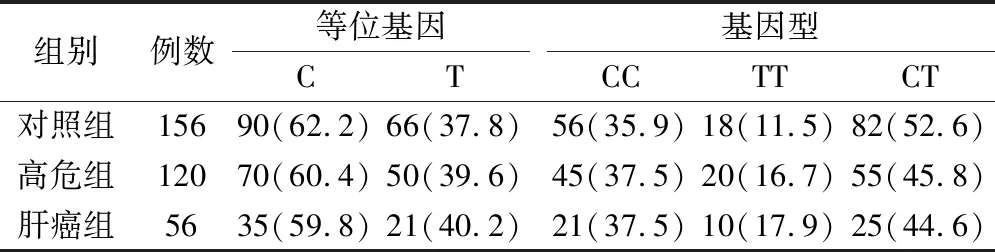
表2 三組入選者的Ale247Ser位點基因型及等位基因分布對比(例,%)
2.3 相關性分析
在校正了年齡、性別、體重指數、血糖、血脂等混雜因素后,二元logistics回歸模型顯示與C等位基因相比,T等位基因入選者肝癌患病OR值為0.992;與CC基因型相比,攜帶CT、TT、CT+TT基因型的入選者肝癌患病OR值為0.872、0.983和0.911。見表3。

表3 不同XRCC4基因型入選者的肝癌患病風險(n=332)
3 討論
肝癌是惡性度極高的腫瘤,具有病情進展快、侵襲性強、起病隱匿、潛伏期長、易轉移等特點,嚴重威脅著人們的健康及生命[12]。肝癌的發生是多種因素綜合作用的結果,其中基因是1個重要的因素,基因作為重要的內源性因素對肝癌的形成具有重要的作用[13]。
人類正常細胞中存在完整的DNA修復系統,通過多種DNA修復通路逆轉DNA損傷,以維持基因的穩定性與正常的細胞進程[14]。DNA修復通路的獲得性、遺傳性缺陷將破壞基因的完整性,使細胞向惡性轉變,可顯著影響個體對腫瘤的易感性[15]。XRCC4是第1個被分離出來的影響細胞對電離輻射敏感性的哺乳類動物的修復基因,是1種重要的DNA修復基因,可廣泛參與DNA損傷的修復,是1種重要的DNA修復基因。XRCC4可參與因電離輻射和氧化損傷引起的堿基切除修復和DNA單鏈斷裂修復,其表達異常和多種惡性腫瘤的發生相關[16-17]。XRCC4全長33 kb,編碼633個氨基酸,包含17個外顯子,包括CAAT盒、N端區、CREB位點和尚未明確的轉錄結合位點。XRCC4基因的SNP位點比較多,主要位于XRCCI的編碼區。其中Ale247Ser位點位于XRCC4基因第6外顯子區域,第194密碼子位點C-T的變異,可導致相應密碼子丙氨酸-絲氨酸(Ale-Ser)的改變的變化[18]。本研究顯示三組入選者的基因型分布均符合Hardy-Weinberg 遺傳平衡(P>0.05),Ale247Ser位點的三種基因型CC、CT、TT和等位基因C、T在肝癌組、對照組、高危組之間的頻率分布差異無統計學意義(P>0.05)。有學者對我國140例肝癌患者和536例對照的研究表明,在病例和對照組中,399Arg/Gln+Gln/Gln的基因型頻率分別為48.6%和32.5%,對比差異有統計學意義(P<0.05)[19]。攜帶399Gln等位基因為肝癌的風險OR值為2.481,且與甲胎蛋白有聯合作用,OR值為2.06[20]。
肝癌是多因素、多步驟、多基因、長期發展而成的,即在HBV感染及甲胎蛋白異常這兩個主要風險因素以外,還有吸煙、飲酒以及遺傳背景等因素[21]。特別是個體是否患肝癌不僅取決于環境因素,在很大程度上還取決于遺傳易感性[22]。SNP是人類長期進化過程中由于環境的選擇形成的基因點的突變,人群中的發生頻率大于1%,是指基因組水平上由單個核苷酸變異引起的DNA序列多態性,包括單堿基的變化以及單堿基的插入/缺失等表現形式[23]。本研究顯示二元logistics回歸模型顯示與C等位基因相比,T等位基因入選者肝癌患病OR值為0.992;與CC 基因型相比,攜帶CT、TT、CT+TT基因型的入選者肝癌患病OR值為0.872、0.983和0.911。XRCC4是KuTO/KuSO介導的DNA末端結合復合物的一部分,XRCC4與DNA連接酶Ⅳ有密切關系,能增強DNA連接酶Ⅳ的活性[24-25]。不過本研究未在動物水平進一步驗證XRCC4的功能,另外在機制研究方面還有待進一步深入,將在后續的工作中進行完善。
綜上所述,肝癌患者可表現為XRCC4基因多態性,XRCC4 Ale247Ser可導致肝癌的患病風險發生變化,可參與調節肝癌的發生與發展。

