抗SOX1抗體陽性副腫瘤性小腦變性1例并文獻復習
金夢華, 白樹風, 翟明明, 程麗妞
副腫瘤綜合征(paraneoplastic neurologic syndrome,PNS)是指在惡性腫瘤患者體內,由腫瘤細胞產生的抗體或介導的細胞免疫作用于遠離腫瘤原發部位或轉移部位的器官或組織而導致的一系列神經系統功能障礙的疾病[1,2]。副腫瘤綜合征發病率低,僅見于1%~3%的腫瘤患者[3],早期表現不典型,極易造成漏診和誤診。我們報道1例曾被誤診為視神經脊髓炎,但最終被確診為副腫瘤性小腦變性的患者。患者以“頭暈、視物不清、行走不穩”為主要臨床表現,通過血清查出抗SOX1抗體陽性,結合患者病史及血清神經特異性烯醇化酶升高,考慮伴有肺部腫瘤的副腫瘤綜合征可能性極大,肺部CT發現肺占位性病灶,并經活檢證實為小細胞肺癌,最終確診為副腫瘤性小腦變性。抗SOX1抗體陽性的副腫瘤性小腦變性臨床上較為少見,尚未見中文的個案報道。患者從出現臨床癥狀,到最終診斷為副腫瘤性小腦變性經歷了2 m余的時間,所以我們希望通過對該例患者臨床資料分析和總結,提高對該類疾病的認識。
1 臨床資料
1.1 病例介紹 患者,男,53歲。以“頭暈、行走不穩2 m,視物不清1 m,加重15 d余”為主訴入院。入院前2 m患者出現頭暈癥狀,呈間斷性,伴行走不穩,能獨立行走,不伴視物旋轉、惡心、嘔吐等癥狀,至當地縣醫院給予藥物治療(具體不詳),頭暈好轉。入院前1 m患者晨起后出現視物不清,頭暈及行走不穩逐漸加重,行走需攙扶,再次至當地縣醫院,完善頭部核磁共振檢查未見明顯異常。給予“尼麥角林、醒腦靜顆粒”等藥物治療,效果欠佳。轉至某三甲醫院,行頸椎、胸椎核磁共振示:頸椎退行性變。視覺誘發電位示右側中樞病損。診斷考慮視神經脊髓炎可能性大,給予甲強龍500 mg/d沖擊治療5 d,頭暈、視物不清好轉出院。入院前15 d行走不穩癥狀進行性加重,不能獨立行走,伴言語不清、飲水嗆咳。遂至我院住院。既往體健,吸煙史30 y余,戒煙1 m,家族史無特殊。神經系統查體:意識清楚,構音障礙,雙眼可見水平及垂直眼震,左眼外展欠充分,右眼各方向活動充分,雙側咽反射消失,余顱神經查體無異常。雙上肢肌力5級,雙下肢肌力5-級,肌張力正常。雙側腱反射(),雙側病理征(-)。雙側指鼻試驗、跟-膝-脛試驗辨距不良。深淺感覺對癥存在。閉目難立征不合作。腦膜刺激征(-)。SARA評分23分。
1.2 輔助檢查
1.2.1 化驗 血常規、尿常規、血凝、肝腎功能、電解質、血沉、超敏C反應蛋白均基本正常。腫瘤標志物示:CA125、CA199、CEA均正常,入院時神經元特異性烯醇化酶18.74 ng/ml(正常值:0.00~16.30 ng/ml)。腰椎穿刺:腦脊液壓力90 mmH2O,腦脊液常規檢查:細胞總數 0.0020×109/L、白細胞數 0.000×109/L,腦脊液生化:葡萄糖3.88 mmol/L、氯125.00 mmol/L、腦脊液蛋白562.00 mg/L。外院送檢血清抗SOX1抗體陽性,血清及腦脊液抗Hu抗體、抗YO抗體、抗Ri抗體、抗CV2抗體、抗Amphiphysin抗體均為陰性。自免腦相關腦脊液抗體及血清檢測均為陰性。視覺誘發電位正常。神經節苷脂抗體陰性。術后1 m復查神經元特異性烯醇化酶11.77ng/ml。
1.2.2 影像學檢查 頭部核磁共振示:小腦未見明顯異常信號(見圖1)。胸部CT示:左肺上葉舌段軟組織結節,考慮肺癌,建議活檢(見圖2)。患者肺部結節活檢示:小細胞肺癌(見圖3)。全身PET/CT示:T5、右側胸鎖關節放射性增高。
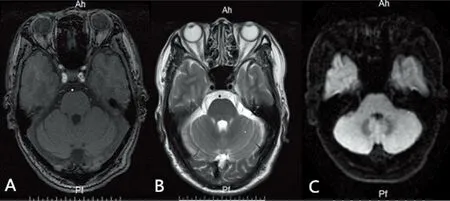
A:T1WI;B:T2WI;C:DWI

圖2 肺CT示左肺上葉舌段占位性病變

A:HE染色×10;B:HE染色×20
1.3 治療及轉歸 患者在我們神經內科給予丙種球蛋白(400 mg·kg·d)靜脈點滴5 d,遂轉胸外科行胸腔鏡肺穿刺活檢及左上肺癌根治術,并于術后1 m給予奈達鉑(80 mg·m2·d)聯合依托泊苷(50 mg·m2·d)共5 d化療一次,術后3 m隨訪,言語不清同前,臥床,SARA評分30分,患者由于經濟原因未再行化療。
2 討 論
副腫瘤病變可累及神經系統的任何部位例如中樞神經、周圍神經、神經-肌肉接頭和肌肉[4]。副腫瘤性小腦變性(Paraneoplastic cerebellar degeneration,PCD)是副腫瘤綜合征的常見亞型之一,以小腦共濟失調亞急性發作和進行性加重為主要臨床表現的癌性神經系統并發癥,是涉及中樞神經系統的危害最大的PNS[5]。PCD最多見于小細胞肺癌,其次是卵巢癌、乳腺癌及霍奇金淋巴瘤[6]。PCD起病多早于腫瘤,60%患者在原發腫瘤被發現前數周或數月出現小腦癥狀,主要表現為小腦性共濟失調、眩暈、構音障礙、眼球震顫[7],小腦性共濟失調在數周或數月內進行性加重,最終導致患者臥床不起。早期腦CT、MRI檢查多為正常,僅18F-脫氧葡萄糖(18F-FDG)PET顯像提示小腦葡萄糖高代謝[8]。晚期MRI可見腦干、小腦萎縮,(18F-FDG)PET檢查示小腦低代謝[9,10]。腦脊液壓力不高,常規、生化檢查正常或蛋白輕度增高。本例報告中的患者即亞急性起病,進展性病程,臨床表現為共濟失調、眼球震顫、構音障礙、眩暈、視物不清。該例患者臨床表現完全符合亞急性小腦變性這個經典綜合征的癥狀。
PNS的相關抗體分為針對細胞內、硬膜上抗原的神經細胞內抗原抗體和針對抗突觸受體及其他神經元細胞表面蛋白的神經細胞表面抗體[11]。與PCD相關的抗體有近30余種。經典抗體抗Yo抗體、抗Tr抗體、抗Hu抗體、抗Ma抗體陽性在PCD的診斷中具有重要意義[6,12,13]。2005年Graus等在小細胞肺癌相關的PNS患者血清中發現了一種能特異結合小腦浦肯野細胞層Bergmann星形膠質細胞核的自身抗體,將其命名為抗膠質細胞核抗體(anti-glial nuclear antibody,AGNA)[14],隨后研究發現SOX1為AGNA相應的抗原。大約22%~32%的小細胞肺癌患者抗SOX1抗體陽性[15,16],Sabater等研究表明在小細胞肺癌存在的情況下,SOX1抗體的產生是由于對細胞膜離子通道的自身免疫反應增強所致[17]。Titulaer等提出SOX1抗體可作為Lambert-Eaton肌無力綜合征(Lambert-Eaton Myasthenic Syndrome,LEMS)合并小細胞肺癌患者的獨立預測因素,但該抗體陽性與患者生存率無關[18,19]。本次報道的患者抗SOX1抗體陽性,NSE升高,高度懷疑相關腫瘤為肺癌,最終經肺占位活檢證實為小細胞肺癌。在血清或腦脊液中檢測相關抗體不僅為尋找潛在腫瘤提供指導,而且也為接下來的檢查及治療指導方向,提高副腫瘤綜合征的診斷水平。
目前存在證據支持PCD發病機制與神經系統自身免疫有關[20]。PCD病理學特點為小腦浦肯野細胞大量丟失,膠質細胞增生,深部血管周圍淋巴細胞浸潤[21]。副腫瘤綜合征的診斷標準參考2004年國際神經學家小組制定的PNS診斷標準[22]。確診標準:(1)一種神經綜合征(經典或非經典),具有特征良好的硬腦膜抗體(anti-Yo,Hu,Ri,CV2,Ma2,或兩棲動物蛋白)的典型綜合征,伴或不伴癌癥;(2)一種經典綜合征,在診斷出神經癥狀后5 y內發展為癌癥;(3)一種非經典綜合征,有單抗體(經典或非經典),在診斷神經疾病后5 y內發展為癌癥。本例報道的患者表現為典型的小腦綜合征,隨著抗SOX1抗體與肺癌的發現,本病例符合PCD的確診標準。
目前對于PNS的治療主要包括潛在腫瘤治療、免疫抑制治療及對癥支持治療。Ronnyson等認為對細胞內抗體相關的副腫瘤綜合征,與細胞表面抗體相關的副腫瘤綜合征治療方面并不完全一致。對細胞內抗體相關的副腫瘤綜合征早期發現腫瘤并治療為最有效的治療方法[11]。Graus等研究表明腫瘤治療是病情改善或穩定的獨立預測因子[23]。對尚未檢測到腫瘤或腫瘤治療后臨床癥狀未改善患者,大多數臨床醫生認為進行免疫抑制治療也是合理的[11]。而細胞表面抗體相關副腫瘤綜合征對于免疫抑制劑的反應相對較好。急性期首選一線免疫抑制治療,(皮質類固醇、靜脈注射免疫球蛋白、血漿交換)。一線免疫抑制治療效果不佳,可選用二線免疫抑制治療(環磷酰胺、環孢素、利妥昔單抗)。Titulaer等研究表明接受免疫抑制治療和腫瘤切除的抗NMDAR腦炎患者,24 m后隨訪時81%患者臨床癥狀出現明顯改善[24]。據報道,在PCD早期使用IVIG聯合類固醇可能有幫助[25]。
總之,在我們臨床工作中當患者出現頭暈、視物不清、行走不穩、眼震等癥狀,輔助檢查排除其他疾病(小腦梗死、感染及中毒性小腦病變、小腦轉移瘤、遺傳性小腦變性等)后,要考慮到副腫瘤小腦變性的可能。懷疑PNS的患者,完善腫瘤標志物檢查,NSE升高的患者,盡早完善肺部CT,并盡早完善副腫瘤相關抗體(血清及腦脊液),常見抗Yo抗體、抗Tr抗體陰性時,要考慮到抗SOX1抗體。必要時行FDG-PET檢查篩查潛在腫瘤。原發腫瘤可在PNS后數年才出現,對未檢測出腫瘤的患者,應密切監測,定期隨訪。盡早明確診斷,爭取更多時間治療腫瘤,減少對神經功能的損害。

