胸腔鏡肺段切除術在治療早期非小細胞肺癌中的應用
劉宗昂,張蘇寧
(中國醫科大學附屬盛京醫院第三胸外科,沈陽 110004)
肺癌是嚴重威脅人類健康的惡性腫瘤,全球每年約有1 800萬人診斷為肺癌,約1 600萬人因該疾病死亡。由于存在地區差異,5年生存率為4%~17%[1]。其中,非小細胞肺癌(non-small cell lung cancer,NSCLC)占肺癌的80%~85%[2]。隨著肺癌早期篩查工作的不斷推進,越來越多的早期NSCLC患者被發現。早期NSCLC首選治療方式是手術切除[3]。目前,在精準治療理念的推動下,肺段切除術成為近年來研究的熱點[4-6]。本研究回顧性分析我科采用胸腔鏡肺段切除術與肺葉切除術治療早期NSCLC的應用效果,旨在為早期NSCLC患者術式選擇提供參考。
1 材料與方法
1.1 臨床資料及分組
選取2017年3月至2018年3月于中國醫科大學附屬盛京醫院胸外科就診的早期NSCLC患者72例。其中,29例患者(肺段組)接受胸腔鏡肺段切除術,43例患者(肺葉組)接受胸腔鏡肺葉切除術。納入標準:(1)術前常規檢查無手術禁忌證;(2)術前影像資料提示腫瘤直徑≤2 cm,且無遠處轉移;(3)術后病理證實為NSCLC,且TNM分期為ⅠA2期及更早分期[7]。排除標準:(1)胸部手術史及預判胸腔嚴重粘連、心肺功能不全者;(2)小細胞肺癌、胸部繼發腫瘤、良性腫瘤及病變位于右肺中葉的腫瘤;(3)術前曾接受過放化療;(4)術中由胸腔鏡轉為開胸手術;(5)患者依從性差,無法配合復查及隨訪。入選患者均知情同意并簽署知情同意書。2組患者年齡、性別、病變部位、分期、第1秒用力呼氣量占用力肺活量比值(forced expiratory volume in the first second/forced vital capacity,FEV1/FVC)比較無統計學差異(均P> 0.05)。見表1。
1.2 手術方法
2組均采用靜吸復合全身麻醉,雙腔氣管插管后單肺通氣,健側臥位,于腋下適當墊高胸部。2組均采用完全胸腔鏡三孔法,取腋中線第6或第7肋間1.0 cm觀察孔,腋前線第3或第4肋間3 cm左右主操作孔,腋后線第8或第9肋間2 cm左右副操作孔。
1.2.1 肺段組:明確病變位置,必要時術前行CT引導下Hook-Wire帶鉤鋼絲定位。打開縱膈胸膜,游離暴露靜脈及相關肺裂,解剖顯露葉間肺動脈干并向遠端游離。過程中給予葉間及段間淋巴結采樣并送冰凍病理。以線扎、超聲刀離斷或直線切割縫合器處理靶肺段動脈,分離、阻斷靶段支氣管,脹肺確認后用鏡下切割縫合器予以離斷。解剖、離斷靶段靜脈,低潮氣量高頻通氣漲肺,“膨脹萎陷”法確定段間平面并以電鉤標記,用直線切割縫合器沿標記切開。若無法明確靶段靜脈,先明確確認段間平面再處理靜脈。部分手術由于解剖位置關系,處理順序為:靜脈、動脈、支氣管、段間平面。根據術中淋巴結、病灶及切緣冰凍病理結果,決定是否行肺葉切除。創面止血,檢驗是否漏氣,沖洗胸腔,于觀察孔位置放置引流管(1枚),關胸。
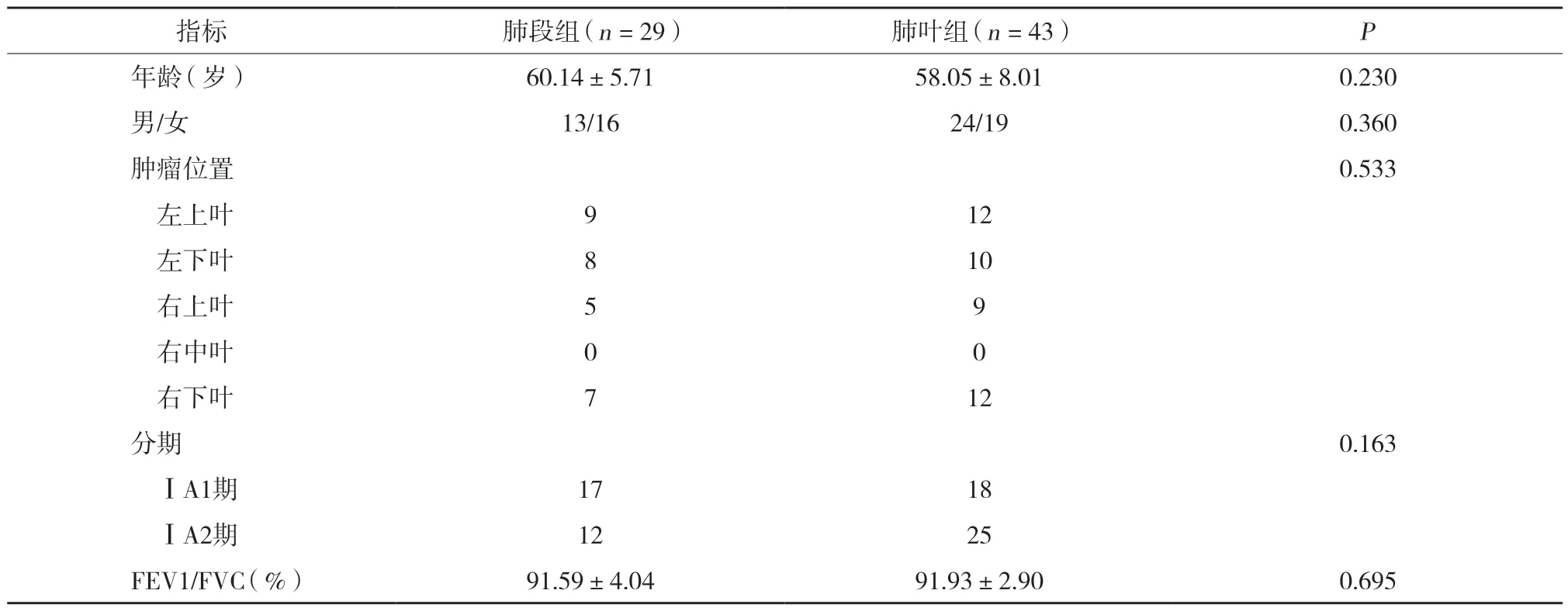
表1 2組患者一般資料比較
1.2.2 肺葉組:直接行常規三孔法胸腔鏡肺葉切除加淋巴結清掃[7]。
1.3 觀察指標
比較2組手術時間、術中出血量、術后總引流量、術前及術后3個月肺功能、術后并發癥等指標,比較2組臨床療效。術后1年內定期隨訪,統計復發(局部及遠處)和死亡患者。
1.4 統計學分析
采用SPSS 20.0軟件分析數據。計量資料以±s表示,組間比較采用獨立樣本t檢驗;計數資料比較采用χ2檢驗,P< 0.05為差異有統計學意義。
2 結果
2.1 2組術中、術后指標比較
結果顯示,與肺葉組比較,肺段組手術時間較長(P< 0.001);而術中出血量、淋巴結清掃數2組比較無統計學差異(均P> 0.05)。術后3個月FEV1/FVC指標肺段組明顯優于肺葉組(P< 0.05);而術后引流量2組比較無統計學差異(P> 0.05),見表2。
2.2 2組并發癥及隨訪結果比較
肺段組中,3例(10.3%)出現術后并發癥,其中肺部感染、心率失常、皮下氣腫各1例。肺葉組中,4例(9.3%)發生術后并發癥,其中肺部感染2例,肺不張1例,切口感染1例。2組并發癥發生率比較無統計學差異(χ2=0.021,P=0.884)。2組術后均隨訪12個月,共12例患者失訪(肺段組4例,肺葉組8例),其他患者隨訪期內均未發生腫瘤轉移或復發,2組均無患者死亡。

表2 2組患者術中、術后指標比較
3 討論
胸腔鏡肺段切除術作為一種新的術式已在許多醫療中心廣泛開展[8]。在治療早期NSCLC方面,目前已有前瞻性研究[9-10]表明胸腔鏡肺段切除術與傳統肺癌根治術在治療效果及預后上無明顯差別。從解剖層面來看,肺段擁有獨立的支氣管及相對獨立的循環血供,符合腫瘤切除原則。另外,肺段切除術需進行淋巴結清掃或采樣,術中進行病理檢測,若術中病理結果發現淋巴結轉移,則需更改手術方式,采取傳統肺癌根治術。眾多研究[3,11-12]提示肺段切除術中淋巴結清掃數目與肺葉切除無明顯差別,還可以清掃到段間淋巴結。雖然肺段切除及肺葉切除均屬于破壞性手術,但肺段切除術在保證完整切除腫瘤的同時保留了更多的肺功能。隨著社會老齡化進程的不斷推進,保留更多肺功能的意義不僅在于提高患者遠期生活質量,同時也提高了原發性再發性肺癌的切除率。本研究結果顯示,肺段組術后3個月肺功能指標明顯優于肺葉組,手術時間略長于肺葉組(均P< 0.05),與以往研究結果一致。而2組術中出血量、淋巴結清掃數目、術后總引流量及術后并發癥方面無統計學差異(均P> 0.05),可見肺段切除術能獲得與肺葉切除術相同的短期療效。
對于肺段手術,術前明確病變位置極其重要。我院常規采用三維CT重建,一方面定位靶肺段,另一方面重建可在術前預判支氣管及靶段肺血管的走行。對于預估術中肉眼及觸診定位困難的磨玻璃結節可采取術前CT引導下彈簧圈或Hook-Wire定位。肺段切除的技術難度在于明確肺實質切除界限,在保證切除范圍的前提下選擇單肺段或聯合肺段切除。主流做法是先充分游離靶段支氣管,離斷前閉合靶段支氣管,然后低潮氣量高頻通氣漲肺,沿塌陷肺實質邊界切除靶肺段。也有研究[13]報道術中通過支氣管鏡明確靶肺段后膨肺,顯露靶肺段的界限。肺段切除術需仔細辨別靶段肺動脈、肺靜脈、支氣管的解剖位置,可根據術中情況決定切除順序。漏氣是肺段手術術后常見并發癥,因此根據實際情況,選擇合適釘高的切割閉合器尤為重要。閉合胸腔前一定要反復驗漏,避免術后持續漏氣。目前對于肺段切除術式選擇的共識[14-16],主要包括:(1)術前評估無法耐受肺葉切除;年齡≥75歲;合并嚴重心腦血管疾病;FEV1占預計值百分比<50%等。(2)多個肺結節且位于不同肺葉;肺葉切除術后再發結節。(3)結節最大徑≤2 cm,位置處在肺外1/3,且在單一肺段內。(4)結節倍增時間≥400 d,胸部CT提示磨玻璃樣結節實性成分>50%,胸部增強CT或PET-CT提示無肺門及縱隔淋巴結轉移。(5)保證切緣距離>2 cm或切緣距離/結節最大徑比值>1。(6)術中冰凍病理提示切緣陰性、淋巴結送檢陰性,術中病理診斷為不典型腺瘤樣增生、肺原位腺癌、微小浸潤性腺癌及貼壁生長為主的浸潤性腺癌。
綜上所述,胸腔鏡肺段切除術手術時間長于肺葉切除術,但隨著技術逐漸成熟手術時間明顯縮短;術后引流量及并發癥比較兩者無明顯差別,符合目前外科精準治療及快速康復的發展理念。因此,對于早期NSCLC患者,肺段切成術能獲得與肺葉切除術相同的短期療效,具備一定安全性及可行性;但臨床上應嚴格把握手術指征,保證腫瘤切除完整性及手術安全性。對于遠期預后及效果目前仍缺乏大規模前瞻性研究,有待進一步驗證。

