狼瘡性腎炎小鼠模型的建立及其鑒定
李艷秋,田淑艷,劉雪,栗霄麗,姚麗,王力寧
(中國醫科大學附屬第一醫院腎內科,沈陽 110001)
系統性紅斑狼瘡(systemic lupus erythematosus,SLE)是嚴重的自身免疫性疾病。SLE使T細胞功能改變和多克隆B細胞活化,伴隨自身抗體[抗雙鏈DNA抗體(double strands DNA,dsDNA)等]產生,從而導致多器官免疫復合物沉積。其中,狼瘡性腎炎(lupus nephritis,LN)是嚴重并發癥,能導致腎功能損傷。人類SLE/LN表型多樣化,臨床上規范分組復雜,因此有關SLE研究多利用動物模型來進行。SLE目前有多種動物類型,包括自發性MRL/LPR、BXSB、轉基因和基因敲除小鼠[1]。本研究擬觀察新西蘭黑鼠和新西蘭白鼠雜交子一代(NZB×NZW,NZB/W F1)小鼠發病過程,建立LN模型,為將來SLE/LN的研究和治療提供理想的動物模型。
1 材料與方法
1.1 LN模型建立
30只8周齡NZB/W F1雌性小鼠購自Jackson實驗室,30只8周齡雌性C57BL/6 小鼠購自維同利華動物有限公司,小鼠均在中國醫科大學實驗動物部繁殖,按照中國國家標準(GB 14925-2001)指導原則,小鼠生存條件:濕度50%±20%,溫度23 ℃±3 ℃,12 h光/12 h暗人工循環,可以自由進食和飲水。本研究獲得中國醫科大學動物保護和使用委員會批準。所有動物均于SPF級飼養至28~36周。
1.2 LN模型鑒定
1.2.1 體質量測定:每周使用電子臺秤測小鼠體質量。
1.2.2 尿蛋白測定:每周對小鼠新鮮尿進行檢測。蛋白尿試紙檢測小鼠尿蛋白嚴重程度:±,5 mg/dL;+,30 mg/dL;++,100 mg/dL;+++,300 mg/dL;++++,1 000 mg/dL[2]。根據尿蛋白嚴重程度將小鼠分為輕度LN(±~+)和重度LN(+++~++++)。
1.2.3 小鼠腎功能測定:小鼠8和28周齡時麻醉、殺滅后取血樣。應用生化自動分析儀檢測小鼠血肌酐及尿素氮。
1.2.4 小鼠血液dsDNA濃度測定:采用ELISA法測定小鼠dsDNA IgG 濃度(美國Alpha Diagnostic International公司),按照說明書進行操作。
1.2.5 腎臟形態學觀察:8周、28周和36周齡時處死小鼠后,立即留取腎臟皮質,2B多聚甲醛固定,常規石蠟包埋切片,進行HE、PAS、MASSON染色,光學顯微鏡下觀察。
1.3 統計學分析
應用SSPS 18.0軟件進行數據處理,計量資料以±s表示,組間比較采用t檢驗,P< 0.05為差異有統計學意義。
2 結果
2.1 2組小鼠體質量比較
結果顯示,小鼠體質量逐漸下降,在22周后趨于穩定。見表1。
2.2 2組小鼠死亡情況
C57BL/6 小鼠實驗期間無死亡。NZB/W F1小鼠28周時死亡10只。其中,26號鼠2周內體質量下降超過20%且尿蛋白(++),處死小鼠(小鼠體質量下降過快是死亡信號,需及時留取活體標本);7號死鼠體質量未下降,解剖發現小鼠發生胸水(700 μL),1周前尿蛋白(++),考慮死因為胸水引起窒息;其他8只小鼠疾病自然病程加重死亡。
2.3 NZB/W F1小鼠LN鑒定
2.3.1 小鼠尿蛋白變化:結果顯示,8、16、24、28周小鼠重度LN所占比例分別為0、10%、25%、40%。隨著周齡增長,NZB/W F1小鼠出現重度LN概率增加。
2.3.2 小鼠腎功能變化:結果顯示,隨著周齡增加,NZB/W F1小鼠腎功能(血肌酐和血尿素氮)、dsDNA水平逐漸升高,28周與8周時比較,與同周齡C57BL/6 小鼠比較均升高明顯(均P< 0.05)。見表2。
2.3.3 小鼠腎臟病理改變:結果顯示,8周輕度LN NZB/W F1小鼠僅部分腎小球系膜增寬,細胞和基底膜基本正常,28周重度LN NZB/W F1小鼠腎小球系膜細胞增生明顯,可見中性粒細胞浸潤,基底膜增厚,伴有部分硬化,36周重度LN NZB/W F1小鼠腎小球增生更加明顯,硬化也開始增加,有大量中性粒細胞浸潤,基底膜僵硬,部分腎小管脫落壞死,36周齡C57BL/6小鼠基本沒有變化,僅腎小球比28周重度LN NZB/W F1小鼠略增大,腎小球與36周重度LN NZB/W F1小鼠大小相同,見圖1。

表1 2組小鼠體質量比較(g)

表2 小鼠血肌酐、尿素氮和dsDNA水平比較
3 討論
NZB/W F1小鼠是新西蘭黑鼠和新西蘭白鼠之間的雜交子一代。雜交在3~4個月時形成高滴度自身抗體水平,產生免疫復合物介導的腎小球腎炎,類似于人類彌漫性增生性腎小球腎炎[3]。
有研究[3]顯示,80%小鼠在8個月時出現大量蛋白尿,90%在12月時死于腎功能不全,因此本研究只觀察至小鼠28周(最多36周)。本研究中NZB/W F1小鼠在12周左右開始出現重度尿蛋白(+++),28周時重度尿蛋白(+++)發生率為40%。22周后小鼠的腎臟功能逐漸下降,病理改變在逐漸加重。研究[4]報道從3~4月起自身抗體滴度和腎功能指標逐漸升高,本研究顯示小鼠28周時 dsDNA和血肌酐已經明顯高于8周齡NZB/W F1小鼠和同齡C57BL/6 小鼠(P<0.05)。 NZB/W F1小鼠腎臟病理呈現典型的彌漫增生性腎小球腎炎,系膜細胞明顯增生,大量中性粒細胞浸潤,系膜基質增加,腎小球彌漫增生,甚至有部分硬化,部分區域基底膜僵硬,有局限性腎小管壞死。而C57BL/6小鼠在36周齡仍然沒有任何病理改變。證明NZB/W F1小鼠LN模型建立成功。
SLE是多基因遺傳疾病,是環境和遺傳等多種因素作用的結果[5]。DNA降解、凋亡[6]、自噬[7]、細胞因子的異常[8]、T細胞和B細胞的異常[9-10]、激素水平異常[11]、基因和表觀遺傳學的關系[12]、基因和基因之間的相互作用[13]等在疾病的發生發展中起重要作用,但是具體病因仍不十分清楚,迫切需要典型動物模型來完成相應的研究課題。國際上大多應用新西蘭小鼠回交造模研究遺傳機制,但是由于價格昂貴國內很少報道。本研究LN模型成功建立證明NZB/W F1小鼠模型具備LN的典型癥狀,可以為LN發病機制和治療研究提供重要依據。
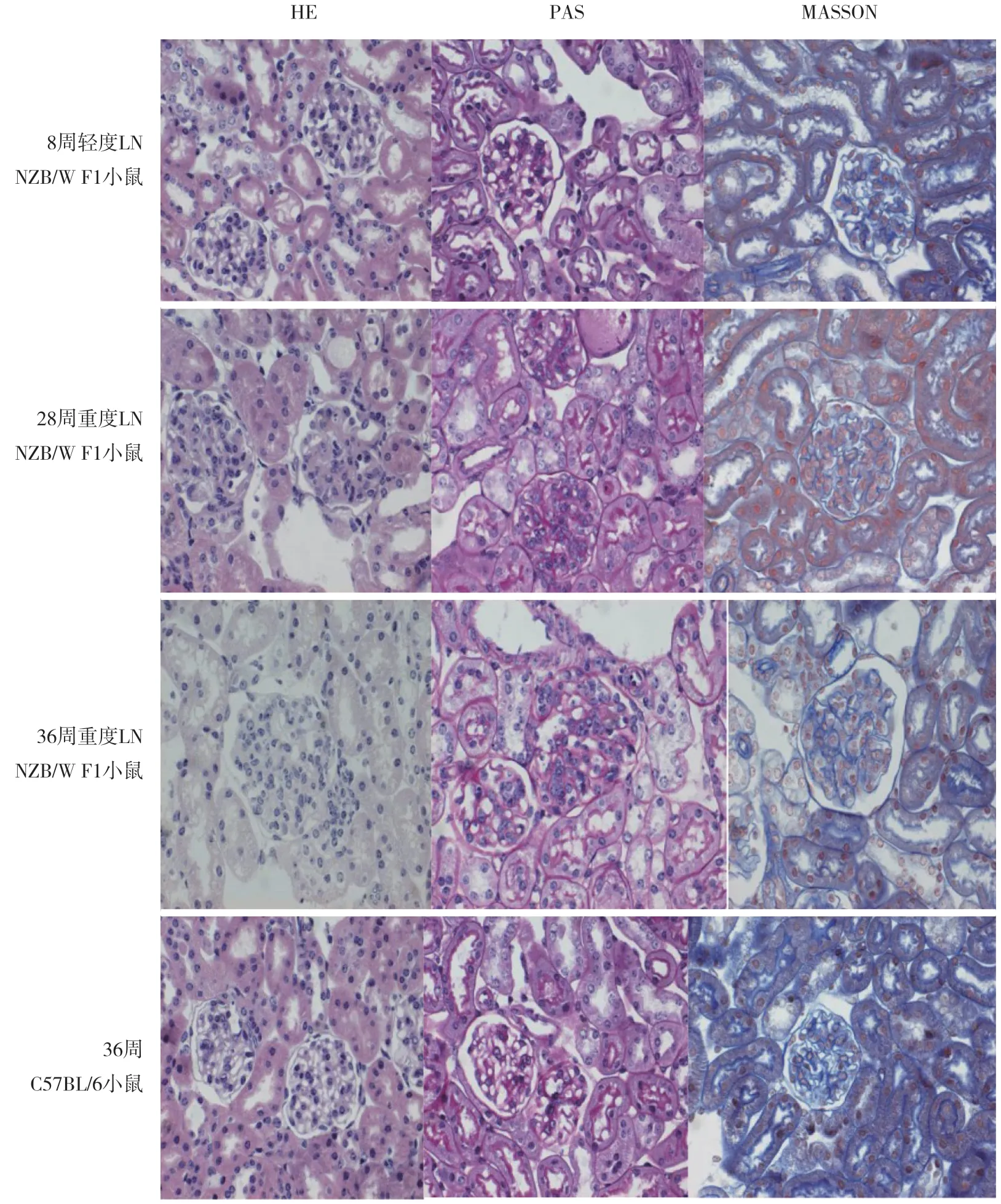
圖1 小鼠腎臟病理結果 x400

