氬氦靶向冷凍和聯合化療治療晚期非小細胞肺癌219例臨床研究
李虎明,韓志海,孟激光,劉振千,李泳群,張春陽
肺癌是嚴重危害人類健康和生命的疾病。我國擁有全球最大的吸煙人群,隨著人口老齡化趨勢及環境污染加重,肺癌已成為我國發病率和死亡率最高的惡性腫瘤。根據文獻報道,2015年我國肺癌的發病和死亡例數分別達733 300人和610 200人[1]。其中,非小細胞肺癌(non-small cell lung cancer,NSCLC)是最常見的肺癌類型,占全部病例的80%~85%。由于早期診斷不足、生物學行為惡劣,肺癌患者臨床診斷時多已為晚期,失去了外科手術機會[2]。且部分患者由于高齡、身體狀況較差、合并心腦血管等慢性疾病而無法耐受外科手術。氬氦靶向冷凍治療是新興的微創治療手段,常應用于肝癌、肺癌、腎癌等實體腫瘤的治療[3-5],有創傷小、痛苦少、精度高、消融徹底的特點。本研究對晚期NSCLC患者行經皮穿刺氬氦靶向冷凍治療,比較單純氬氦靶向冷凍治療和聯合化療患者治療近期局部控制及生存情況,并對聯合化療患者采用Cox回歸模型對相關因素進行分析,尋找影響生存的因素。
1 資料與方法
1.1 一般資料 回顧分析2010年1月—2015年12月中國人民解放軍總醫院第六醫學中心呼吸與危重癥醫學科接受氬氦靶向冷凍治療的219例晚期NSCLC患者,根據治療情況分為2組,單純氬氦靶向冷凍組患者118例,患者因各種原因拒絕化療,并報倫理委員會通過,僅接受氬氦靶向冷凍治療;聯合化療組患者101例,行氬氦靶向冷凍并聯合一線化療方案化療。2組患者均對肺部原發病灶進行氬氦靶向冷凍治療。2組患者一般情況比較差異無統計學意義(P>0.05,表1)。
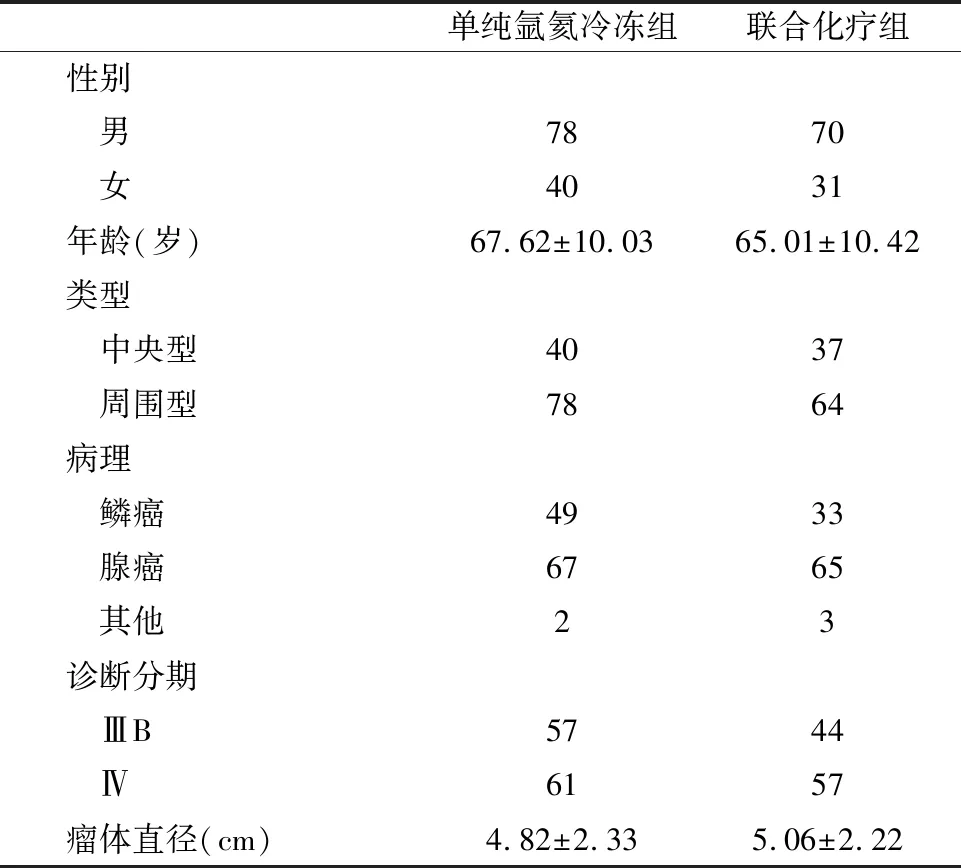
表1 2組患者一般情況
1.2 納入標準及排除標準 納入標準:①經組織學或細胞學確診為NSCLC患者;②腫瘤分期為ⅢB、Ⅳ期的晚期患者,不能行外科手術治療;或者患者全身情況較差,不能耐受外科手術者;③預期生存時間大于3個月;④肝腎功能、凝血功能無明顯異常;⑤心電圖、心功能分級大致正常;⑥患者同意行氬氦靶向冷凍治療并簽署手術同意書。排除標準:①全身情況很差,預期生存時間短;②腫瘤位置不易穿刺,或易損傷重要血管者;③原發灶彌漫分布者;④有明顯肝腎功異常、嚴重出血傾向者;⑤心功能明顯異常,不能耐受治療者。
1.3 儀器設備 采用Cryo-Hit低溫冷凍手術系統(以色列GalilMedical公司),有獨立控制器分別控制的5組集氣管,每組集氣管上可連接5個氬氦刀探針。采用超細1.47 mm尖頭氬氦刀探針。高壓常溫氬氣可在十余秒內達到-165~-100 ℃。刀尖部裝有溫差電偶,可實時監測冷凍溫度。CT機為Somatom螺旋CT機(德國Siemens公司)。
1.4 手術方法 根據腫瘤位置,患者采用平臥位、側臥或仰臥位。利多卡因穿刺點行局部麻醉,依據術前CT定位片所提示的進針方向、角度、深度,將特制氬氦靶向冷凍穿刺針快速刺入腫瘤靶點,再經CT掃描確認穿刺針到達預定位置。沿穿刺針將所選型號的擴張管及導管鞘插入瘤體內。退出穿刺針及擴張管,導管鞘原位保留。沿導管鞘將氬氦刀插入瘤體內,固定氬氦刀,將鞘部分退出。啟動超低溫手術系統,重復冷凍2~3個循環,最后氦氣復溫至0 ℃以上,氬氦刀松動后即可拔刀。術畢常規行CT掃描,觀察冷凍效果、冰球大小及覆蓋腫瘤比例。術中用多功能心電監護儀監測血壓、心率、血氧飽和度等。
患者術后平臥6 h,吸氧,持續心電監護,嚴密觀察患者血壓、心率、血氧飽和度等,觀察有無發熱、咯血、胸痛、呼吸困難。術后常規使用止血藥、抗生素等,預防血胸、氣胸等并發癥。
1.5 化療方案 一般術后3~5 d開始進行,鱗癌采用吉西他濱(1 000~1 250 mg/m2d1、d8)+順鉑(75 mg/m2),即GP方案;腺癌及大細胞癌采用培美曲塞(500 mg/m2d1)+順鉑(75 mg/m2),即AP方案[6]。化療過程中常規給予抗過敏及藥物止吐等對癥支持治療,對于Ⅲ度以上的粒細胞減少患者,給予重組人粒細胞集落刺激因子皮下注射升白細胞治療[7]。
1.6 療效評估及隨訪 患者術后即刻行CT掃描,測定冰球大小及冷凍冰球覆蓋率。術后3個月左右復查CT評估局部控制情況。按實體瘤療效評價標準(response evaluation criteria in solid tumors,RECIST)評價療效[8]。完全緩解(complete response,CR):腫瘤完全消退4周以上,無新病灶;部分緩解(partial response,PR):腫瘤消退超過50%,無新病灶;疾病穩定(stable disease,SD):腫瘤面積減少不到50%或增大未超過25%;疾病進展(progressive disease,PD):腫瘤增大超過25%或出現新病灶;總有效率即[(CR+PR)÷總例數]×100%。遠期療效觀察采用中位生存時間,患者死亡或失訪作為隨訪終點。
2 結果
2.1 腫瘤冷凍冰球覆蓋情況 單純氬氦靶向冷凍組與聯合化療組患者冷凍冰球覆蓋率差異比較無統計學意義(P>0.05);按照瘤體最大直徑分組,單純氬氦靶向冷凍組、聯合化療組其直徑<4 cm患者冰球覆蓋率高于直徑≥4 cm患者,差異比較有統計學意義(P<0.01,表2)。

表2 2組患者腫瘤冷凍冰球覆蓋情況
注:與瘤體直徑≥4 cm患者比較,*P<0.01
2.2 患者治療3個月后局部控制情況 氬氦靶向冷凍治療3個月后復查CT,單純氬氦冷凍組CR 20例,PR 39例,有效控制59例(50.0%),聯合化療組3個月后復查,CR 24例,PR 41例,有效控制65例(64.4%),2組間差異比較具有統計學意義(χ2=4.567,P<0.05,表3)。
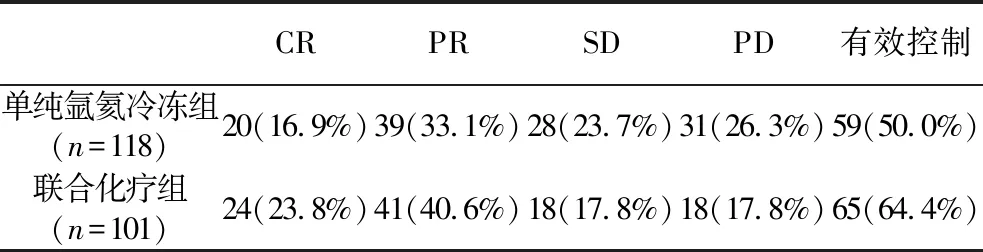
表3 患者治療3個月后局部控制情況[n(%)]
2.3 患者遠期生存情況 患者氬氦靶向冷凍治療后隨訪時間為3~60個月。單純氬氦靶向冷凍組與聯合化療組中位生存時間分別為(15.00±1.48)個月和(20.00±2.21)個月,2組之間差異比較有統計學意義(χ2=6.092,P<0.05),聯合化療組患者的生存時間長于單純氬氦靶向冷凍組患者。生存曲線見圖1。
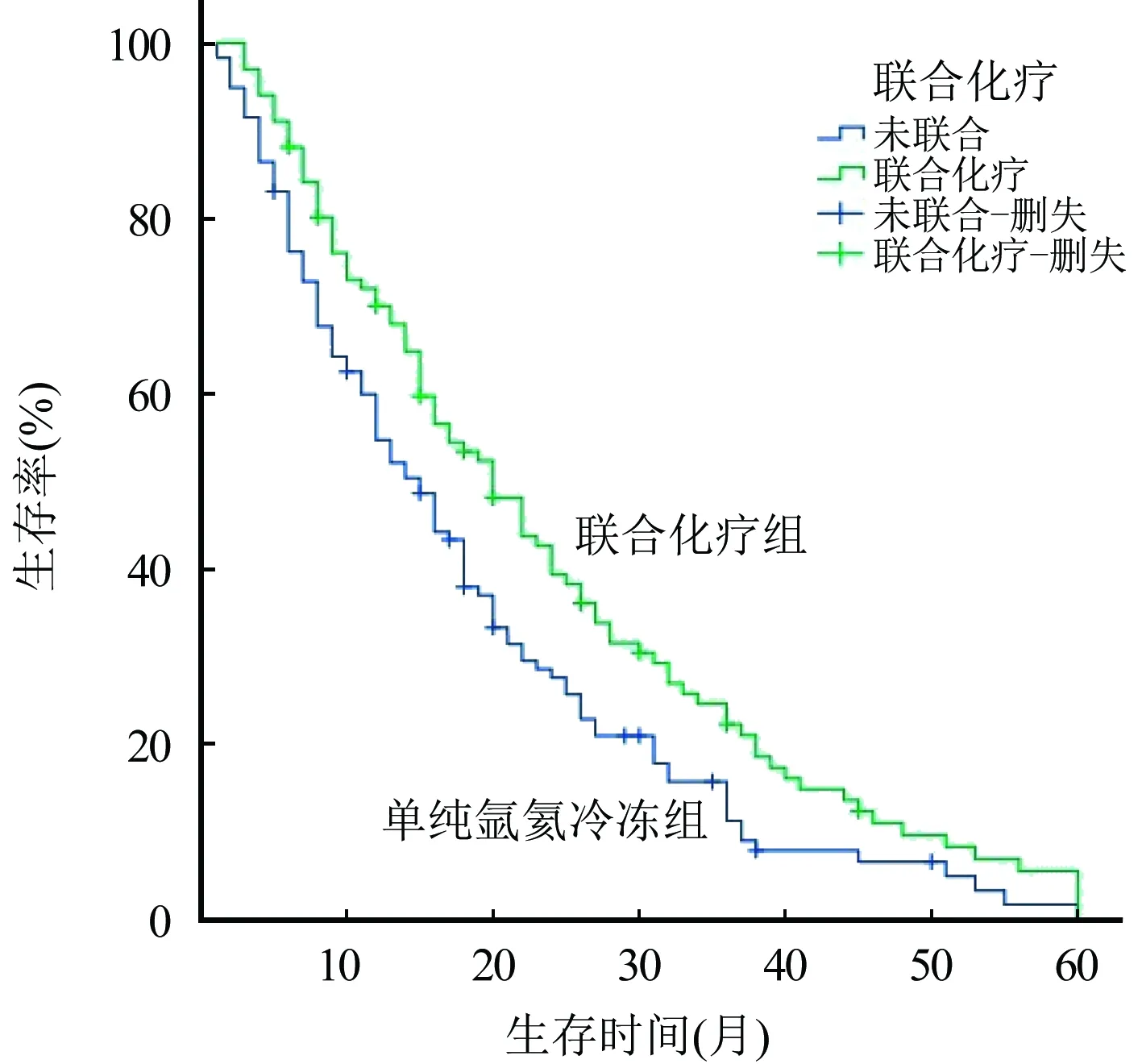
圖1 單純氬氦冷凍和聯合化療組治療晚期NSCLC患者生存曲線
2.4 聯合化療組患者遠期生存多因素Cox分析 對101例聯合化療組患者行單因素分析,腫瘤大小、組織學類型、腫瘤位置、診斷分期及術后控制情況是預后的影響因素,采用Cox回歸模型進行多因素分析顯示腫瘤大小、診斷分期、術后局部控制情況是影響遠期生存率的獨立危險因素(Wald=4.865,Wald=8.175,Wald=5.489,P<0.05)。肺癌分期較早、瘤體較小及近期局部控制較好者相對預后較好。見表4。
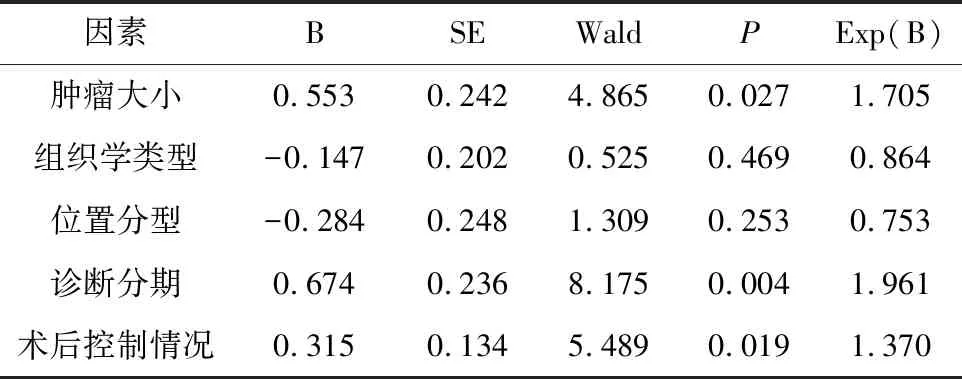
表4 聯合化療組患者遠期生存多因素Cox分析
3 討論
肺癌是中國和世界范圍內發病率和病死率最高的腫瘤,外科手術切除腫瘤被公認為最有效、唯一可根治肺癌的方法,但由于早期診斷不足等原因,多數患者診斷時已為晚期;即便是早期肺癌患者,也有30%的患者因為合并癥、心肺功能不良、高齡等因素而無法手術治療[9]。化學治療通常是晚期或無法手術患者的主要治療方法之一,但目前肺癌化療的效果幾乎達到平臺期,提升空間有限。氬氦靶向冷凍治療無需全身麻醉,恢復較快,患者耐受性好,具有創傷小、痛苦小、消融徹底的特點,并且氬氦靶向冷凍治療時能對腫瘤靶區進行精確控制和監控,減少術中腫瘤周圍正常組織的損傷。氬氦靶向冷凍的局部靶向消融、減輕腫瘤負荷作用在肝臟、肺、腎臟等實體腫瘤有廣泛應用。
氬氦靶向冷凍的作用機制是多方面的:①氬氦冷凍治療可直接摧毀腫瘤細胞,治療通過冰晶形成、復溫解凍、反復凍融而直接引起細胞膜和細胞器等細胞結構的破壞,引起細胞萎縮、破裂,從而導致腫瘤細胞死亡[10]。Hinshaw等[11]研究顯示,在豬肺的模型中-20 ℃是凝固壞死的溫度線,低于-20 ℃時細胞會發生凝固性壞死,并在周邊形成直徑為(2.4±0.2) cm的消融區。②間接損害腫瘤細胞,氬氦靶向冷凍可以損傷血管壁內皮細胞,造成血管通透性改變,甚至形成微小血管血栓,引起局部組織缺血而引起細胞的死亡[12]。③抗腫瘤免疫作用,有學者報道,在氬氦靶向冷凍治療時,腫瘤細胞可損傷破裂,從而使腫瘤組織相關抗原暴露,刺激機體產生特異的抗腫瘤免疫反應,達到治療惡性腫瘤的目的[13]。但氬氦靶向冷凍治療誘發的抗腫瘤免疫作用有較多爭議,一些研究則報道冷凍手術后的免疫反應無明顯增強[14]。本研究中,219例晚期NSCLC患者均行氬氦靶向冷凍治療,單純冷凍治療組與聯合化療組患者冰球覆蓋率差異比較無統計學意義,按腫瘤最大直徑分類,直徑<4 cm患者冰球覆蓋(98.19±0.04)%,直徑≥4 cm患者冰球覆蓋率為(90.74±0.10)%,2組差異比較具有統計學意義(P<0.05),說明腫瘤直徑較小冰球覆蓋較大,冷凍更為徹底。
晚期NSCLC以化療為主的綜合療法,含鉑兩藥聯合化療是主要治療方案。有文獻報道多西他賽和順鉑方案(TP)能延長患者的生存期,使中晚期NSCLC患者的中位生存期延長1~3個月,1年生存率增加10%[15]。氬氦靶向冷凍治療是一種姑息性治療手段,其機制之一是通過損傷血管壁內皮細胞,影響局部組織血供而引起腫瘤細胞凋亡。氬氦冷凍治療時局部的血管破壞是否會影響化療藥物作用?在本研究中,比較近期局部控制情況,術后3個月單純氬氦冷凍治療組有效控制患者59例(50.0%),聯合化療組有效控制患者65例(64.4%),2組間差異比較具有統計學意義(χ2=4.567,P<0.05);比較遠期預后,單純氬氦冷凍治療組中位生存時間為(15.00±1.48)個月,聯合化療組為(20.00±2.21)個月,2組之間差異比較有統計學意義(P<0.05)。本研究中聯合化療組患者在近期局部控制情況和遠期生存時間均優于單純氬氦冷凍治療組,說明化療與氬氦冷凍治療有協同作用,氬氦冷凍治療聯合化療可提高腫瘤的局部控制情況,并能改善患者的遠期預后。Baust等[16]認為冷凍區周邊為非致死溫度,冷凍治療后殘留大量腫瘤細胞,冷凍后腫瘤細胞對化療的敏感性增加,聯合化療可以促進細胞凋亡,殺傷未壞死的腫瘤細胞,從而改善患者局部控制情況,改善患者遠期預后。
對聯合化療組患者行單因素分析,腫瘤大小、組織學類型、腫瘤位置、診斷分期及術后控制情況是預后影響因素,采用Cox回歸模型進行多因素分析顯示腫瘤大小、診斷分期、術后局部控制情況是影響遠期生存率的獨立危險因素。肺癌分期較早、瘤體較小及近期局部控制較好者相對預后較好。腫瘤分期會影響患者生存時間,即分期較早的患者預后較好,這是比較好理解的。瘤體大小是另一個預后的影響因素。對于較小的腫瘤,一般單刀治療就可覆蓋全部腫塊,療效較好。腫瘤直徑較大時,都需要多刀組合冷凍,在多刀組合過程中,難以使冰球全部覆蓋瘤體,導致腫瘤殘留,從而影響手術效果及預后。有文獻報道,腫瘤直徑小于3 cm,患者預后較好[17];Palussière等[18]的研究則表明,直徑小于2 cm是影響生存時間的獨立危險因素。治療后局部控制情況與生存時間有關,局部有效控制的患者預后較好,這與該部分患者局部腫瘤細胞增生、遠處轉移得到有效控制,腫瘤進展變慢有關。有文獻報道腫瘤位置對遠期療效有影響,上肺葉腫瘤因定位容易、活動度較小而療效較好。但本研究中,腫瘤的組織學類型與位置對生存無明顯影響,這與李泳群等[19]的研究報道相一致(P>0.05)。
綜上所述,氬氦靶向冷凍治療是晚期NSCLC患者的有效局部治療手段,氬氦靶向冷凍聯合化療可以改善患者局部控制情況及遠期預后。肺癌分期較早、瘤體較小及近期局部控制較好者相對預后較好。但本研究屬于單中心的回顧性研究,存在樣本量少的影響和一定程度的偏倚,因此需要進一步開展前瞻性、多中心的隨機對照研究。

