《世界衛生組織狂犬病專家磋商會第三版報告》更新與解讀
陳瑞豐
狂犬病是由狂犬病病毒(rabies virus,RABV)感染引起的急性腦炎或腦膜腦炎的一種動物源性傳染病,一旦發病,其病死率幾乎100%,全世界每年因狂犬病致死約59 000人。近年來,狂犬病報告死亡數一直位居我國法定報告傳染病前列,給人民群眾生命健康帶來嚴重威脅,我國也一直是世界衛生組織(World Health Organization,WHO)認定的狂犬病流行高風險國家之一。2017年4月,WHO狂犬病專家磋商會在泰國曼谷召開,2018年4月,WHO公布了《WHO狂犬病專家磋商會第三版報告》[1](以下簡稱“第三版報告”),同時取代了2013年公布的第二版報告[2]。自2005年《WHO狂犬病專家磋商會第一版報告》[3]公布以來,該報告一直是世界范圍內狂犬病免疫、預防和控制方面最權威的指南性文件,對于指導全球范圍預防、控制和消除狂犬病具有舉足輕重的作用。現就《WHO狂犬病專家磋商會第三版報告》主要更新進行解讀,旨在借鑒WHO最新的研究成果和推薦,指導和規范我國的狂犬病免疫預防工作。
1 狂犬病病毒屬組成
RABV和一系列相關病毒(能導致以急性進行性腦脊髓炎為特征的狂犬病)均屬于單股負鏈病毒目、彈狀病毒科、狂犬病病毒屬的RNA病毒。在第二版報告中,提出了14個狂犬病病毒種,其中確定了12個,另2種病毒種已經被發現,但并未明確其宿主動物,確定的12個狂犬病病毒種根據遺傳距離和血清學交叉反應特性,分為遺傳系譜Ⅰ(9個)和系譜Ⅱ(3個)。第三版報告中提出了18個狂犬病病毒種,其中確定了14個狂犬病病毒種,并增加了遺傳系譜Ⅲ,18個狂犬病病毒種分為遺傳系譜Ⅰ(12個)、系譜Ⅱ(3個)和系譜Ⅲ(3個)。
國際病毒分類委員會(International Committee on Taxonomy of Viruses,ICTV)是國際公認的病毒分類命名機構。ICTV最新版《主要物種名錄》發布于2018年3月[4],其中公布了16種狂犬病病毒種(不包括第三版報告中公布的“Taiwan bat lyssavirus”和“Kotolahti bat lyssavirus”,在WHO列表的標注中,此二者血清學證據顯示感染源自肯尼亞,ICTV目前并沒有公布此二者的分類與命名。在ICTV公布的16種狂犬病病毒種中,WHO給出的10種為系譜Ⅰ型、3種為系譜Ⅱ型、3種為系譜Ⅲ型)。
關于狂犬病病毒屬病毒種的命名和確定,是領域內爭議的焦點之一,作者認為,WHO與ICTV公布的差異,源自對狂犬病的持續監測以及新一代測序技術的進步。近年來不斷有新的狂犬病病毒種被發現,也說明對狂犬病病毒屬的認識越來越深入,相信今后還會有新的狂犬病病毒種被發現。就目前ICTV公布的16種狂犬病病毒種,蝙蝠是其中14種病毒的宿主和傳播媒介。雖然伊科馬狂犬病毒(Ikoma lyssavirus,IKOV)和莫科拉病毒(Mokola virus,MOKV)分別在非洲靈貓和鼩鼱、家養貓和嚙齒動物體內分離出來,但其宿主動物仍未知,根據遺傳學距離和血清學交叉反應,有專家認為這兩種病毒可能仍來源于蝙蝠,這些個例可能屬于溢出性感染[5]。所有的狂犬病病毒屬中只有RABV可以在食肉動物中傳播,也是導致人狂犬病病例的最主要的病毒種,食肉動物能保持RABV的長期存在[6]。所有狂犬病病毒屬的多樣性都以蝙蝠為宿主中表現出來,蝙蝠是狂犬病病毒屬的主要進化和自然儲存宿主[7]。
2 人狂犬病的預防
2.1 狂犬病暴露分級 第三版報告在Ⅱ級暴露中增加了一點:“蝙蝠導致的Ⅱ級暴露按Ⅲ級暴露處置”,在Ⅲ級暴露中明確指出“直接接觸蝙蝠屬于嚴重暴露”。從中可以看出,WHO越來越強調蝙蝠在狂犬病暴露中的危險性和重要性[8]。
2.2 暴露類型和犬只特征與發病概率 人狂犬病病例絕大多數(第三版報告的數據是>95%,第二版報告的數據是>99%)是由狂犬咬傷所致。第三版報告指出暴露于RABV的結局取決于幾個因素,包括傷口的嚴重程度、咬傷部位、進入傷口的病毒數量、病毒種別(基因型)以及暴露后預防的及時性,并且第一次提出暴露類型和犬只特征與暴露風險概率(見表1),我國還未有相關報道。
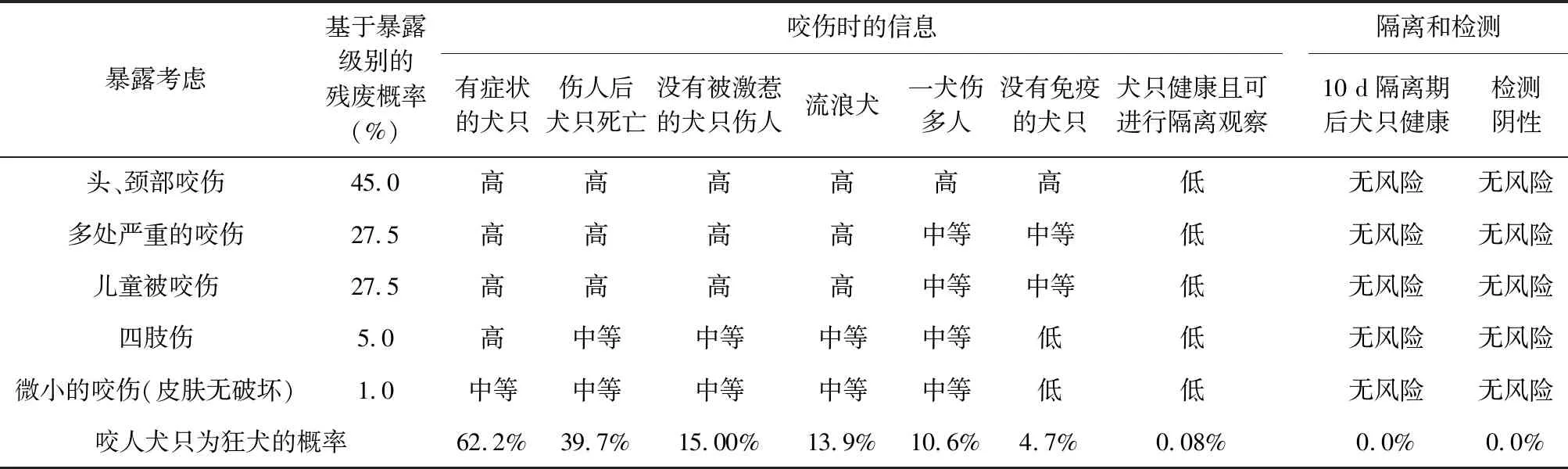
表1 暴露類型和犬只特征與暴露風險概率表
2.3 人用狂犬病疫苗接種方式及接種程序 第三版報告在狂犬病流行地區將狂犬病暴露前預防(pre-exposure prophylaxis,PrEP)納入兒童常規免疫計劃的推薦進行了修改,WHO在研究其效益和相關成本后指出:PrEP作為一種大規模的公共衛生干預措施比預防狂犬病死亡的其他措施昂貴得多,只有在犬咬傷發生率極高的特殊情況下(每年>5 000/10萬人),并且該地區人用狂犬病疫苗接種比例很低、暴露后需要使用狂犬病免疫球蛋白(rabies immunoglobulin,RIG)比例較高的情況下,對全人群進行PrEP才不會增加成本,因此不再進行相關推薦。
第三版報告在人用狂犬病疫苗的接種方式上首次推薦皮內注射(intradermal injection,ID),這是以往報告中所沒有的,這與此次更新的重點及原則相符,即:關注方案的可行性、疫苗接種程序的簡化、成本效益的提高。人用狂犬病疫苗使用方式有肌肉注射(intramuscular injection,IM)和ID兩種,目前絕大部分國家和地區都采用IM方式進行免疫接種,在過去的二十年里,多個臨床研究已經證實ID在狂犬病暴露后免疫預防(post-exposure prophylaxis,PEP)中的免疫原性和有效性,目前ID接種方式已經在多個亞洲和非洲國家使用。ID途徑誘導免疫應答的基礎是:皮膚是機體重要的免疫器官,當抗原呈遞到真皮層時疫苗功效增強。此外,將抗原用于皮膚層有利于它們暴露于多種抗原呈遞細胞,例如巨噬細胞和樹突細胞,這些抗原呈遞細胞在皮膚中的數量多于在肌肉中的數量[9]。與IM相比,盡管ID使用的抗原量較少,但真皮中抗原呈遞細胞可對通過ID的疫苗產生強烈的免疫應答。ID可替代IM為狂犬病疫苗接種提供了一種節約成本和劑量的方案。通過ID進行PEP接種比通過IM至少節約25%的疫苗。隨著就診患者數量的增加,ID方案的成本效益越來越高,使用的疫苗瓶數可以減少85%。另外,第三版報告中明確“即使說明書中沒有明確標注,能夠IM的狂犬病疫苗也可以安全地用于ID使用”。
接種程序上,WHO進行了較大的變更(圖1),WHO在PrEP和PEP疫苗接種方式、接種次數與接種時間上進行了很大的更改和優化,是此版最大的亮點之一。對使用IM和ID途徑進行PEP效果評估的研究表明[10-14],與目前WHO推薦的PEP和PrEP程序相比,可以縮短正在使用的PEP和PrEP程序的持續時間和所需劑量[15-17]。另外,近期在泰國、荷蘭和比利時進行的單次接種人用狂犬病疫苗的研究顯示[18],單次接種疫苗后,99.5%~100%受試者體內的抗體滴度高于0.5 U/mL,并且其所產生的免疫記憶應答可長達1年。盡管這些研究在所包含的年齡組(年齡<50歲)、隨訪時間和不同的血清學試驗時間等方面存在局限性,但證明了單次就診方案可引起充分的機體免疫應答,也說明我們對人用狂犬病疫苗在激活機體免疫應答方面還知之甚少。
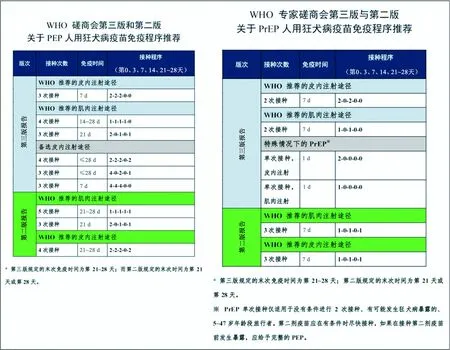
圖1 WHO第三版和第二版報告關于PEP和PrEP程序的推薦
2.4 再次暴露后的加強免疫 第三版報告提出:已免疫的任何年齡段的個體,如果有記錄證明之前進行過PrEP劑次以上的PEP接種,則可不用RIG。如果再次暴露發生在前次暴露后的3個月內,且暴露者在前次暴露后已進行了完整的PEP,那么再次暴露后只需進行傷口處置,不需要接種狂犬病疫苗和RIG。如果再次暴露發生在前次PEP接種的3個月之后,那么之前已免疫的暴露者需要進行再次的PEP,但不需要注射RIG。再次暴露后的免疫預防程序如下。
兩次就診:IM,1-1-0-0-0;ID,1-1-0-0-0(在第0天和第3天通過IM或ID各接種一劑/次人用狂犬病疫苗)。
單次就診:ID,4-0-0-0-0(在第0天,四個點位、皮內注射人用狂犬病疫苗各0.1 mL)。
另外,第三版報告指出:在注射第一劑疫苗的7 d內,通常不會產生有效的免疫反應,因此,如果在此期間發生再次暴露,應給予完整的PEP程序,對于Ⅲ級暴露者,還應使用RIG。沒有完成完整PEP程序者,但如果已經接種過至少兩劑次疫苗,應被認定為具有狂犬病疫苗免疫史者。這種極端狀況雖然不常見,但的確時有發生,以往的報告對此沒有明確的推薦意見。
2.5 狂犬病免疫球蛋白使用 關于RIG使用的最新推薦,也是此版報告的最大亮點之一。RIG在被動免疫中的作用是:接種狂犬病疫苗后,在機體產生有效的中和抗體之前,在暴露的部位提供特異性的狂犬病病毒中和抗體中和RABV。RABV是高度嗜神經性的RNA病毒,它通過破損皮膚或直接接觸黏膜進入機體,在肌肉組織中復制,然后通過運動神經元的終板和軸突到達中樞神經系統。RABV的生物學特性以及狂犬病相對較長的潛伏期為暴露后預防提供了可能性,因此,狂犬病致死率幾乎為100%,而狂犬病又是100%可以預防的疾病。預防狂犬病發生的措施包括:①立即對傷口進行徹底地沖洗和清洗;②盡早進行人用狂犬病疫苗接種;③必要時,盡早在傷口及傷口周圍注射RIG。
關于RIG的使用,一直是研究和臨床的爭議焦點之一。新近的研究顯示,將傷口周圍浸潤后剩余的RIG注射至遠離傷口的肌肉內,與只進行傷口周圍浸潤相比,對于預防狂犬病發生沒有或僅有少量的額外保護作用,剩余的RIG可供其他患者使用,這種做法在RIG供應不足的情況下特別有用[19-22]。第三版報告推薦馬源RIG的最大劑量按40 U/kg計算,人源RIG的最大劑量按20 U/kg計算。如果有許多小的創口,或暴露于蝙蝠,或是咬傷之外的暴露時,推薦將剩余的RIG在盡量靠近暴露部位的周圍進行IM;對于沒有傷口的黏膜暴露,推薦用RIG進行暴露部位的沖洗;對于可疑狂犬病病毒氣溶膠暴露者,推薦RIG IM。已經不再是第二版報告推薦的:馬源RIG使用劑量為40 U/kg,人源RIG的使用劑量為按20 U/kg,所有的免疫球蛋白,如果解剖結構上允許(但避免可能的骨筋膜室綜合征),應仔細地注射到傷口內及傷口周圍。如果有剩余,將其注射到遠離疫苗注射點的肌肉部位。
另外,第三版報告還指出:來自狂犬病流行地區的數據顯示,即使在沒有RIG的情況下,通過立即對傷口進行徹底地沖洗和清洗加盡早接種疫苗并完成PEP,99%以上的患者可以存活。
3 犬狂犬病的預防控制
WHO及其合作伙伴在2015年就已經達成一個戰略目標,即到2030年,在全世界范圍內消除由犬傳播的人狂犬病[23],在第三版報告中用了大量的篇幅來闡述這一戰略目標以及實施方案。狂犬病的預防高度依賴于高危人群對該病的認知,提高認知應包括教育、動物咬傷預防部門的參與、犬主人的責任感、暴露后迅速的急救。這些預防措施對控制其他疾病和咬傷(如:棘球蚴病、利什曼病、鉤端螺旋體病等)也會產生有益的影響。通過在地方性流行地區進行大規模犬狂犬病疫苗接種證實,使犬只的疫苗覆蓋率達到70%即可阻斷RABV在犬只間的傳播,從而拯救人類生命。
另外,第三版報告繼續推薦“10日觀察法”,即,暴露于家養的犬、貓和雪貂后,對傷人動物進行嚴密醫學觀察,10 d后如果動物仍然健康,則證明傷人動物沒有罹患狂犬病的風險。但是第三版報告第一次提出“14日觀察法”這一概念,并且明確這一概念適用于家養犬、貓和雪貂以外的其他動物。
4 其他更新及推薦
4.1 免疫缺陷患者 關于免疫缺陷患者的PrEP和PEP改動也比較大,以往的推薦是:一些對艾滋病病毒攜帶者/艾滋病患者的研究表明,CD4細胞計數非常低的患者RABV的中和抗體反應明顯低下或檢測不到。當這些患者和其他免疫功能不確切的人群發生的Ⅱ級和Ⅲ級暴露,需要在正確徹底的傷口處理和消毒同時,局部浸潤注射人或馬的RIG以及全程5個劑量IM人用狂犬病疫苗。如果可行,在疫苗接種2~4周后檢測RABV中和抗體以評估是否需要額外劑量的疫苗。第三版報告更新體現在:①重新對免疫缺陷患者進行了劃分,并對其免疫效果進行了審視,認為“臨床監測和管理良好的免疫缺陷患者,如接受抗逆轉錄病毒治療的艾滋病毒感染者不被視為免疫功能低下,并且已證實其對狂犬病和其他疫苗可產生正常的免疫應答”。②其PrEP程序的推薦總體原則與常人相同,僅對于“免疫功能低下的免疫缺陷患者”才推薦PrEP在第0天和第7天的基礎上加上第三劑疫苗,即:ID途徑2-2-2(0-7-21~28)或IM途徑1-1-1(0-7-21~28)。③以往推薦僅能使用IM途徑,而新的推薦ID途徑也可以使用。
4.2 人狂犬病潛伏期 第三版報告關于人狂犬病病例潛伏期的敘述為:人狂犬病病例的潛伏期從5 d到幾年不等,絕大多數人狂犬病病例的潛伏期是2~3個月。2%~3%的人狂犬病病例潛伏期大于1年,有記錄的特殊病例為8年[24]。以往的報告敘述為:潛伏期從5 d到幾年不等(一般為2~3個月,很少超過1年)。盡管第三版報告提出了1個潛伏期8年的病例(從巴西移民至美國的1個病例),以往曾有文獻報導最長潛伏期為6年的1個病例[25](從菲律賓移民至美國的1個病例)。但由于病例數量太少,相關證據鏈也并不是十分完整,因此筆者建議審慎地看待這個觀點,大量的統計數據表明人狂犬病病例的潛伏期一般為1~3個月,越靠近中樞潛伏期越短,超過一年者極罕見。
另外,對于被確診狂犬病動物暴露者,第三版報告第一次明確,不論暴露時間多久,甚至已經過去幾年,也應注射狂犬病疫苗(但是并沒有推薦使用RIG)。當出現人狂犬病病例時,應進行回顧性評估,暴露于同一個動物的其他人應給予PEP,即便是暴露數月之后。在以往的推薦中,如果出現類似情況,一直都是按照暴露后或再次暴露程序進行處置,也就是說,如果被確診狂犬病動物初次暴露且屬于Ⅲ級者,無論暴露時間多久,除了狂犬病疫苗,還應使用RIG。第三版報告對此的修訂對臨床有重要的指導作用。
4.3 人狂犬病病例及人與人之間的傳播狀況 第三版報告提出:人狂犬病病例的唾液、眼淚、尿液和神經組織中都可以發現RABV,暴露于這些體液和組織在理論上有傳播風險。人狂犬病病例的血液中沒有發現RABV。RABV通過人與人之間的傳播從來沒有確診過,這種極低的風險不應妨礙對人狂犬病病例的護理。有記錄的人與人之間傳播的病例是由于接受了來自被RABV感染的個體組織和器官移植,以及一個可能由于母嬰傳播導致的RABU感染病例。盡管缺乏證據,但根據病理學和流行病學,RABV不太可能通過母乳喂養傳播。
4.4 人狂犬病病例的暴露方式及特殊考慮 人狂犬病病例主要通過咬傷的方式被傳染,其他途徑導致的死亡病例極為罕見。動物實驗顯示,RABV可以通過食用狂犬病動物的肉傳播,但是從來沒有因食用狂犬病動物的生肉得狂犬病的報道。強烈建議不要食用狂犬病動物的肉,尤其是生肉,如果在處理狂犬病動物肉時發生Ⅱ級或Ⅲ級暴露,應該考慮進行PEP。從狂犬病奶牛的奶中沒有發現RABV,也沒有因進食狂犬病奶牛的原奶而患狂犬病的報道,雖然不建議飲用狂犬病奶牛的原奶,但是沒有證據證實飲用后可以發生狂犬病,因此即使飲用了狂犬病奶牛的原奶,也不推薦進行PEP。經過巴氏消毒的牛奶沒有傳播RABV的風險。
野生食肉動物和蝙蝠(食肉目和翼手目動物)較其他野生動物傳播狂犬病的風險要高,因為它們是RABV的儲存宿主動物。但是被其他野生動物,尤其是猴子咬傷通常發生在人們喂食或手持喂食的食物時,或動物處于受威脅、被困住或被捕捉時,應盡量避免類似狀況出現,這種情況沒必要進行PEP。嚙齒動物狂犬病非常罕見,也從沒有因嚙齒動物咬傷得狂犬病的病例報道。極其罕見的情況下,會出現人狂犬病病例是由于在實驗室處理含有高濃度活RABV的材料或在有高密度RABV感染的蝙蝠的洞穴內吸入含有病毒的氣溶膠而發生。
以上特殊狀況在以往的報告中并未明確涉及,但是在臨床上時有出現,這些推薦對于臨床工作有非常重要的指導作用。
4.5 其他特殊狀況 第三版報告依然非常強調暴露后傷口局部處置的重要性:對于所有咬傷和抓傷的傷口,立即對傷口進行局部治療是狂犬病暴露后預防中至關重要一步。同時第一次在其系列報告中明確提出“15 min”這一概念,即立即使用肥皂和清水對傷口進行約15 min的沖洗和清洗,然后使用碘伏或其他有殺病毒活性的物質對傷口進行消毒。“15 min”這個概念第一次出現是在WHO 2007版“Rabies vaccines:WHO position paper”[26]中提過,但是在隨后的2010版中就沒有再提及[27]。
另外,對于疫苗接種程序中變更疫苗品種甚至變更接種途徑,第三版報告第一次進行了相關推薦:有證據顯示,在不可避免的狀況下,變更狂犬病疫苗的品種和(或)接種途徑是可以的,而且不需要重新開始PEP程序,但是要按照新的接種途徑程序繼續完成剩下的PEP。
5 小結
《WHO狂犬病專家磋商會第三版報告》總結和展示了近年來世界范圍內在狂犬病免疫、預防、控制和國際間合作等方面的研究結果,在狂犬病病毒學、人類狂犬病防控、人用狂犬病疫苗及狂犬病免疫球蛋白使用、犬狂犬病防控和狂犬病防控國際間合作和國際項目等方面展示了新的證據、提出了新的推薦意見。提出到2030年在全球范圍內消除由犬傳播的人狂犬病病例的戰略目標及其實施方案。這些最新的推薦意見對我國的狂犬病防控工作具有重要的指導作用,也是廣大狂犬病暴露預防門診工作的指南性參考文獻。在應用該報告指導臨床工作時,需結合國情,為我國狂犬病暴露患者選擇最優治療方案,并積極設計適合我國的狂犬病防控策略和臨床研究,為實現我國“2020年在中國達到狂犬病控制標準”[28]的目標提供重要的指導。

