血清E-cadherin、sE-cadherin水平與乳腺癌臨床分期及療效相關性分析
鐘 彪,鄒萌萌,李靄建,劉 揚
乳腺癌為一種發病率較高的惡性腫瘤,其預后與腫瘤分期及治療方法、治療時機密切相關[1]。新輔助化療為局部晚期乳腺癌的一種規范療法,可縮小腫瘤體積,提高保乳手術成功率,在乳腺癌治療中具有重要作用[2]。但部分患者對新輔助化療敏感性較低,使其得到無效化療或低效化療,造成患者錯失最佳手術時機[3]。因此,探尋新輔助化療療效的預測指標非常重要。E-鈣粘蛋白(E-cadherin)為一種粘附分子,其表達減少或缺失可影響腫瘤的浸潤及轉移,臨床研究也發現,E-cadherin表達水平與胃癌、乳腺癌等惡性腫瘤的臨床分期、患者生存期有關[4]。而可溶性E-鈣粘蛋白(sE-cadherin)為E-cadherin裂解后產生的可溶性片段,在腫瘤患者血清、尿液等體液中均能檢出,且隨腫瘤細胞分化進展,E-cadherin代謝加快,也能促進血清sE-cadherin水平升高,故sE-cadherin在評估惡性腫瘤患者病情進展中也具有一定作用[5]。然而,學術界對E-cadherin及sE-cadherin與乳腺癌化療效果的相關性研究較少。本研究回顧性分析行多西他賽+吡柔比星+環磷酰胺(Taxotere+Pirarubicin+Cyclophosphamide,TAC)方案化療乳腺癌患者臨床資料,探討患者E-cadherin、sE-cadherin水平與臨床分期、化療療效的相關性,為臨床預測新輔助化療療效及患者預后提供參考依據。
1 資料與方法
1.1 臨床資料 回顧性分析2016年5月—2017年9月成都大學附屬醫院行TAC方案化療的62例乳腺癌患者臨床資料。納入標準:經空芯針穿刺活檢確診為乳腺癌;浸潤性乳腺癌;首次行乳腺癌治療;年齡18~70歲;臨床分期≥Ⅱ期;臨床資料完整。排除標準:既往接受放化療、內分泌治療等其他治療方案;合并其他惡性腫瘤;乳房組織炎癥、表皮潰瘍或皮膚性疾病;伴糖尿病、甲亢等內分泌系統疾病。62例乳腺癌患者均為女性;年齡42~64(53.69±10.36)歲;臨床分期Ⅱ期28例,Ⅲ期34例;浸潤性導管癌59例,浸潤性小葉癌3例。
1.2 化療方法 62例患者均行TAC化療方案:吡柔比星(浙江海正藥業股份有限公司,規格10 mg,批準文號H20045983)40~50 mg/m2,靜脈注射(iv),1/d,21 d為1個周期;環磷酰胺(浙江海正藥業股份有限公司,規格500 mg,批準文號H20093393)500 mg/m2,iv,1/d,21 d為1個周期;多西他賽(北京協和藥廠,規格2 mL/80 mg,批準文號H20093734)75 mg/m2,iv,2/d,21 d為1個周期;化療期間給予地塞米松防止水鈉潴留、昂丹司瓊止吐等基礎治療;化療后預防性使用粒細胞集落刺激因子,并檢查血象;所有患者在接受3個周期化療后,行手術治療。
1.3 療效評估方法 根據實體腫瘤療效評價標準(response evaluation criteria in solid tumour,RECIST)[6]分為完全緩解(complete response,CR)、部分緩解(partial response,PR)、穩定(stable disease,SD)、進展(progressive disease,PD)共4個等級;其中CR為病灶完全消失,PR為腫瘤2個最大垂直直徑之和縮小>30%,SD為介于CR及PD間,PD為腫瘤2個最大垂直直徑之和增加>20%或出現新病灶。
1.4 E-cadherin測定與觀察 化療前穿刺活檢及化療后手術標本均行常規石蠟切片及免疫組化分析。使用烤箱(60 ℃)烤片1 h;并使用二甲苯脫蠟2次(30 min/次),100%乙醇、95%乙醇、70%乙醇各3 min;使用磷酸鹽緩沖液(phosphate buffer saline,PBS)沖洗3次(3 min/次),利用恒溫水浴(95 ℃、20 min)行抗原修復(0.01 mol/L枸櫞酸鹽緩沖液,pH為6.0),接著使用PBS沖洗3次(3 min/次);室溫下,使用3%過氧化氫阻斷10 min,滴加一抗(鼠抗人上皮性鈣粘附蛋白單克隆抗體,北京中杉金橋生物技術有限公司),在醫用冰箱(4 ℃)內保存12 h;再次使用PBS沖洗3次(5 min/次),滴加二抗(通用型抗體,北京中杉金橋生物技術有限公司),并在恒溫箱內(37 ℃)孵育20 min;行PBS沖洗3次(5 min/次),滴加二氨基聯苯胺(diaminobenzidin,DBA)顯色劑(北京中杉金橋生物技術有限公司),顯微鏡下觀察染色情況;使用蘇木素復染2 min,并用1%鹽酸酒精分化,封片。操作中以PBS代替一抗作為陰性對照,使用已知陽性片為陽性對照片(陽性對照片由北京中杉金橋生物技術有限公司提供);在10×40高倍鏡視野下,由2名分析員獨立分析,隨機選取10個視野,根據陽性細胞所占百分比記為0分(無)、1分(<25%)、2分(26%~50%)、3分(51%~75%)、4分(>75%);并根據陽性細胞染色程度分為0分(無)、1分(淡黃)、2分(棕黃)、3分(棕褐);2種分數相加,0~1分為陰性(-),2~3分為弱陽性(+),4~5分為等陽性(++),6~7分為強陽性(+++)。
1.5 sE-cadherin、糖類抗原153(carbohydrate antigen 153, CA153)測定 化療前及手術治療前抽取患者空腹肘外周靜脈血,離心保留上層血清,置于醫用冷凍儲藏設備(-80 ℃)待用;檢測前將其取出,在常溫下自然融化,使用酶聯免疫分析法(試劑由德國美天旎生物技術有限公司生產)檢測sE-cadherin濃度,血清sE-cadherin水平正常參考范圍為0~1 000 ng/mL;使用化學發光法(試劑由德國羅氏公司生產)檢測血清CA153水平。
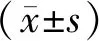
2 結 果
2.1 乳腺癌患者E-cadherin表達情況及sE-cadherin水平與其病例特征的關系 62例乳腺癌患者E-cadherin表達陽性51例。乳腺癌患者E-cadherin表達情況及sE-cadherin水平在不同年齡、腫瘤直徑和雌激素受體(estrogen receptor,ER)、孕激素受體(progesterone receptor,PR)、人類表皮生長因子受體-2(human epidermal growth factor receptor-2,HER-2)表達情況比較,差異比較無統計學意義(P>0.05);伴淋巴結轉移者E-cadherin陽性率低于無淋巴結轉移者(P<0.05),而伴淋巴結轉移者血清sE-cadherin水平高于無淋巴結轉移者(P<0.05);見表1。
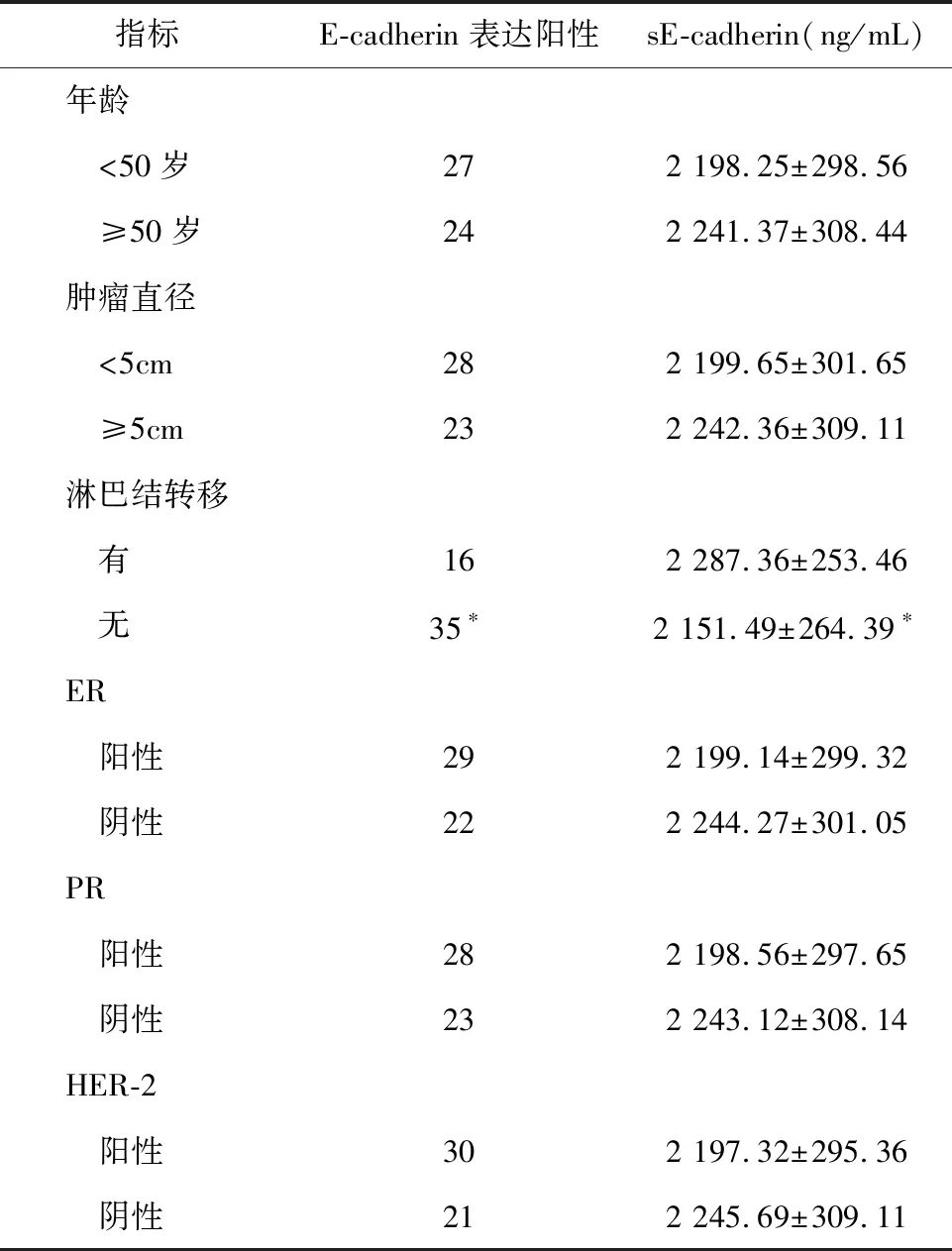
表1 乳腺癌患者E-cadherin表達情況及sE-cadherin水平與其病例特征的關系
注:組內比較,*P<0.05
2.2化療前后E-cadherin表達情況及sE-cadherin、CA153水平 化療后,62例乳腺癌患者E-cadherin表達較化療前下調(Z=3.234,P<0.05),血清sE-cadherin水平較化療前升高(t=-5.811,P<0.05),而CA153水平較化療前降低(t=17.593,P<0.05),見表2。

表2 化療前后E-cadherin表達情況及sE-cadherin、CA153水平
2.3 E-cadherin表達及sE-cadherin水平與CA153的相關性 經Spearman秩相關檢驗分析,發現化療前CA153水平與E-cadherin表達強度呈負相關(r=-0.356,P=0.019);經Pearson相關分析,發現化療前CA153水平與sE-cadherin水平呈正相關(r=0.412,P=0.008)。
2.4 臨床分期與化療前E-cadherin表達情況的相關性 不同臨床分期患者化療前E-cadherin表達強度差異顯著(Z=2.02,P<0.05);且經Spearman秩相關檢驗分析,發現臨床分期與化療前E-cadherin表達強度呈負相關(r=-0.339,P<0.05);見表3。

表3 臨床分期與化療前E-cadherin表達情況的相關性
2.5 化療療效與化療前E-cadherin表達情況的相關性 不同化療療效患者化療前E-cadherin表達強度差異顯著(Z=6.21,P<0.05);且經Spearman秩相關檢驗分析,發現化療療效與化療前E-cadherin表達強度呈負相關(r=-0.297,P<0.05);見表4。
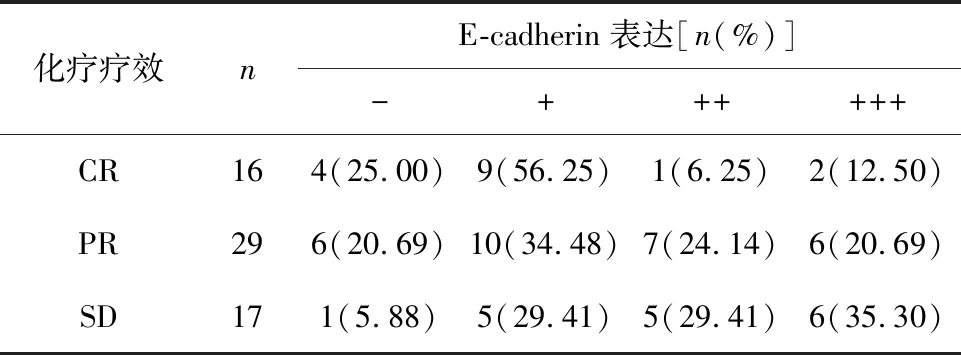
表4 化療療效與化療前E-cadherin表達情況的相關性
注:62例患者中無PD者
2.6 臨床分期與化療前sE-cadherin水平的相關性 臨床分期Ⅱ期患者化療前sE-cadherin水平(2 154.65±254.69)低于Ⅲ期患者(2 299.65±249.54,t=2.256,P<0.05);且經Pearson相關分析,發現臨床分期與化療前sE-cadherin水平呈正相關(r=0.394,P<0.05)。
2.7 化療療效與化療前sE-cadherin水平的相關性 不同化療療效患者化療前sE-cadherin水平差異顯著(F=4.162,P<0.05);且經Pearson相關分析,發現臨床分期與化療前sE-cadherin水平呈正相關(r=0.398,P<0.05);見表5。
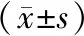
表5 化療療效與化療前sE-cadherin水平的相關性
3 討 論
目前,臨床常使用腫瘤直徑、臨床分期等病理學指標評估腫瘤病情進展狀況,但隨著分子生物學研究的飛速發展,E-cadherin在惡性腫瘤組織中表達的臨床意義受到學術界廣泛關注[7]。臨床研究發現,在正常組織中E-cadherin可保持穩定表達,可保護上皮形態、結構完整,并誘導正常組織細胞接觸抑制,促使腫瘤細胞凋亡;但隨著乳腺癌等上皮來源腫瘤細胞上皮間質轉化(epithelial-mesenchymal transition,EMT)激活,上皮細胞膜上的E-cadherin表達下調,上皮細胞也轉化為具有移動特性的間質細胞,進而促進乳腺癌的進展[8]。故E-cadherin表達水平可作為早期乳腺癌的診斷指標,且能輔助評估腫瘤的臨床分期及進展。另外,sE-cadherin作為E-cadherin的胞外降解產物,且能參與腫瘤細胞分化、增殖的信號通路,有學者也提出,可將sE-cadherin作為癌癥輔助治療的靶標,則sE-cadherin與腫瘤的分期及進展有關[9]。然而,鮮有學者研究E-cadherin表達水平、sE-cadherin水平與化療療效的相關性。對此,本研究就乳腺癌患者E-cadherin表達水平、sE-cadherin水平與其臨床分期及化療療效的相關性展開分析,以評估E-cadherin、sE-cadherin在評估乳腺癌病情進展及預后的臨床意義。
本研究結果顯示,乳腺癌患者E-cadherin表達較化療前下調,而血清sE-cadherin水平較化療前升高。考慮此結果是由于新輔助化療能有效抑制乳腺癌細胞活性,而乳腺癌細胞主要來源于上皮細胞,使間質細胞相對增多,造成存在于上皮細胞的E-cadherin表達下調[10];新輔助化療可刺激EMT活性,使E-cadherin代謝速度加快,而在下調E-cadherin的同時,增加血清sE-cadherin水平[11]。此外,臨床分期與化療前E-cadherin表達強度呈負相關,即化療前E-cadherin表達強度越低,臨床分期越高,與國內學者研究結果一致[12]。這也證實,隨著乳腺癌腫瘤細胞的增殖分化及病情進展,上皮細胞中E-cadherin也逐漸缺失,造成E-cadherin表達下調。不僅如此,化療療效與化療前E-cadherin表達強度呈負相關,與外國學者研究結果不同[13]。推測此結果由以下因素作用引起:E-cadherin表達強度越低的乳腺癌患者腫瘤分期及惡性程度較高,對新輔助化療敏感性也較高,使其化療療效較好[14]。因此,E-cadherin表達強度較低的乳腺癌患者雖然臨床分期較高,但新輔助化療對其治療效果較好,利于患者預后。
本研究結果發現,伴淋巴結轉移者E-cadherin陽性率低于無淋巴結轉移者,而伴淋巴結轉移者血清sE-cadherin水平高于無淋巴結轉移者,這也提示,淋巴結轉移是影響機體E-cadherin表達的重要指標。考慮該結果與伴淋巴結轉移者腫瘤侵襲能力較強,惡性程度較高,E-cadherin表達強度低有關。另外,本研究也就經典乳腺癌腫瘤標志物CA153水平與其相關性展開分析,發現化療前CA153水平與E-cadherin表達強度呈負相關,與sE-cadherin水平呈正相關。也初步證實,乳腺癌惡性程度與E-cadherin表達強度和血清sE-cadherin水平具有顯著相關性。
本研究還發現,臨床分期與化療前sE-cadherin水平呈正相關,這也說明sE-cadherin水平能隨乳腺癌患者病情進展、E-cadherin表達下調而逐漸升高。也有學者對此指出,sE-cadherin作為一種血清學檢測指標,具有檢測方便的優勢,可輔助乳腺癌早期診斷[15]。但臨床分期與化療前sE-cadherin水平呈正相關,即化療前sE-cadherin水平越高,新輔助化療效果越好。這可能與腫瘤分期及惡性程度越高的腫瘤細胞,對新輔助化療敏感性也越高,使其化療效果提高有關。故臨床在根據化療前sE-cadherin水平評估乳腺癌患者病情進展,并預測患者新輔助化療療效時,應結合其他指標共同觀察,以保證結果的準確性。
綜上所述,化療前E-cadherin表達情況與乳腺癌患者臨床分期及新輔助化療效果呈負相關,而血清sE-cadherin水平則與患者臨床分期及化療效果呈顯著正相關,臨床可結合E-cadherin表達情況及sE-cadherin水平評估患者病情進展,并預測新輔助化療對其敏感性,以判斷新輔助化療的可行性,為患者提供最佳治療方案。本研究為回顧性研究,具有一定的局限性,還需要多中心、大樣本、前瞻性、隨機對照研究來進一步證實研究結論。

