MiR-153-3p調控異丙腎上腺素誘導的心肌肥大機制研究
張麗霞,周露玙,許 勝,王 濤,劉 靖,王 昆
心肌肥大是心臟對多種病理生理刺激的重要補償反應,如心肌梗死,高血壓,瓣膜功能不全和收縮蛋白突變[1]。雖然在早期階段作為有益的適應性反應,但如果不進行治療則由于失代償而逐漸惡化為心力衰竭。盡管已經鑒定出參與心肌肥大過程的許多信號傳導途徑[2-3],但是對于心肌肥大的潛在分子機制仍然知之甚少,這妨礙了臨床實踐中對這種心臟病的有效治療。因此非常希望揭開調節心肌肥大的新分子,從而破譯心肌肥大的新機制并制定治療該疾病的新策略。
微小RNA(microRNA,miRNA)是一類小的內源性非編碼RNA分子,通過降解靶mRNA或直接翻譯抑制來沉默其同源靶基因[4]。越來越多的證據表明,miRNA在心肌肥大的發病機制中發揮重要作用[5]。例如,我們之前的研究結果表明miR-9[6]和miR-489[7]可以抑制心肌肥大,而miR-23a[8]是一種促進心肌肥大的miRNA。其他研究如miR-133的下調導致顯著的心肌肥大[9]。另一方面,單獨過表達miR-208a,miR-195,miR-214,miR-24或miR-23a也已顯示在動物和培養的心肌細胞中誘導肥大反應[10]。顯然,miRNA在心肌肥大的調節中發揮著多種重要作用。MiR-153參與多種疾病的生理過程,如胃癌[11],乳腺癌[12-13],宮頸癌[14],神經膠質瘤[15],骨肉瘤[16]等。并且miR-153-3p被認為是一種新的生物靶標[17],然而其在心肌肥大的作用機制尚未可知,本研究以體外分離培養大鼠心肌細胞為研究對象,利用異丙腎上腺素(isoproterenol,ISO)誘導法建立心肌肥大的體外細胞研究模型,通過轉染miR-153-3p antagomir(RNA拮抗劑)研究miR-153-3p在心肌肥大中的作用機制。
1 材料與方法
1.1 材料
1.1.1 實驗動物 新生0~3 d的Sprague-Dawley(SD)大鼠,雌雄不限,購自濟南朋悅實驗動物繁育有限公司[SCXK-(魯)-2014-0007]。
1.1.2 主要試劑 ISO(上海樊克生物科技有限公司);FITC Phalloidin FITC標記鬼筆環肽(上海翊圣生物科技有限公司);RR820A takara SYBR?Premix ExTaqTMII(Tli RNaseH Plus)(日本TaKaRa公司);DEME培養基(英國Gibico公司);胎牛血清(英國Gibico公司);胰蛋白酶和II型膠原酶(日本TaKaRa公司);TRIzol試劑盒(日本TaKaRa公司);RNA反轉錄試劑盒(日本TaKaRa公司);lipofectamineTM 3000(美國Invitrogen公司)。
1.2 方法
1.2.1 小鼠心肌細胞的分離及培養 用75%酒精浸泡出生0~3 d的SD大鼠乳鼠,消毒2~3次,于滅菌超凈臺中用眼科剪取出心臟的心尖大部分,用預冷的磷酸鹽緩沖液(phosphate buffer saline,PBS)沖洗2~3遍直至無血細胞殘留,之后用剪刀剪碎至無大組織殘留,使用胰蛋白酶(10 mg/mL)和II型膠原酶(30 mg/mL)消化法反復消化,每次消化5~6 min后將細胞懸液吸出放入2%的胎牛血清中終止消化,最后將消化后的細胞懸液以800~1 000 r/min轉速離心5 min,2次,通過細胞篩除去組織碎片,所提取的細胞置于含5%胎牛血清的DEME/F12培養基中,混勻細胞,種于37 ℃ 5% CO2培養皿中,采用差速貼壁1.5~2 h分離細胞,纖維細胞將貼壁生長,輕輕吸取含未貼壁細胞的培養液,按(0.5~1)×105/mL密度種植細胞于6孔板中或按(1.5~2)×107/mL密度種植于24孔板中,24 h后換液,繼續培養進行實驗。
1.2.2 ISO誘導心肌肥大實驗 培養的心肌細胞換液后,選擇6孔板中生長狀態良好的乳鼠心肌細胞用不同時間[0(對照組)、8、12、18、24、48 h]梯度的ISO(濃度為10 μmol/L),并將培養基換為2%胎牛血清培養。在同一時間點收集細胞的RNA用熒光定量PCR(real-time quantitative PCR,RT-qPCR)法檢測心房利鈉肽(atrial natriuretic peptide,ANP),β-肌球蛋白重鏈(β-myosin heavy chain,β-MHC)和miR-153-3p的表達。收集ISO誘導24 h的細胞進行表面積染色,拍照后使用Image J軟件分別測量實驗組和對照組細胞大小。
1.2.3 MiR-153-3p拮抗實驗 培養的心肌細胞換液后,選擇6孔板中生長狀態良好的乳鼠心肌細胞用lipofectamine 3000將miR-153-3p的拮抗劑(antagomir)和NC(陰性對照)轉入心肌細胞中,轉染4 h后換液加入ISO miR-153-3p,分組如下:0 h(空白組),ISO組(藥物誘導組),ISO+NC組(陰性對照組),ISO+miR-153-3p antagomir組(實驗處理組)。24 h后收集細胞進行表面積染色,拍照后使用Image J軟件分別測量實驗處理組和陰性對照組細胞大小,并收集細胞的RNA行RT-qPCR法檢測ANP,β-MHC和miR-153-3p基因表達。
1.2.4 RT-qPCR 用RT-qPCR法檢測。使用Trizol試劑提取各組細胞總RNA,而后按照反轉錄試劑盒說明書操作,用隨機引物合成cDNA,或加入莖環引物反轉錄miR-153-3p,用SYBR Green熒光RT-PCR法檢測反轉錄產物中心肌肥大標志基因ANP,β-MHC的mRNA表達和miR-153-3p的表達。上述實驗均重復3次。RT-qPCR引物序列見表1。
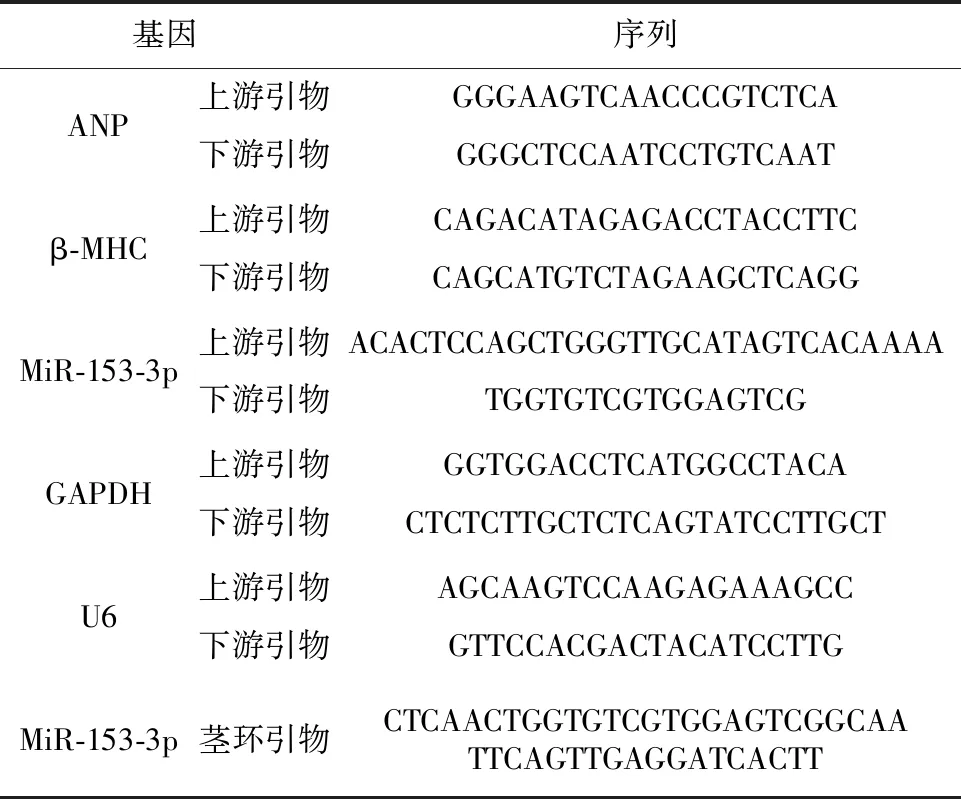
表1 RT-qPCR引物序列
1.2.5 表面積染色 將上述提取的細胞按(1.5~2)×107/mL密度種植于24孔板中,按下述步驟進行染色:①在24孔板中加入賴氨酸包被的蓋玻片,按孔調整細胞濃度;②將要染色的細胞用PBS洗2遍,加入0.5~1 mL 3.7%的多聚甲醛固定細胞,室溫15 min,用PBS充分洗滌;③用丙酮脫水5 min,用含有0.2% Triton X-100的PBS配制TRITC標記的鬼筆環肽(TRITC-Phalloidin),錫紙避光,室溫,染40 min;④用PBS洗3次,以去掉未反應的染料;⑤將貼有細胞一面的蓋玻片扣于含DAPI封片液的蓋玻片上。
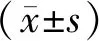
2 結果
2.1 ISO誘導心肌細胞肥大情況 與對照組比較,隨著ISO的誘導時間越長心肌細胞逐漸呈現肥大效果,在ISO誘導心肌細胞18 h和24 h后,ANP和β-MHC基因的表達具有顯著差異,尤其在24 h誘導肥大效果更加明顯(圖1A、B,P<0.05),48 h后心肌細胞肥大降低,可能是由于細胞凋亡引起。對ISO誘導24 h的心肌細胞進行表面積染色發現與對照組比較,實驗組心肌細胞的表面積顯著增加(圖2,P<0.05)。
2.2 MiR-153-3p在心肌肥大細胞中的表達情況 與對照組比較,隨著ISO的誘導時間越長miR-153-3p的表達逐步升高,在ISO誘導心肌細胞18 h和24 h后miR-153-3p基因的表達具有顯著差異,尤其在24 h上升更加明顯(圖3,P<0.05)。這與上述的心肌細胞肥大驗證結果相一致,表明miR-153-3p可能促進心肌肥大。
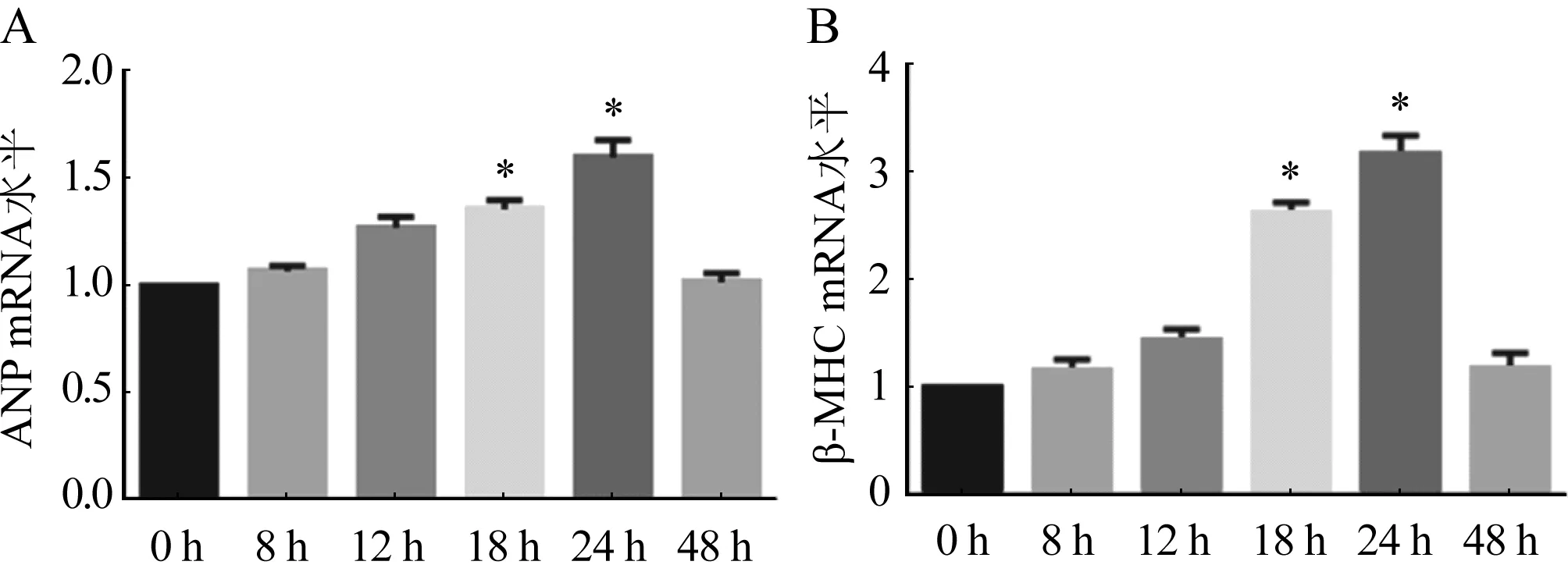
n=3;與對照組相比,*P<0.05圖1 不同時間梯度ISO處理組ANP(A)和β-MHC(B)的表達情況
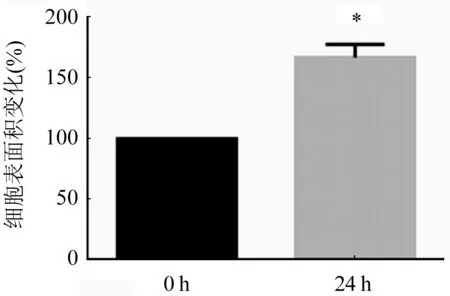
n=3;與對照組相比,*P<0.05圖2 ISO誘導24 h后心肌細胞表面積的變化情況
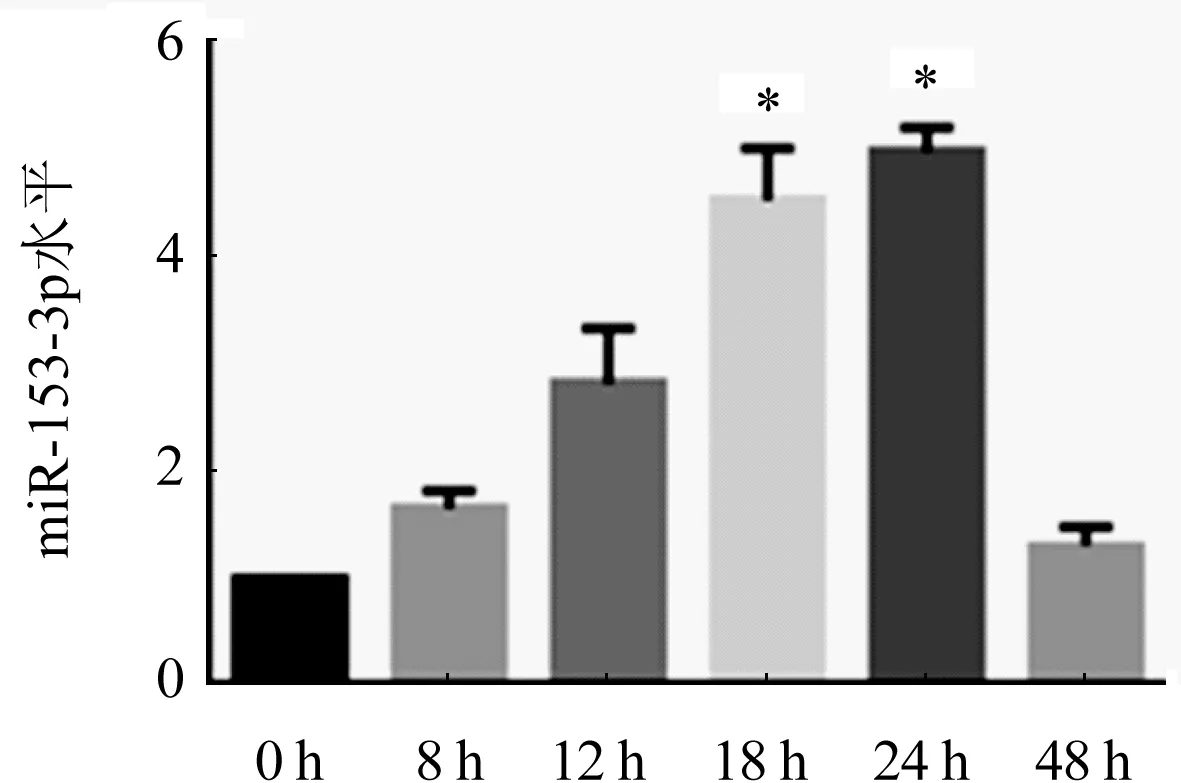
n=3;與對照組相比, *P<0.05圖3 不同時間梯度ISO處理組miR-153-3p的表達情況
2.3 MiR-153-3p拮抗實驗后對心肌肥大的影響 轉染miR-153-3p antagomir 4 h后行RT-qPCR檢測,結果發現miR-153-3p的表達降低(圖4,P<0.05),表明miR-153-3p拮抗成功,進一步行RT-qPCR檢測發現,與ISO組和ISO+NC組比較,ISO+antagomir組的心肌細胞肥大效果顯著降低(圖5A、B,P<0.05)。心肌細胞表面積的結果也同這一結果相一致(圖6,P<0.05),進一步證明miR-153-3p促進心肌細胞肥大。
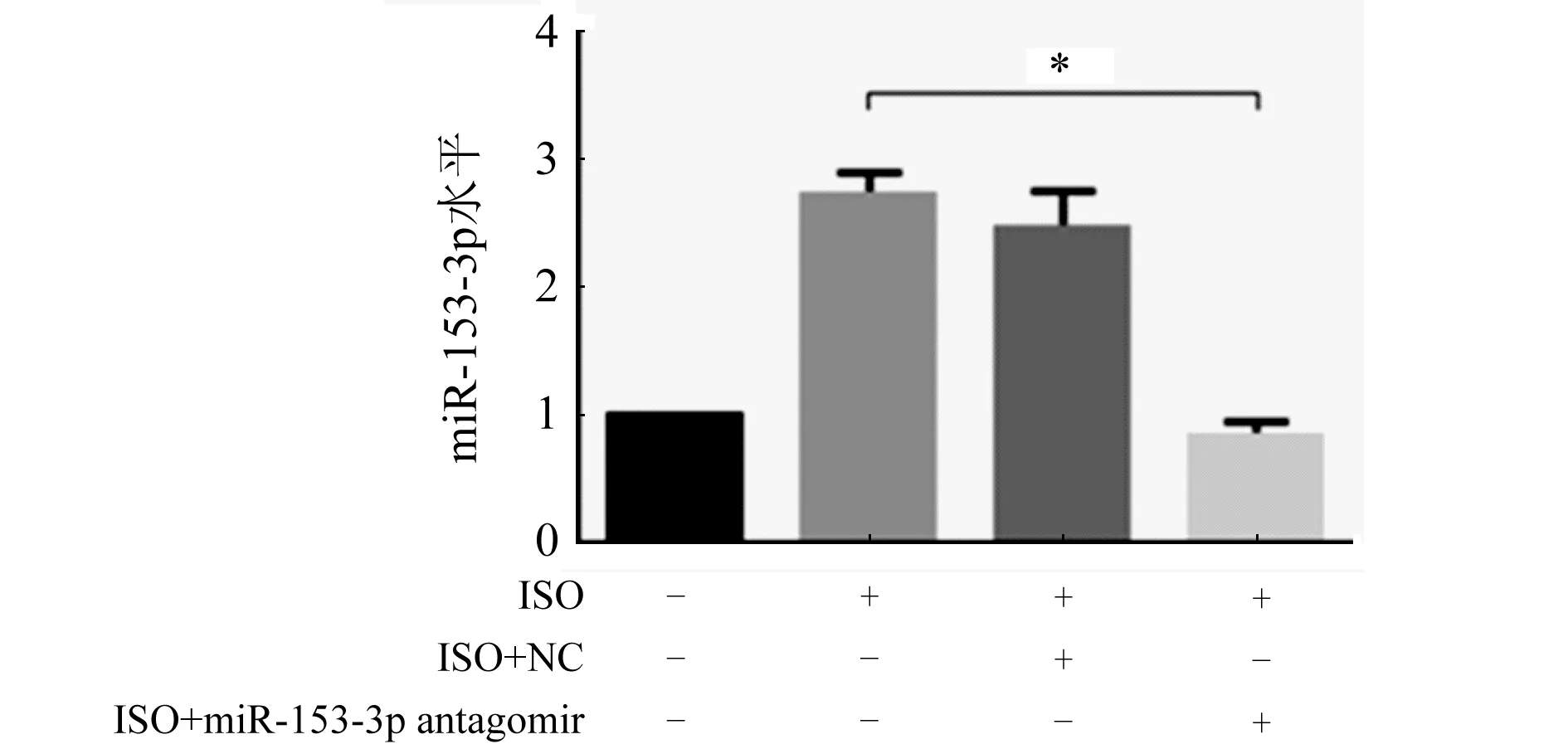
ISO組:ISO誘導24 h;ISO+NC組:先轉染NC 4 h后用ISO誘導24 h;ISO+miR-153-3p antagomir組:先轉染miR-153-3p antagomir 4 h后用ISO誘導24 h;n=3;與陰性對照組比較,*P<0.05圖4 轉染miR-153-3p antagomir后的敲低情況
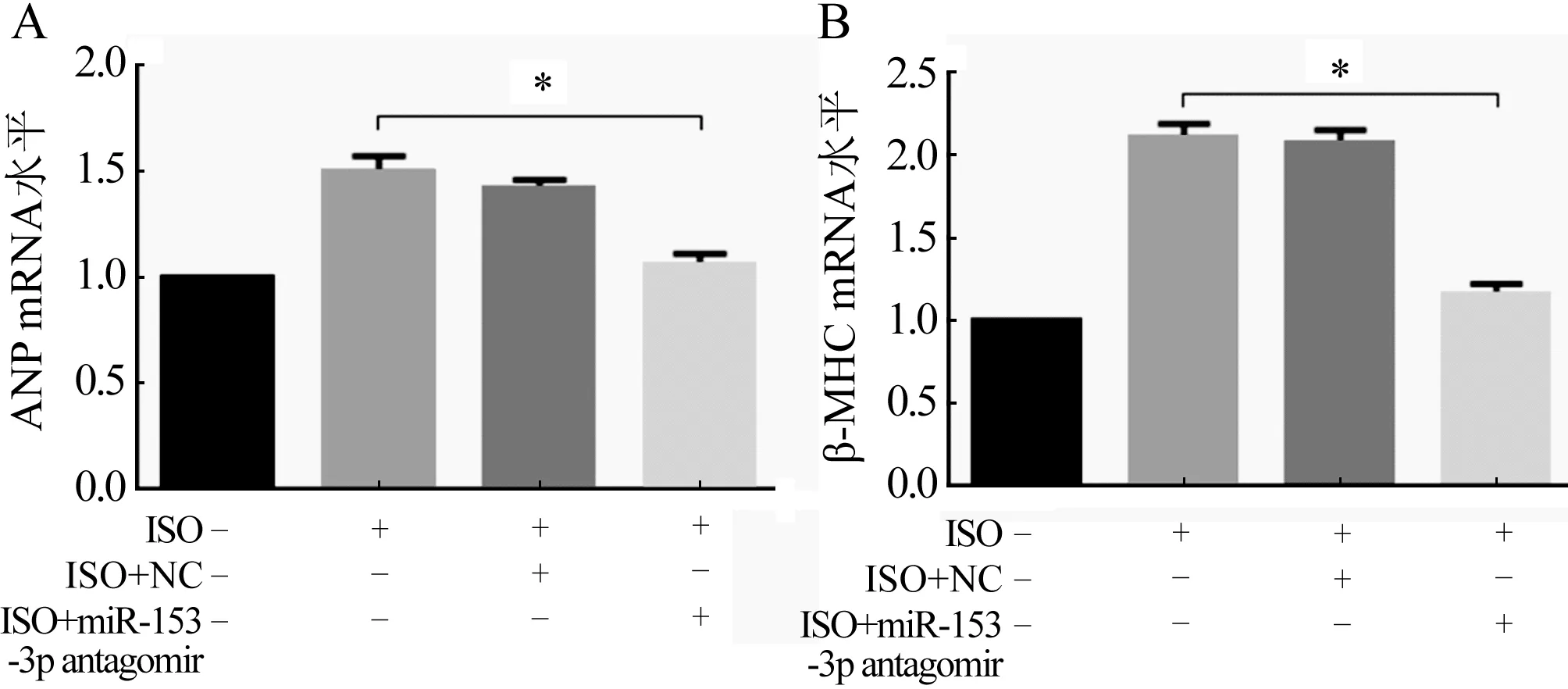
ISO組:ISO誘導24 h;ISO+NC組:先轉染NC 4 h后用ISO誘導24 h;ISO+miR-153-3p antagomir組:先轉染miR-153-3p antagomir 4 h后用ISO誘導24 h;n=3;與陰性對照組比較,*P<0.05圖5 轉染miR-153-3p antagomir后ANP(A)和β-MHC(B)的表達情況
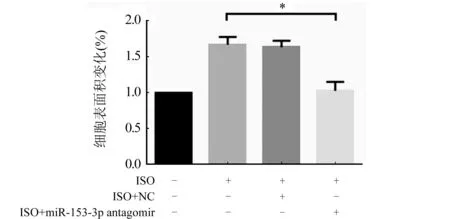
ISO組:ISO誘導24 h;ISO+NC組:先轉染NC 4 h后用ISO誘導24 h;ISO+miR-153-3p antagomir組:先轉染miR-153-3p antagomir 4 h后用ISO誘導24 h;n=3;與陰性對照組比較,*P<0.05圖6 轉染miR-153-3p antagomir后心肌細胞表面積的變化情況
3 討論
心肌肥大是由于神經體液活化引起的應激增加和血流動力學負荷增加而發生的,通常會發展為心力衰竭,死亡率高。最初,心臟經歷適應性形態學變化,導致補償性肥大以維持心輸出量。持續性肥大是不可逆轉的,并且在長期壓力下不可避免地導致失代償性心力衰竭,引起患者的死亡[18]。
在神經體液因素中,ISO受體及其信號傳導通路是誘導心肌肥大的重要因素。該通路一旦被激活,會改變細胞內多個基因和蛋白質的表達量,發生一些列生物化學變化,從而導致心肌肥大的發生。在本研究中,采用了ANP和β-MHC基因作為心肌肥大的發生指標,二者均是與細胞肥大密切相關的基因,在心臟胚胎發育早期或出生后病理狀態下高表達,新出生0~3 d SD大鼠心肌細胞在體外可以離體培養7 d,是研究心臟相關疾病的經典模型[19]。
miRNA屬于轉錄后調控,主要通過作為RNA誘導的沉默復合體的一個元件,識別mRNA的3′端非編碼區,引起該mRNA降解或者翻譯抑制,從而負性調節靶蛋白的表達,發揮其生物學功能。許多miRNAs已被證實是心血管疾病治療的目標基因,如miRNA23、miRNA24、miRNA199、miRNA98等[20]。MiR-153-3p可以通過多種信號通路參與疾病的發生,如與lncRNAs HIF1A-AS2相互作用促進HIF-1α的上調,從而促進缺氧時人臍靜脈內皮細胞的血管生成[21];circRNA_0084043可以通過miR-153-3p/Snail軸促進惡性黑素瘤進展[22];miRNA-153-3p還可以通過靶向黑色素瘤中的SNAI1來抑制細胞增殖和侵襲[23]。本研究通過檢測ISO誘導的心肌肥大中的miR-153-3p基因的表達水平,以及檢測敲低miR-153-3p對ISO誘導的心肌肥大效果的影響,mRNA水平與表面積結果都顯示miR-153-3p可能促進由ISO誘導的心肌肥大。因此,我們的研究結果揭示了miRNA在控制心肌肥大發展中的新信號機制。
考慮到miR-153-3p能夠通過多種信號通路參與疾病的發生,并且miRNA屬于轉錄后調控,其作用機制主要是通過它對相關靶基因的轉錄調控實現的,在本研究的基礎上,尋找miRNA的靶基因從而研究它們之間的相互作用機制及相關靶基因對心肌肥大的作用,將會為進一步明確miRNA的作用機制,闡明心肌肥大的相關生理、病理過程發生、發展機制起到重要的促進作用[24]。

