基于液相色譜-質譜的血清糖蛋白質組定量分析
胡丹陽,蔣碧云,王 獻,劉曉慧
(1.中南民族大學化學與材料科學學院,國家民事委員會分析化學重點實驗室,湖北 武漢 430074;2.復旦大學生物醫學研究院,上海 200032)
糖基化是一種具有重要生物學功能的蛋白質翻譯后修飾。與許多其他翻譯后修飾不同,蛋白質的N糖基化的主要結構N-聚糖是由許多單糖單元組成,且呈非線性排列,具有結構多樣性,研究蛋白質的糖基化對了解其生物學結構和功能有著重要意義,如對糖蛋白和糖基化位點、對糖型進行鑒定等[1-3]。研究表明[4-7],糖蛋白參與了很多重要的生物學過程,包括細胞粘附、分子運輸、受體激活和特定的蛋白功能等,許多疾病的病理過程與糖蛋白表達量的變化密切相關。據報道[8-9],美國食品藥品監督局批準的25%腫瘤標志物都是糖蛋白,例如載脂蛋白A1、甲胎蛋白(α-Fetoprotein)、癌胚抗原(carcinoembryonic antigen)等。
研究蛋白質糖基化具有一定難度。糖蛋白在復雜樣品中的含量較低,糖肽的離子化效率有限,其質譜響應信號強度遠低于非糖肽,且具有高度的微觀不均一性,若糖蛋白、糖肽不經富集,幾乎無法用于質譜直接鑒定[10-12]。因此,為獲得較理想的質譜信息,在樣品處理過程中,將糖蛋白、糖肽從復雜樣品中富集出來是關鍵步驟。常見的糖蛋白/糖肽富集方法包括凝集素富集法、肼化學富集法[13]、兩性離子親水相互作用色譜富集法(zwitterionic hydrophilic interaction liquid chromatography, ZIC-HILIC)等。凝集素富集法是通過凝集素選擇性地識別某些特殊結構的單糖或聚糖而實現對糖蛋白的富集,雖然該法具有高度的特異性,但凝集素與糖蛋白的結合力較弱[14]。肼化學富集法是通過糖鏈的順式二羥基被高碘酸鈉氧化形成二醛,然后與固定相上的肼官能團反應形成腙進行富集,其特異性好、效率高,但糖鏈結構會受到破壞[15]。糖基化修飾中的聚糖基團具有親水性,親水相互作用色譜法(hydrophilic interaction liquid chromatography, HILIC)不需要對樣品進行衍生,具有較強的保留能力。在此基礎上發展的兩性離子親水相互作用色譜(ZIC-HILIC)則是利用電荷相互作用和親水相互作用富集糖肽,固定相上存在正電荷和負電荷的中心,可以和被分析物表面基團以及流動相中的電解質產生電荷相互作用和電荷-偶極相互作用,從而對糖肽進行富集[16]。該方法高效、快速、不易破壞糖鏈。
糖尿病是一種以高血糖為特征的代謝性疾病,目前糖尿病患者需終生服藥,飲食方面有諸多禁忌,嚴重影響生活質量。糖尿病還伴隨多種并發癥,長期血糖升高會對心臟、血管、眼睛、腎臟和神經系統造成較大損傷。目前,全球已有超過4億人患有糖尿病[17],我國的糖尿病患者約9 500萬,糖尿病前期患者約1.5億[18]。研究發現,患者糖蛋白的表達量發生了變化[19-21],O-糖基化糖蛋白在糖尿病及其并發癥的病因及形成中有重要作用[22],但關于N-糖基化糖蛋白的相關報道較少。
本工作擬以6例正常人與6例糖尿病人的血清為樣品,深入研究N-糖蛋白,對血清進行蛋白質組學和糖蛋白質組學的非標記定量(label-free quantification),以系統、全面地揭示糖尿病發病過程中蛋白質和糖基化后修飾的變化,希望為進一步揭示糖尿病的發病機理提供參考。
1 實驗部分
1.1 主要儀器與試劑
Eksigent UPLC超高效液相色譜儀、Triple-TOFTM5600高分辨質譜儀:均為美國AB Sciex公司產品;Milli-Q超純水系統:美國Millipore公司產品;C18除鹽柱:美國Waters公司產品;離心機、真空濃縮儀器、恒溫混勻儀:德國Eppendorf公司產品;兩性離子親水相互作用填料(ZIC-HILIC particles)、-80 ℃超低溫冰箱:美國Thermo Fisher公司產品。
糖尿病人血清、正常人血清:由中山醫院提供;碳酸氫銨、二硫蘇糖醇(DTT)、碘乙酰胺(IAA)、三氟乙酸(TFA):均為美國Sigma公司產品;胰蛋白酶(Trypsin):美國Promega公司產品;肽N-糖苷酶F(PNGaseF):美國New England Biolabs公司產品;乙腈(ACN):德國Merck公司產品;甲酸:美國Fisher Scientific公司產品。
1.2 血清收集與處理
將采集的血液樣品在不加抗凝劑的情況下室溫靜置1 h凝血,隨后以1 500 r/min離心10 min,取上清液得到血清,分裝并置于-80 ℃冰箱保存。實驗時取出血清,在冰上進行解凍,低溫下以14 000 r/min離心30 min,取中層血清于離心管中,并編號。
1.3 蛋白質酶解與C18除鹽
各取55 μL每例血清,分別加入終濃度為1 mol/L尿素和100 mmol/L碳酸氫銨溶液稀釋后,使血清蛋白質充分變性,然后加入終濃度為10 mmol/L二硫蘇糖醇,于56 ℃恒溫反應1 h;避光加入終濃度25 mmol/L碘乙酰胺,于37 ℃避光振蕩30 min;按照胰蛋白酶與蛋白質量比1∶50加入胰蛋白酶,于37 ℃反應過夜;將酶解后的溶液以14 000 r/min離心15 min去除懸浮微粒,然后加入200 μL 乙腈活化C18柱,用200 μL 0.1%三氟乙酸平衡柱子;將酶解好的蛋白質溶液重復上樣3次,并用0.1%三氟乙酸清洗3次;依次用200 μL 30%乙腈+0.1%三氟乙酸、60%乙腈+0.1%三氟乙酸將肽段從C18柱上洗脫下來,將多次洗脫液混合均勻后,各取每個樣品40 μL洗脫液于離心管中,在凍干機中凍干,直接用于蛋白水平質譜鑒定;將剩余的洗脫液置于凍干機中凍干,待糖肽富集實驗。
1.4 糖肽富集
將上述剩余肽段用200 μL 80%乙腈+1%三氟乙酸溶液溶解,并用200 μL 80%乙腈+1%三氟乙酸溶液平衡活化ZIC-HILIC柱3次,重復上樣3次,用80%乙腈+1%三氟乙酸淋洗6次除去未結合的肽段;然后將保留于ZIC-HILIC柱上的糖肽用0.1%TFA洗脫2次,收集洗脫液,凍干后置于-20 ℃冰箱中備用。將富集的糖肽用100 mmol/L碳酸氫銨溶解,向其中加入PNGaseF酶,并在37 ℃孵育振蕩過夜處理;將酶解后的肽段凍干,并用0.1%甲酸溶解,待LC-MS/MS分析,所有樣品處理過程一致。
1.5 實驗條件
用于做全蛋白質組分析的肽段以及經富集后的糖肽,均以相同的液相色譜和質譜條件進行分析。采用Eksigent UPLC色譜儀與AB Sciex TripleTOF?5600質譜儀聯用系統進行LC-MS/MS實驗。
1.5.1色譜條件 C18反相色譜柱(0.3 mm×150 mm×3 μm);流動相:A為0.1%FA水溶液,B為0.1%FA的乙腈溶液;流速5 μL/min;洗脫程序:0~1 min(5%~7%B),1~94 min(7%~24%B),94~109 min(24%~38%B),109~109.5 min(38%~80%B),109.5~114 min(80%B),114~114.5 min(80%~5%B),114.5~119 min(5%B)。
1.5.2質譜條件 正離子模式檢測;氣簾氣壓強172.4 kPa;噴霧電壓2 300 V;一級質譜采集的質量掃描范圍為m/z350~1 250;采集模式為數據依賴采集,并選取豐度最高的20個母離子進行二級掃描;動態排除時間為14 s,排除已檢測到的離子;檢測的肽段所帶電荷數為2~4。
1.6 數據庫檢索
質譜數據使用 Maxquant(1.6.0.1版本)軟件進行分析,以Uniprot_human(20 394條肽段)為蛋白數據庫進行搜庫。搜索參數:Trypsin蛋白酶,糖肽/糖蛋白鑒定漏切上限是2個(全蛋白組漏切位點參數設置為1);可變修飾(variable modification):蛋白N端乙酰化(N-terminal acetylatin(+42.01 u)),甲硫氨酸上的氧化修飾(oxidation[M](+15.99 u)),天冬酰胺脫酰胺基(deamidated-N(+0.98 u))(僅限于糖蛋白);固定修飾(fixed modification):半胱氨酸的還原烷基化修飾(carbamidomethy[C],(+57.02 u));MS的質量誤差為40×10-6,MS/MS的質量誤差設為0.1 u,蛋白假陽性率(false discovery rate, FDR)設為1%;組間匹配(match between runs):匹配時間窗口為0.7;對齊時間窗口為20;非標定量參數:LFQ label-free定量,設定選擇獨有肽段(unique peptide)的強度信息進行定量。各組數據依據總強度信息進行強度歸一化后,組間通過肽段強度進行定量分析。
2 結果與討論
2.1 實驗方法
作為最廣泛的蛋白后修飾,糖基化修飾在疾病的發生和發展過程中受到較多關注。糖蛋白天然豐度較低,非糖基化肽會嚴重干擾糖肽的信號,因此蛋白富集是糖蛋白組學分析中的重要環節之一。 ZIC-HILIC是一種簡單、快速且高通量的糖蛋白富集方法,處理過程不需要衍生,且不破壞糖鏈結構,因此被廣泛應用于糖基化位點、完整糖肽和位點特異性的糖蛋白分析。本研究采用ZIC-HILIC對糖肽進行富集和分析,為了更準確地找到糖基化水平發生變化的蛋白質,選用未經富集的肽段進行定量分析,以蛋白質表達水平作為參考,同時找出差異蛋白質和糖基化水平發生變化的差異糖蛋白質信息,作為研究糖尿病發生發展的參考。
常規蛋白質組學研究采用的納升級液相色譜-質譜法(nano-LC-MS/MS)具有檢測靈敏度高的特點,但是也存在較多缺點。首先,nano-LC-MS/MS的負載容量低,導致生物基質中的濃度敏感度較低;其次,操作穩定性相對較差,需要耗費大量的人力、物力用來維護儀器,且分析通量相對較低,限制了其在大型隊列分析中的應用。為了增加分析通量,且保證定量分析的穩定性,本研究選擇微升級液相色譜-質譜法(micro-LC-MS/MS),同時采用label-free方法進行定量分析,一次分析12個樣品的蛋白質組差異和糖蛋白質組差異。
血清樣品取材侵入性小、易于保存,且包含了機體豐富的生理病理信息,是疾病早期診斷和預后研究中重要的生物樣品材料。因此,本研究以6例正常人與6例糖尿病人的血清為樣品,對其進行Trypsin酶解后分成2份,其中1份進行LC-MS/MS分析,得到全蛋白質組的定性和定量結果;另一份經HILIC富集糖肽與PNGaseF酶切糖肽后進行LC-MS/MS鑒定,得到糖肽的鑒定和差異表達結果,實驗流程示于圖1。

圖1 實驗流程圖Fig.1 Flow chart of analysis of serum
2.2 血清蛋白與糖蛋白定量結果分析
通過Maxquant搜庫得到6例正常人與6例糖尿病人血清樣品的質譜數據信息,在蛋白質水平上,選取2種樣品均含有的肽段進行去冗余,共鑒定出291個非冗余蛋白質和2 500條非冗余肽段;在糖肽水平上,首先以Deamidated為條件篩選出糖基化的肽段,選取2種樣品均含有的糖基化肽段去冗余,并找出具有糖基化位點序列特征(N-!P-S/T/C,其中!P不是脯氨酸)的肽段,結果共鑒定到181個非冗余糖蛋白和637條非冗余糖基化肽段。
采用Student’s T-test,以蛋白質在糖尿病患者血清和正常人血清中表達含量作為參考,找出具有顯著性差異的蛋白(P<0.05),并分別以兩組樣品中的蛋白強度平均值計算含量比值。為找到更多的差異蛋白質,采用表達量± 20%為差異,即蛋白在糖尿病患者血清中相比正常人血清升高1.2倍或者降低0.8倍為參考值[23-25]。在蛋白水平上共分析得到65種差異蛋白質,其中有29種顯著下調,36種顯著上調,結果列于表1。在糖蛋白水平上,分析得到24種正常人血清與糖尿病患者血清的差異糖蛋白,其中有17種顯著上調,7種顯著下調,并對糖蛋白的位點進行標注,結果列于表2。
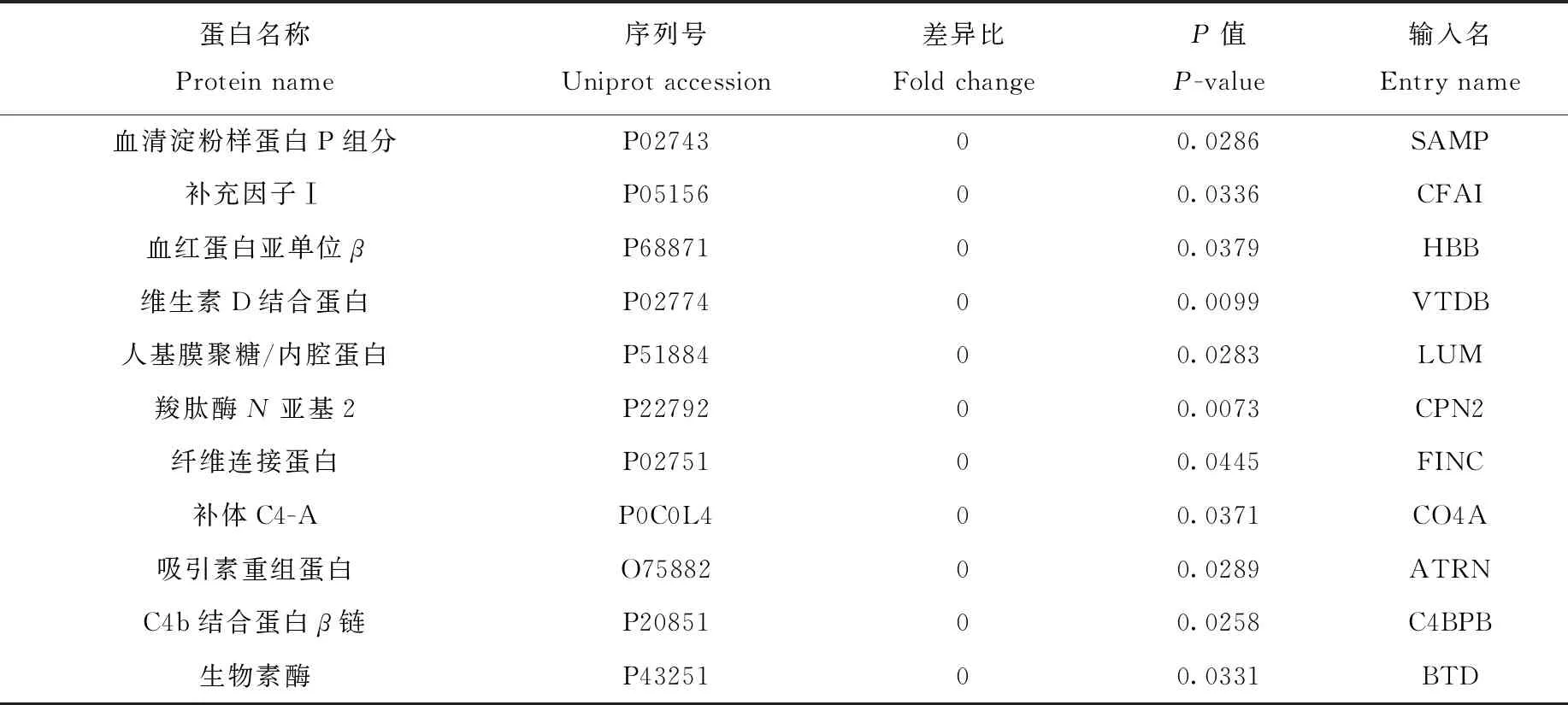
表1 蛋白水平上差異蛋白信息Table 1 Information of differential protein on protein level
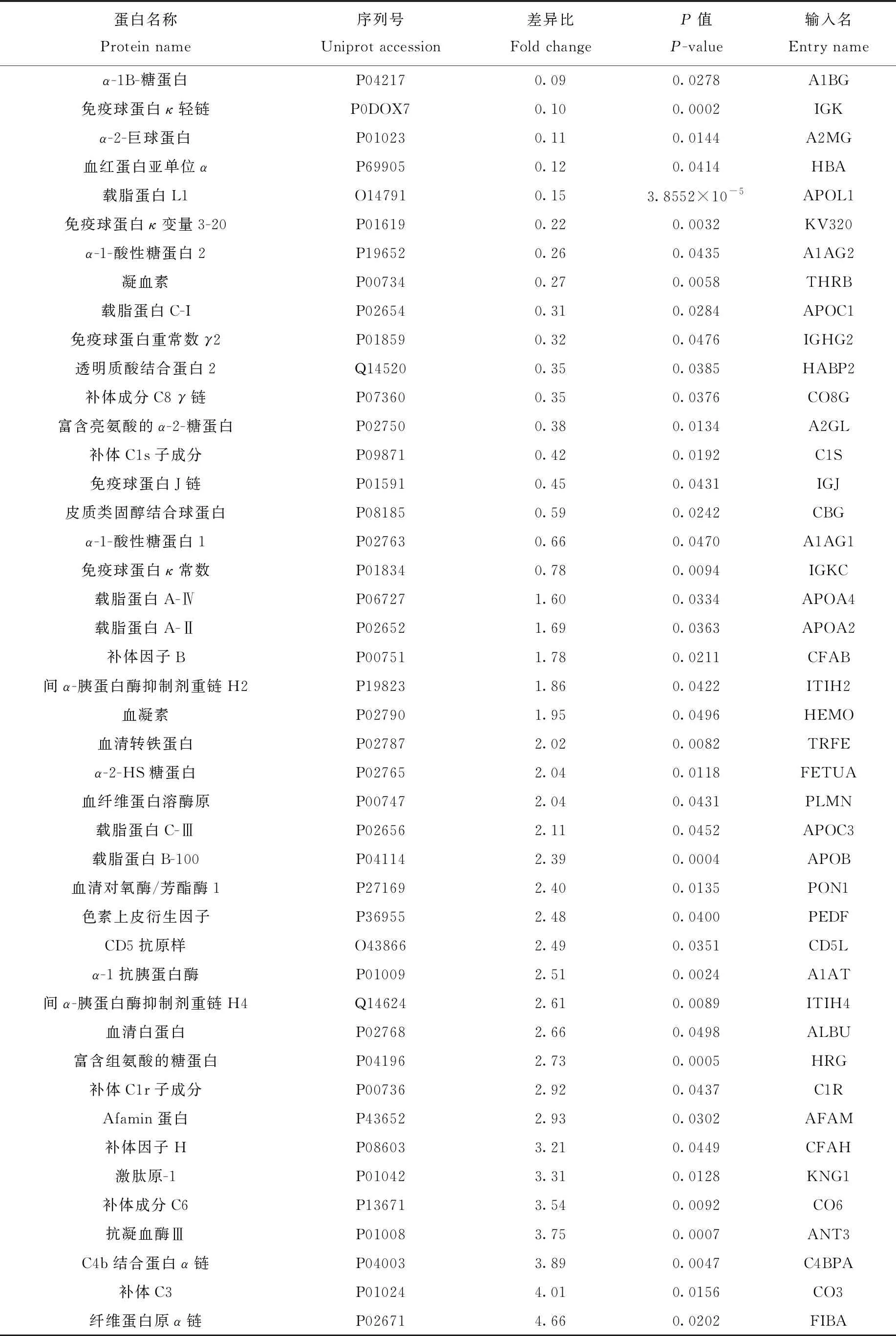
續表1
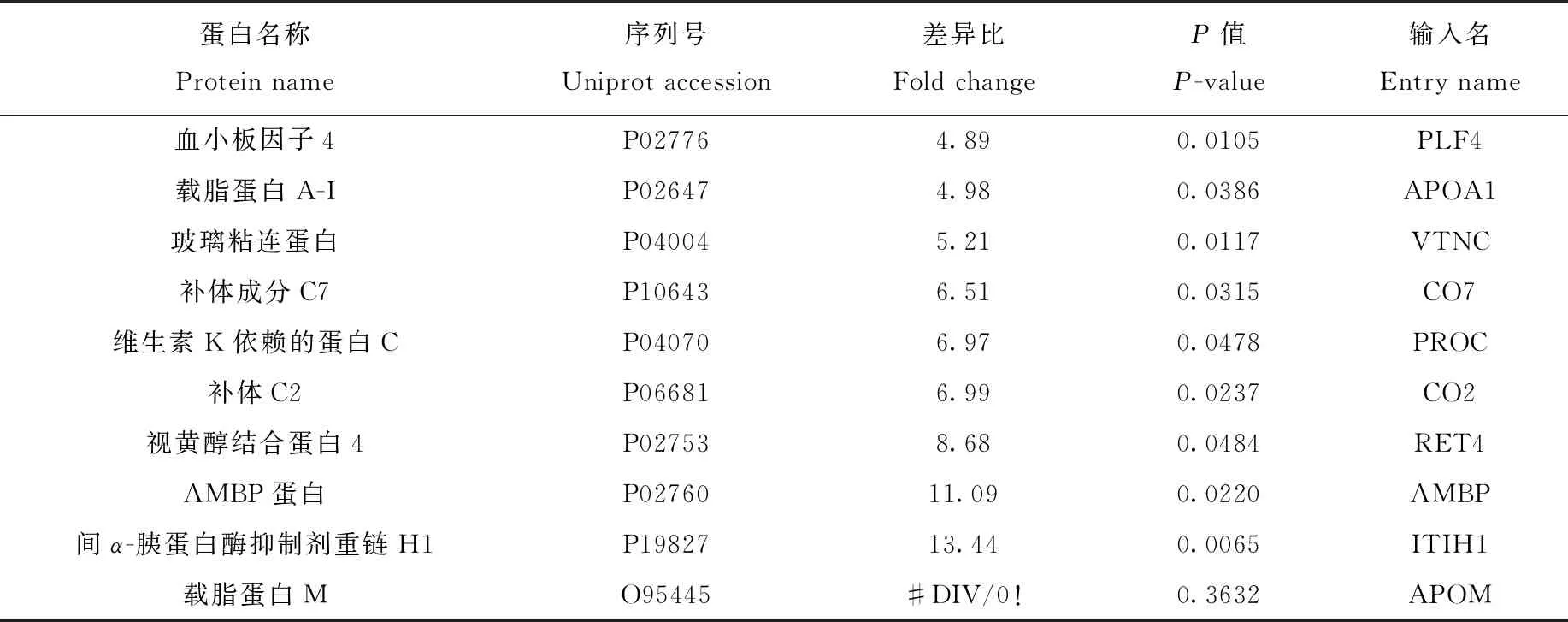
續表1
注:#DIV/0!代表正常血清6次重復中有0次有定量值的情況

表2 糖尿病人與正常人血清的差異糖蛋白信息Table 2 Differential glycoprotein information between diabetic and normal human serum
注:*表示糖蛋白的位點
2.3 蛋白與糖蛋白水平的比較分析
通過比較蛋白和糖基化水平的蛋白質,發現有21種蛋白質在蛋白水平上無差異而糖基化水平表達有差異,結果列于表3。選取其中2種代表性的糖蛋白進行分析。
硒蛋白P是一種特殊的細胞外糖蛋白,有研究表明[26-28],無論硒蛋白過量或缺乏,均會引起體內葡萄糖穩態的異常調節。本研究中,糖尿病患者血清中的硒蛋白P有1.7倍上調,根據文獻報道[27],硒蛋白P通過抑制肝臟中AMP活化蛋白激酶和乙酰CoA羧化酶的磷酸化水平抑制胰島素信號轉導,從而導致胰島素抵抗和糖尿病的發生和發展。
載脂蛋白B-100的主要功能是:1) 將膽固醇運送到外周組織;2) 識別、調節低密度脂蛋白受體與低密度脂蛋白的結合;3) 刺激血管平滑肌增生,與內膜基質結合[29]。結果表明,糖尿病患者血清中的載脂蛋白B-100的含量有2.83倍上調,可能是由于糖尿病患者血漿中低密度脂蛋白膽固醇濃度升高,或高血糖下低密度脂蛋白修飾使其無法進入正常的代謝途徑,從而引起病變[30]。

表3 蛋白水平無差異而糖基化水平有差異的蛋白質信息Table 3 Protein information with no difference in protein levels and difference in glycosylation levels
2.4 差異蛋白與糖蛋白的功能富集分析及比較
為了深入了解鑒定到的差異蛋白與差異糖蛋白所屬的細胞組分、對應的分子功能和參與的生物學過程,本實驗使用DAVID軟件(https:∥david.ncifcrf.gov/)對鑒定到的差異蛋白與差異糖蛋白進行基因本體功能富集分析(gene ontology, GO),結果示于圖2。
從圖2可見,差異蛋白質主要集中在血微粒、細胞外區域、胞外外泌體、細胞外間隙等區域;差異糖蛋白質主要集中于血微粒、細胞外區域、血小板、胞外外泌體等區域。在分子功能富集分析中,差異蛋白質行使的分子功能包括絲氨酸型肽鏈內切酶活性、絲氨酸型肽鏈內切酶抑制劑活性、肽鏈內切酶抑制劑活性、肝素結合等;差異糖蛋白的分子功能包括絲氨酸型肽鏈內切酶活性、肝素結合、絲氨酸型肽鏈內切酶抑制劑活性、免疫球蛋白A結合等。差異蛋白參與的主要生物學過程包括補體激活(經典途徑)、血小板解聚、補體激活的調節、補體激活等;差異糖蛋白參與的生物進程有血小板解聚、凝血(內在途經)、受體介導內吞作用、凝血等。
比較差異蛋白質與差異糖蛋白質功能富集結果,發現二者細胞定位接近;在分子功能上,差異蛋白質中絲氨酸型肽鏈內切酶活性、絲氨酸型肽鏈內切酶抑制劑活性所占比例與差異糖蛋白中相應比例相差較大;生物過程中,差異蛋白參與的生物過程較多,且分布相對均勻,差異糖蛋白中血小板解聚以及凝血相關過程所占比例較大。
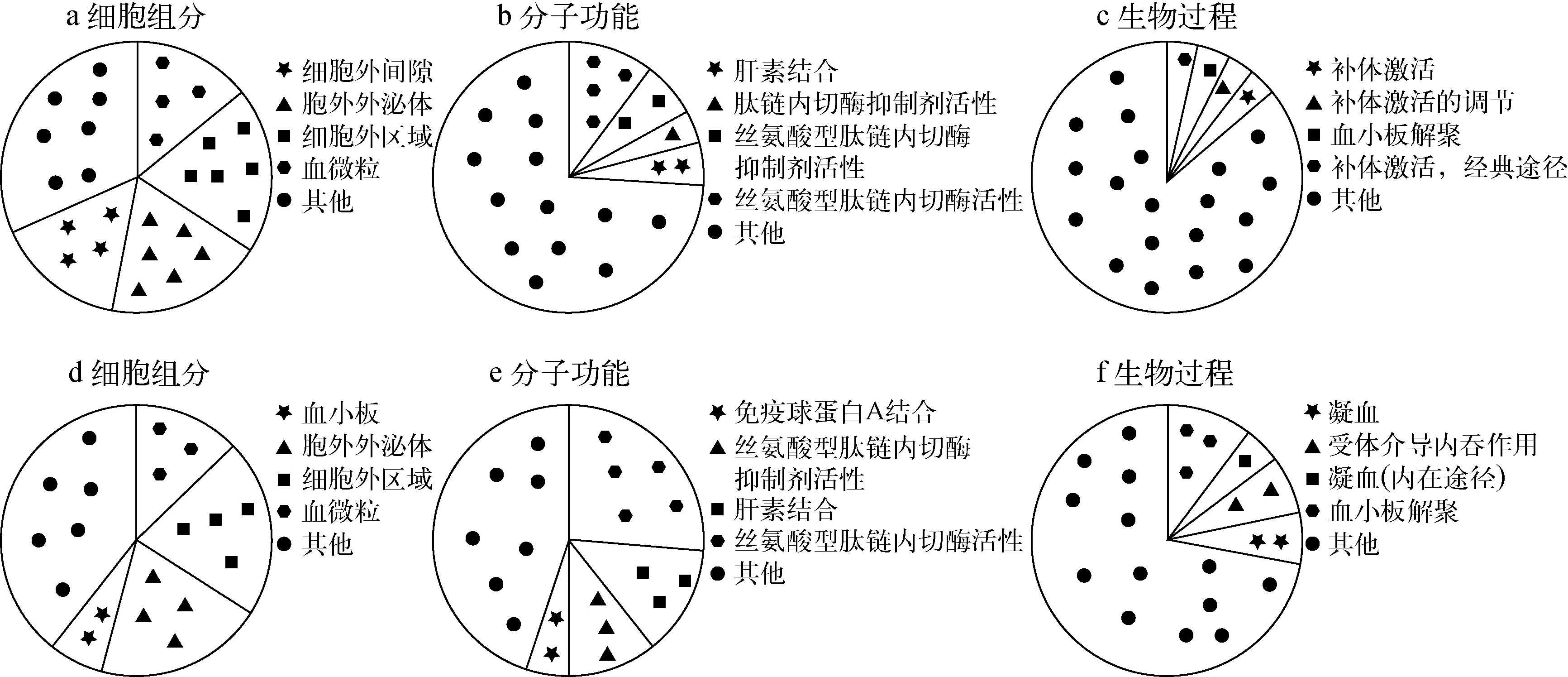
圖2 差異蛋白(a,b,c)與差異糖蛋白(d,e,f)的GO分析圖Fig.2 GO analysis of differentially expressed proteins (a, b, c) and differentially expressed glycoproteins (d, e, f)
3 結論
為揭示糖尿病發病過程中糖蛋白的變化,本研究根據糖尿病的特點以及分析要求,從樣品選擇、糖肽富集方法、LC-MS/MS分析和數據處理等方面進行了探討。選擇血清作為研究對象,并選用穩定性好的micro-LC-MS/MS方法進行label-free檢測,建立了基于所有肽段與ZIC-HILIC富集后肽段雙重定量的方法以確定蛋白質糖基化的差異。結果表明,實驗得到65個蛋白水平的差異蛋白,鑒定得到24種糖基化水平的顯著差異糖蛋白,該實驗可為復雜體系樣品分析、差異蛋白質的定性定量分析提供可靠準確的方法,同時為糖尿病的研究提供詳實的數據參考。

