利塞膦酸鈉對骨質疏松性骨折大鼠愈合影響及生物力學評價
柯呈輝,何立江,黃俊杰,杜思明,林樹峰,白海濱,吳文華
(福建醫科大學附屬第二醫院骨科,福建 泉州 362000)
骨質疏松癥(Osteoporosis,OP)是一種以低骨量為特征的疾病,導致骨質惡化和骨骼強度受損。它被認為是引起骨折的主要原因,在美國大約有1 000萬50歲以上成人受其影響[1]。據世界衛生組織(WHO)估計,全球每年有166萬例髖部骨折發生,預計到2050年該數字將增加4倍[2]。雖然絕經后女性服用雙膦酸鹽類藥物(bisphosphonate drugs,BPs)后典型骨折的發生率有所下降,但非典型骨折的發生率在過去十年中卻有所增加[3]。而BPs類藥物治療被認為是預防和治療OP的第一線,并且已在多項隨機對照試驗(randomized controlled trial,RCTs)[4-7])中被證明可降低典型髖部骨折的發生率。BPs通過增加骨礦物質密度和預防脆性骨折來實現這一目標[8-10]。然而,長期使用BPs有潛在的嚴重抑制骨轉換的風險,這可能損害骨重塑的能力,最終導致微損傷的累積以及骨韌性的降低和脆性的增加[11-19]。本實驗模擬短期內應用BPs類藥物對于骨質疏松性骨折(Osteoporotic l fracture,OPF)的愈合影響并進行生物力學分析,探討BPs類藥物與OPF愈合的相關性,為臨床OPF后短期應用BPs類藥物提供一定的依據。
1 資料與方法
1.1 實驗動物
1.1.1 動物 同時期健康6月齡雌性SD大鼠90只,所有動物均購自閩侯縣吳氏實驗動物貿易有限公司,在實驗前適應性喂養1周,室內分組籠養,室溫控制在(22±2)℃,8:00~20:00時自然光線照射,其余時間關燈。由專人喂養,自由飲水,并根據大鼠的生長速度調節飼料和飲用水的高度。所有飼料均購自閩侯縣吳氏實驗動物貿易有限公司。
1.2 試劑和器材 a)利塞膦酸鈉膠囊(江蘇正大清江制藥有限公司,江蘇)。b)水合氯醛(CP滬試,≥99.0%,250 g,國藥試劑cas302-17-0;上海)。c)克氏針若干,規格為直徑1.5 mm。d)DR數字化攝影機(德國,飛利浦公司)。e)骨組織標本制作裝置:切片機、載玻片、石蠟等(福建醫科大學附屬第二醫院病理科)。f)雙能X線吸收儀(美國,HOLOGIC公司)。g)常規動物手術器械(中國人民解放軍第180醫院骨科實驗室)。h)Endura TEC ELF 3200力學實驗儀器及其配套的Wintest生物力學測試軟件(Bose公司,美國)。
1.3 實驗前稱重和攝片 每只大鼠每周稱重并記錄。實驗時間為每天晚上6點到8點。時間為期1.5個月。所有大鼠均在10%水合氯醛(300mg/kg)腹腔注射下麻醉。麻醉后拍攝大鼠俯臥位片,將頭部和身體擺正后攝片。
1.4 動物分組及模型制作
1.4.1 動物分組 所有大鼠均獨立隨機分配在動物實驗箱里,箱子表面標記A1-A30、B1-B30、C1-C30,每天專人給予飼料喂養,自由飲水,采用相同的照明,并根據大鼠的生長速度調節飼料和飲用水的高度。
1.4.2 大鼠骨質疏松模型建立 a)A組:10%水合氯醛(300 mg/kg)腹腔注射麻醉后,選用背側入路,取脊柱旁開1 cm、髂骨脊上2 cm處為手術切口,縱行切開約1 cm,切開皮膚和皮下組織,分離肌層,暴露雙側卵巢。后逐層關閉切口。嚴格無菌手術操作,術后連續3d予肌注青霉素80萬單位,2次/d。術后籠中自由活動與進食。b)B、C組:10%水合氯醛(300 mg/kg)腹腔注射麻醉后,選用背側入路,取脊柱旁開1 cm、髂骨脊上2 cm處為手術切口,縱行切開約1 cm,切開皮膚和皮下組織,分離肌層,顯露腹腔內雙側卵巢,分別切除卵巢后殘端結扎,逐層關閉切口。嚴格無菌手術操作,術后連續3 d予肌注青霉素80萬單位,2次/d。術后籠中自由活動與進食。c)BMD值檢測:卵巢切除術后4周,在10%水合氯醛(300 mg/kg)腹腔注射麻醉下,檢測各組大鼠右側股骨中段BMD值,各組大鼠前后前后BMD均值對比,結果出現明顯差異提示骨質疏松模型建模成功。本實驗術后檢測中,未見大鼠死亡現象,各組大鼠BMD值測量結果差異均有統計學意義,證明骨質疏松模型造模成功,成功率為100%。d)股骨生物力學性能檢測:處死大鼠制作右側股骨病理標本,采用En-dura TEC ELF 3200力學實驗儀器進行4點彎曲試驗。頂端跨距為8 mm,底端跨距為20 mm,加載速度為1 mm/min。測量時保持各標本位置一致,并保持標本濕潤狀態。通過載荷-位移曲線獲得最大載荷;以骨折側股骨最大載荷占對側非骨折側股骨最大載荷比例表示骨折載荷恢復率。
1.4.3 OP大鼠骨折模型的制作 a)A組:10%水合氯酸(300 mg/kg)腹腔注射麻醉下,選取右側股骨中段為手術切口,縱行切開約1 cm,切開皮膚和皮下組織,分離肌層顯露股骨,逐層縫合各層組織。嚴格無菌手術操作,術后連續3 d予肌注青霉素80萬單位,2次/d。b)B、C組:10%水合氯酸(300 mg/kg)腹腔注射麻醉下,選取右側股骨中段為手術切口,縱行切開約1 cm,切開皮膚和皮下組織,分離肌層顯露股骨中段,線鋸于股骨中段,并橫行鋸斷股骨,選用直徑1.5 mm克氏針經髓腔固定骨折斷端,逐層縫合各層組織。嚴格無菌手術操作,術后連續3 d予肌注青霉素80萬單位,2次/d。c)給藥途徑與劑量:B組于骨折術后3 d開始每天給予0.1 mg/kg·d,利塞膦酸鈉灌胃治療;A、C組給予同等劑量0.9%生理鹽水灌胃。d)術后第3、6周:各組大鼠在術后第3、6周隨機抽取大鼠10只,處死并去除骨折內固定物,制作右側股骨病理標本,檢測右側股骨骨痂處BMD值,并進行生物力學檢測。
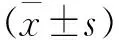
2 實驗結果
2.1 各檢測數值結果 在各組大鼠骨折建模過程中,BMD值進行組間、組內對比情況,建模前各組大鼠組間對比,P>0.05,差異無統計學意義,建模后3周與建模前、建模后6周與建模前各組間、組內比較,均P<0.05,差異有統計學意義。說明利塞膦酸鈉可促進骨質疏松性骨折愈合過程中BMD升高。結果見表1。

表1 各組大鼠骨質疏松性骨折建模前后BMD值比較
在各組大鼠骨質疏松性骨折建模前后生物力學性能組間、組內對比情況中,均P<0.05,差異有統計學意義,除了在最大載荷恢復率中,B、C組間對比,P>0.05,差異無統計學意義;在最大載荷中,C組組內對比,P>0.05,差異無統計學意義。說明利塞膦酸鈉可增強新生骨痂結構強度和力學強度。結果見表2。

表2 各組大鼠骨質疏松性骨折建模前后生物力學性能比較
3 討 論
OP是一種骨礦基代謝疾病,其特點主要為骨密度下降、骨礦物質削減,骨小梁稀松,進而致使骨機械強度下降、脆性增高,容易導致病理性骨折。OPF是OP最嚴重的并發癥之一,多發于老年人,發生率較高,因OP的特征故而導致OPF多呈粉碎型,愈合慢。且因骨強度低和骨脆性高而容易引起內固定松動和再骨折發生,故而殘疾率和死亡率相對較高[20]。就目前的研究現狀來說,BPs類藥物成為臨床防治OPF最常用的一線藥物,其治療目標是防止進一步的骨質流失,以減少初始或后續骨折的風險,故該類藥物的應用顯著降低OPF的發生:有文獻報道應用BPs后脊柱骨折發生率降低了40%~70%,髖部骨折發生率降低了40%~50%[21]。然而,考慮到BPs類藥物的主要作用機制,基于抑制破骨細胞活性和隨后抑制骨形成[22],人們擔心它們長期應用是否會延遲或損害骨折愈合的能力[22-26],甚至引起新發骨折形成。
本實驗就是基于這個思考而設計。本實驗主要探尋在OPF中,短期使用利塞膦酸鈉對于OPF愈合的影響,進而推測長期應用BPs類藥物引起新發骨折的可能原因。為臨床短期內應用BPs類藥物提供一定的依據。因為目前有相關研究表明,有相當一部分患者在發生嚴重骨質疏松性骨折后才接受了抗骨質疏松藥物治療。例如,Klop等[27]報道在英國人數將近達到了一半(45.5%)。Gillespie等[28]則指出,在美國有17.1%的女性在第一次髖部骨折后才接受了骨質疏松評估和治療。而根據對日本患者的調查,Hagino等[29]最近證實,大多數髖部脆性骨折的患者沒有接受預防第二次骨折的藥物治療。Iba等人[30]對730個骨質疏松患者進行調查,612例(83.8%)患者未接受任何抗骨質疏松癥藥物治療,僅有118例(16.2%)患者出院后接受骨質疏松癥藥物治療。所以探討患者發生OPF后,立即短期使用BPs類藥物對于骨折愈合的影響具有顯著的臨床意義。
在本實驗的結果中,我們發現大鼠發生OPF后,短期內使用利塞膦酸鈉可以促進骨質疏松性骨折愈合過程中骨折處BMD升高,增強骨結構強度和力學強度。這一點可以從BPs類藥物的藥效動力學方面解釋:BPs類藥物對骨骼有雙重作用。第一種是通過減少由于預防破骨細胞生成和促進破骨細胞凋亡而破壞破骨細胞的數量來阻止骨質流失[31-32],第二種是在各種病理條件下抑制骨細胞和成骨細胞凋亡[33-34]。利塞膦酸鈉作為第三代BPs類藥物,主要是通過抑制促進破骨細胞的形成、分化成熟及凋亡過程的焦磷酸法尼酯合酶(FPPS)形成來起作用的,進而相對的促進骨形成過程,促進骨礦化。且利塞膦酸鈉具有在骨折處蓄積效應。因為事實上,BPs類藥物從骨骼中消除的半衰期長達10年[35]。通過觀察,停止BPs類藥物治療8年后患者尿液中仍可檢測到帕米膦酸納水平[36]。故在本實驗檢測的BMD結果中,我們不難發現BMD的變化趨勢存在一定程度上的時間依賴性,即隨著時間的進展增加速度增快。
在本實驗結果中,骨折處BMD明顯升高情況下,骨痂的生物力學存在如下特性:在短期使用利塞膦酸鈉情況下,最大載荷和最大載荷恢復率明顯升高,且在一定程度上存在時間依賴性。3組大鼠在組間或組內對比中,骨痂的最大載荷、最大載荷恢復率均隨時間的延長逐漸減少,但在B組中各時間點的最大載荷均高于同期C組,且差異有統計學意義,說明可能在髓內釘固定和使用利塞膦酸鈉后,骨折斷端存在的微動和利塞膦酸鈉均能促進骨痂的礦化,使得最初在骨折端形成的體積較大的纖維骨痂向骨性骨痂轉化,骨重塑階段最先開始,骨痂的體積逐漸變小,力學性能也不斷提高。而且一定程度的力學刺激也可以促使骨髓間充質干細胞向成骨細胞轉化。在礦化骨痂形成以后,新生骨痂即進入重塑階段。在這個階段,主要是機械應力的變化影響骨的形成。而且Sigurdsen等學者[37]在觀察大鼠脛骨骨折模型過程中,發現軸向壓縮與軸向拉伸相比,其更能促進骨的礦化程度、機械強度及剛度上升。
本研究僅觀察了OPF后6周內使用利塞膦酸鈉對于骨折愈合情況的影響,所研究時間跨度不長。目前臨床上對于OPF患者是否短期內應用BPs類藥物促進骨折愈合仍不明確,這也是本實驗探究OPF患者短期內應用利塞膦酸鈉的必要性。本實驗需進一步擴大實驗的研究時間跨度,進一步了解時間因素對于骨折愈合情況的影響。且本實驗在探究BPs類藥物的用藥劑量、用藥頻率、用藥方式等方面存在局限性,這幾方面也是可能影響骨折愈合的危險因素。本實驗中,樣本量較小,其結果的穩定性可能不足,同時還應該對于骨痂進行病理切片,進一步了解骨痂的組織構成及成分。

