感染性骨不愈合中的主要治療方法比較
郭佳琪,楊朝暉
(1.山西醫科大學,山西 太原 030001;2.山西醫科大學第二醫院骨科,山西 太原 030001)
感染性骨不愈合指的是骨折6~8個月后骨折斷端仍不愈合并且存在感染的骨折。造成感染的原因可能是由于微環境、異常活動、手術清創失敗、斷端吸收等,從而抑制骨骼再生[1]。感染性骨不愈合在開放骨折、慢性骨髓炎或者內固定失敗的患者中常常見到,臨床表現除了骨折斷端不愈合之外,軟組織及骨缺損、竇道及分泌物均是主要臨床表現。目前,感染性骨不愈合患者的治療有很多方法,其中主要有Ilizarov技術、Masquelet技術、血管化自體骨移植等,骨成形蛋白(bone morphogenetic proteins,BMPs)的應用也出現在感染性骨不愈合以及骨髓炎的治療中。
本研究收集了在山西醫科大學第二醫院創傷骨科使用Ilizarov技術和使用Masquelet技術治療的感染性骨不愈合患者,分析其臨床效果差異及各自的優缺點,為臨床實踐提供了理論依據。
1 資料與方法
1.1 臨床資料 回顧性分析2015年1月至2018年1月山西醫科大學第二醫院骨科中感染性骨不愈合患者30例,其中男19例,女11例;年齡20~65歲,平均(32.6±11.22)歲。12例采用Masquelet技術治療,18例采用Ilizarov技術治療。感染的骨缺損涉及19個脛骨和11個股骨。5例患者出現膿性引流,2例靜止,3例感染活躍。骨缺損長度37.62~188.57 mm,平均(96.76±29.52)mm。對針道感染的診斷基于多個臨床表現,如針道發紅、膿性排出物、軟組織疼痛以及壓痛。統計治療時間、治療費用、手術次數、并發癥及療效評價,比較兩種技術優劣。
診斷標準:骨折6~8個月后,骨折斷端不愈合且有感染存在,軟組織及骨缺損、竇道及分泌物等。骨折端微動,影像學可見斷端骨折線清晰[2]。
納入標準:a)明確診斷患者;b)10~65歲;c)對側下肢功能完好的患者;d)患者遵醫囑,配合度高,資料完整。e)所有患者均由同一組的外科醫生團隊治療。排除標準:a)非感染性的骨不愈合患者;b)伴有病理性骨折不愈合者;c)資料不全、病例丟失的患者;d)不遵醫囑,不配合治療,不定期復查的患者;e)妊娠期或哺乳期婦女。
1.2 手術方式
1.2.1 Masquelet技術組 Ⅰ期清創階段:麻醉妥后,患者取仰臥位。術前抗生素靜滴,消毒鋪單。仔細切開各層組織,清除、沖洗感染區域,徹底清創后取出死骨,測量骨缺損,并在I期手術使用抗生素聚甲基丙烯酸甲酯(polymethylmethacrylate,PMMA)骨水泥,每40g骨水泥加入2 g萬古霉素,調和塑形后填充缺損。固定方法取決于骨折的類型和位置。Ⅱ期植骨階段:即第1階段后6~10周,沿原入路找到骨水泥表面纖維膜組織,即誘導膜[3]。誘導膜的情況下小心移除骨水泥,清理髓腔,檢查有無感染。髂骨松質骨剪碎,形成顆粒狀[4],包裹斷端,置引流管,無張力縫合傷口。使用合適的固定方法(內固定、外固定等)固定患肢。
1.2.2 Ilizarov技術組 I期清創階段:與Masquelet技術組基本相同。在清創術完成之后,使用外固定架臨時固定,一般選用環形外固定架。Ⅱ期截骨階段:在清創術完成之后,使用環形外固定架固定。做1~2 cm切口暴露預選的截骨部位,截骨器截斷,安置環形外固定架,采用開放換藥及真空封閉引流等方法清理復雜的大面積軟組織創口。
1.3 術后治療 兩組患者均接受適當的抗炎消腫營養治療。Masquelet技術組患者4周內不負重功能鍛煉,檢查感染情況。在4~6周時通常需要使用拐杖部分負重,復查觀察恢復情況,判斷有無感染[5]。Ilizarov技術組術后3 d開始適度功能鍛煉,骨轉運前潛伏期為7~10 d。術后7 d開始搬移,前1周為0.75 mm/d,1周后為1 mm/d,將要結束時速度減為0.25 mm/d,直到患者在骨質接觸部位感到疼痛。術后加強釘道護理,每日碘伏擦洗釘道口,每2周復查,觀察骨搬移情況,判斷有無感染及并發癥[6-7]。
1.4 治療結果評價 統計Masquelet技術組、Ilizarov技術組兩組的愈合時間、并發癥情況、手術次數、整體醫療費用、治療結果。骨折愈合情況及肢體活動情況,我們使用Paley評定標準來對兩組數據進行評估。
1.5 數據處理 采用SPSS Statistics 25軟件進行統計分析。對所有變量進行描述性統計,對于獨立樣本的兩組數據,通過t檢驗以評估兩組內部的差異。對于不同組之間,則使用χ2檢驗比較差異。P<0.05為差異有統計學意義。
2 結 果
2.1 治療結果 Masquelet技術組隨訪12~21個月,平均(17.07±2.69)個月;愈合時間4~13個月,平均(6.00±2.17)個月。Ilizarov技術組隨訪17~26個月,平均(17.34±2.34)個月。愈合時間8~26個月,平均(19.22±3.52)個月。
2.2 手術次數 兩組手術次數平均為(4.53±1.20)次,Masquelet技術組平均為(4.33±0.98)次,Ilizarov技術組平均為(4.88±1.07)次。控制感染及治療缺損手術次數見表1。

表1 兩組各自所需手術次數比較次)
2.3 治療費用 Masquelet技術組平均治療費用(8.00±3.01)萬元,Ilizarov技術組平均治療費用(9.5±3.53)萬元,差異有統計學意義(P<0.05)。
2.4 缺損長度 Masquelet技術組平均缺損長度(5.41±1.92)cm,治愈時間(6.00±2.17)個月。Ilizarov技術組平均缺損長度(5.50±2.33)cm,治愈時間(19.22±3.52)個月。
2.5 并發癥 Ilizarov技術組并發癥13例,釘道感染5例,骨不愈合4例,軟組織缺損導致凹陷3例,力線偏離1例。Masquelet技術組并發癥7例,骨吸收5例,感染未控制2例.
2.6 術后功能恢復 Masquelet技術骨愈合情況:優5例,良6例,中1例,優良率91.6%。肢體活動情況:優6例,良3例,中2例,差1例,優良率75%。Ilizarov技術骨愈合情況:優7例,良9例,中1例,差1例,優良率88.9%。肢體活動情況:優5例,良10例,中2例,差1例,優良率83.33%。兩組術后功能差異無統計學意義(P>0.05)。
2.7 典型病例 Masquelet技術組典型病例為一35歲男性患者,右股骨髓內釘術后9個月余。入院時右下肢畸形明顯,骨折斷端處皮膚紅腫,診斷為右股骨髓內釘內固定斷裂、骨不愈合,入院后第5天行內固定取出術+清創術+抗生素骨水泥安置+外固定架安置術。術后8周再次入院,行外固定架取出+骨水泥取出+松質骨植入+內固定術。術后12周開始負重鍛煉。術后9個月隨訪,患者右下肢恢復良好,骨折端已愈合。手術前后影像學資料見圖1~4。
Ilizarov技術組典型病例為一40歲男性患者,左脛腓骨開放性骨折,急診行清創+外固定架安置術+左腓骨內固定術,4周后仍有感染,入院后診斷為左脛骨開放性骨折術后骨不愈合。入院第2天行清創+截骨+Ilizarov環形外架安置術。術后開始功能鍛煉,并開始行骨搬移術。18個月后拆除外固定架,患者患肢功能逐漸恢復(見圖5~7)。
3 討 論
3.1 控制感染及手術次數 本研究兩組手術次數無明顯差異,但是在感染和骨缺損方面手術次數差異有統計學意義。Ilizarov技術的清創次數較低,這是因為Ilizarov技術對于骨量要求較低,清創控制感染時可大范圍清除壞死組織和死骨,充分清理可有效控制感染,從而減少因控制感染而實施的手術數量。Simpson等[8]認為在治療骨不愈合及骨髓炎時去除所有壞死和感染的骨骼是必不可少的。在控制感染方面,Ilizarov技術獲得了極大地肯定[9]。Ilizarov提出,應先處理骨缺損,由于骨缺損的治療使得局部血運得以重建,從而可解決感染問題。大量臨床實踐表明,Ilizarov技術效果十分顯著,但缺點是復發較多[10]。而Masquelet技術感染控制方面并不滿意,Masquelet技術[3]是由Masquelet2000年首次描述,由于骨量要求高,導致在I期清創時容易殘留細菌,從而加重感染風險,而生物膜也有可能帶有細菌,存在于流動性的軟組織中。最近的一項研究[11]報道了12例使用誘導膜技術治療的創傷患者,只有5例愈合(42%),另外5例患者在治療期間出現感染性并發癥,2例因嚴重感染需要截肢。近兩年,人們逐漸認為僅在植入骨水泥后的最初幾天達到的局部高濃度抗生素,有助于治療廣泛的骨橋接后感染的軟組織。因此,通常推薦慶大霉素/萬古霉素或根據抗菌譜有效的親水性抗生素的混合物,并將其用于骨水泥中。由此可見,在控制感染方面Ilizarov技術具有明顯的優勢。

圖1 一期術前X線片示右股骨遠端髓內釘斷裂,骨折線清晰 圖2 一期術后X線片示清創后股骨力線適當,斷端缺損骨水泥填充 圖3 二期術后X線片示松質骨填充完整,內固定位置適宜
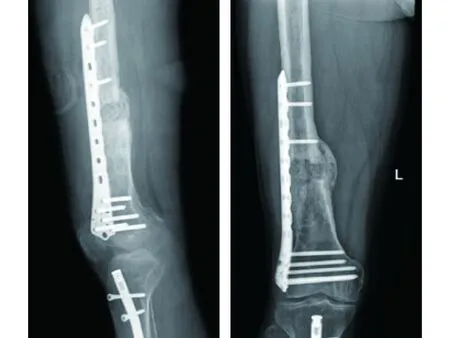
圖4 二期術后9個月X線片示植骨融合

圖5 感染后術前X線片示左脛骨骨折線清晰

圖6 術后第2天X線片示Ilizarov外固定架安置可,力線恢復,可進行骨搬移

圖7 術后18個月拆除外固定架,骨缺損患肢功能逐漸恢復
在治療骨缺損方面,Ilizarov技術應用張力-應力法則,即在緩慢穩定的牽拉過程中促進組織生長,從而修復缺損、重建肢體。應注意釘道感染、周期過長引發患者心理因素,牽拉速度不應過快[12]。Masquelet技術操作簡單,愈合速度快。因此,在骨缺損治療次數方面,Ilizarov技術時間較長,給患者帶來了一定的負擔,導致心理和生理壓力。建議在Ilizarov技術實施手術前,應對患者及其家屬詳細解釋所有手術過程及細節。骨缺損的治療目前有自體植骨、帶血管的腓骨移植、膜誘導技術、骨搬移術等。自體顆粒狀植骨適用于骨缺損小于4 cm的情況,大段骨缺損則由于原料問題不適宜使用[13]。而在感染的情況下,更由于存在骨吸收現象,不適宜推廣。
3.2 治療費用 Ilizarov技術與Masquelet技術相比,Masquelet技術費用較低,差異具有統計學意義(P<0.05)。Masquelet技術主要支出為PAMA相對高昂的價格以及清創手術費用。Ilizarov技術的主要支出為環形外固定架及并發癥的處置費用。
3.3 治療結果
3.3.1 骨愈合方面 感染:Ilizarov技術在開始的清創手術中,可以徹底清創;而Masquelet技術前期是通過置入PAMA來控制感染。畸形:Ilizarov技術使用的是牽拉組織再生原理,在漫長的骨搬移過程中,可以隨時對力線進行調整。而雙下肢不等長方面,骨搬移可以十分有效的降低下肢不等長的情況;Masquelet技術后期取出PAMA后,植入自體骨,則是通過固定來調整力線,糾正畸形。
3.3.2 肢體活動方面 日常活動:Ilizarov技術由于環形外固定架安置較早,可以在術后很短的時間內進行康復活動。不過,由于長期有環形外固定架的阻擋,關節活動會受到限制,容易導致關節僵直,關節僵直需要在治療結束后拆除外固定架才能恢復功能鍛煉。Masquelet技術由于有骨吸收和不愈合的并發癥風險,相對會影響患者的日常活動。且由于Ⅰ期清創過程漫長,患者可能無法在術后及時下地恢復功能鍛煉,在日常活動、關節僵直方面有一定的不便。疼痛:Ilizarov技術主要存在于重建完成后的疼痛;而Masquelet技術主要在于并發癥。兩組術后均可達到滿意的療效,且兩組無明顯差異,說明二者均可有效的治療感染性骨不愈合帶來的骨缺損問題。
3.4 并發癥 在目前的研究中,并發癥是不可避免的。長時間佩戴Ilizarov外部固定架導致許多并發癥[14-15],如釘道松動及感染、斷裂、畸形愈合、關節僵直、復發感染、骨移植。Masquelet技術目前亦有許多并發癥,主要包括:骨吸收、骨不愈合復發、延遲愈合、神經血管損傷等[16-17]。其中,該技術對軟組織環境需求較高。
3.5 展望 近年來,新的方法技術也為治療提供了新的思路[18]。例如,體外沖擊波治療(extra-corporeal shock wave therapy,ESWT)[19]。ESWT是一種眾所周知的治療腎結石碎裂的方法,但在過去的幾十年中,ESWT越來越多地用于骨生長刺激。Valchanou和Michailov使用ESWT治療延遲愈合和骨不連,并報告了82例骨折中70例骨性愈合,沒有任何并發癥。在這些有希望的結果之后,已經發表了更多的研究,其中ESWT用于延遲愈合和不愈合治療。Schlumberger等[20]則在研究異位骨化為自體骨移植治療脛骨骨不連合骨缺損。
此外,Giannoudis等[21]開發并描述了治療鉆石概念,根據成骨細胞、骨傳導支架、機械環境、生長因子、血管這幾個方面評估骨不愈合,為骨不愈合的評估提供了更加有效的方法。Miska等[22]使用鉆石概念治療肱骨干骨折骨不愈合。
總之,兩組均可達到很好的療效。在優劣性方面各有優勢:a)Ilizarov技術可以徹底清創并控制感染,手術后可以早期下地[11];b)Masquelet技術操作簡單,可選擇內固定進行二期治療,從而對術后恢復有極大幫助;c)Ilizarov技術費用較貴,病程長,對患者的身心均有較大影響;d)Masquelet技術對骨量需求大,存在失敗風險;e)Masquelet技術需要很好的軟組織環境[23],而Ilizarov技術可進行后期調節。

