多花黃精植株再生及繁殖研究
2
(1.福建農林大學園藝學院, 福州 350002;2.蘭科植物保護與利用國家林業與草原局重點實驗室, 福州 350002)
多花黃精(PolygonatumcyrtonemaHua)屬于百合科( Liliaceae )黃精屬(PolygonatumMill.)多年生草本藥用植物[1-2]。分布在東北、華北、西北和華東等地,多花黃精集藥用、觀賞和食用價值于一體,根莖含淀粉、煙酸、黃酮、多種氨基酸、維生素、多種皂甙,具有益氣養陰、強壯筋骨、治療風濕痛、降血脂、降血壓、降血糖、抗衰老及抗腫瘤等作用[3-7]。隨著多花黃精藥用價值的開發,野生資源被人為肆意挖掘破壞嚴重,使得有限的野生資源逐漸減少[8-9]。
由于多花黃精種子繁殖后代性狀分化嚴重,不能通過播種大量繁殖苗木[10]。繁育培養既能實現植物個體的快速大量繁殖,又能較好地保持植物的種質特性[11],是實現多花黃精工廠化育苗,加快良種推廣應用的關鍵技術。有關多花黃精的組培快繁技術已有不少研究[12-19],但主要集中在根莖繁殖[13],使用未成熟黃精莢果進行芽萌發誘導少見報道。為了建立一套高效、高質、快速的多花黃精工廠化育苗體系,本實驗在前人對多花黃精組培快繁技術研究與生產實踐的基礎上,選取優質多花黃精母株上成熟度為70%的莢果為外植體進行繁育,研究不同激素、不同生長素配比、不同光照強度控制等因素對多花黃精種子芽萌發誘導、芽增殖誘導、瓶苗生根誘導及移栽的影響,建立了多花黃精植株再生體系。

圖1 A為野生多花黃精植株,B為成熟度為70%莢果
1 材料與方法
1.1 材 料
試驗材料采自福建泰寧大田鄉壘際村夏家地海拔500 m的林下,選擇長勢良好黃精植株作為母株,取顆粒飽滿、無病蟲害、成熟度為70%的莢果,用濕紗布包裹帶回實驗室,置4 ℃冰箱中保存備用。
1.2 外植體處理
用洗衣粉清洗去除莢果表面塵埃,置于流水下沖洗干凈,純水沖蕩2~3遍,置于超凈工作臺內用體積分數為75%酒精消毒30 s,用5%次氯酸鈉消毒10~15 min并加入2~3滴吐溫80,無菌水沖蕩3~4遍后,用無菌濾紙吸干材料表面水分備用。
1.3 培養基與培養條件
基本培養基為MS,附加蔗糖 20 g·L-1、瓊脂 7.0 g·L-1、活性炭 0.5 g·L-1,pH值為5.8,溫度為(23±2)℃,初始接種的培養體在暗培養條件下5~10 d,然后移到光照強度為0~2 000 lx 遞增培養,光照時間為每天10 h。
1.4 外植體選擇
將無菌處理后的莢果,用無菌手術刀剝除外種皮,把剝除種皮后的種子接種到MS培養基上,附加蔗糖20 g·L-1、瓊脂7.0 g·L-1、活性炭0.5 g·L-1,pH值為5.8,總計5個組,每組接10瓶,每瓶接入3粒種子,重復3次。在溫度(23±2)℃下暗培養10 d。10 d后移到光照強度為0~2 000 lx下培養,光照時間為每天10 h。30 d后統計萌發率,用于研究不同成熟度對種子萌發的影響。
萌發率(%)=(每組萌發種子粒數/每組接種種子粒數)×100%。
1.5 誘導種子萌發
將無菌處理后的種子,用無菌手術刀剝除外種皮,把剝除種皮后的種子接種到MS基本培養基,附加蔗糖 20 g·L-1、瓊脂 7.0 g·L-1、活性炭 0.5 g·L-1,pH值為5.8,然后將不同質量濃度的BA、NAA分組加入,總計15個組,每組接10瓶,每瓶接入3粒種子,重復3次。在溫度(23±2)℃下暗培養10 d。10 d后移到光照強度為0~500 lx遞增培養,光照時間為每天10 h。30 d后統計萌發率,研究不同質量濃度BA、NAA配比對多花黃精種子芽誘導萌發的影響。
誘導萌發率(%)=(萌發粒數/接種總粒數)×100%。
1.6 誘導芽增殖
當種子抽出莖葉并長出胚根時,切取莖段,將其轉入MS基本培養基中進行增殖培養,附加蔗糖 20 g·L-1、瓊脂 7.0 g·L-1、活性炭 0.5 g·L-1,pH值為5.8,然后將不同質量濃度的BA、KT、NAA分組加入(見表2),總計9組,每組接10瓶,重復3次,每瓶接入3個莖段。在溫度(23±2)℃,光照強度從500~1 000 lx遞增,光照時間為每天10 h。培養30 d(見圖3)后統計各處理的誘導芽數和增殖率,從中篩選出最適宜多花黃精誘導芽增殖的培養基。
芽增殖率(%)=(每組增殖粒數/每組接種粒數)×100%。
1.7 誘導瓶苗生根
經誘導芽增殖培養后,選取長勢健壯的植株,接種到1/2 MS基本培養基進行生根培養(見圖4),附加蔗糖 20 g·L-1、瓊脂 7.0 g·L-1、活性炭 0.5 g·L-1,pH值為5.8,然后將不同質量濃度的IBA和IAA分組加入(見表3),總計16組,每組接10瓶,重復3次,每瓶接入1棵植株,溫度(23±2)℃,光照強度從1 000~2 000 lx遞增,光照時間為每天10 h。培養40 d(見圖3)后統計生根率和平均生根數,從中篩選出最適宜多花黃精誘導瓶苗生根的培養基。

圖3 A為接種30 d,B為接種40 d

圖2 去除莢果種皮接種于MS培養基
生根率(%)=(生根苗數/接種苗數)×100%;
平均生根數=每組根數總和/每組接種苗數。
1.8 煉苗與移栽
經生根培養后,選取健壯植株試管苗,置自然光溫室環境下煉苗5~8 d,打開瓶蓋煉苗3~5 d,將根表面殘留培養基沖洗干凈,移栽到V(腐殖質)∶V(粉碎落葉)=2∶1、V(腐殖質)∶V(沙子)=1∶1及V(泥炭土)∶V(腐殖質)∶V(珍珠巖)=6∶3∶1的3種混合基質中,每盆種植1株在溫室環境下培養,移栽苗第1次水澆透,每隔3 d澆水1次(可根據不同季節、天氣來調整),光照強度保持在1 000~2 000 lx,溫室內空氣濕度保持在75%~85%之間,避免陽光直射。30 d后統計成活率,篩選出最適宜多花黃精瓶苗移栽的基質。
成活率(%)=(成活總數/移栽總數)×100%。
1.9 數據分析
采用DPS分析軟件進行數據處理及方差分析,多重比較采用顯著系數為0.05的Duncan新復極差法分析評價差異顯著性。所有處理應用正交試驗設計法,計算結果用“平均數±標準差”表示。
2 結果與分析
2.1 不同成熟度莢果對種子萌發的影響
由表1可知,不同成熟度莢果對種子萌發具有不同的影響;30 d后統計發現,萌發率最高。
表1 不同成熟度莢果對種子萌發的影響
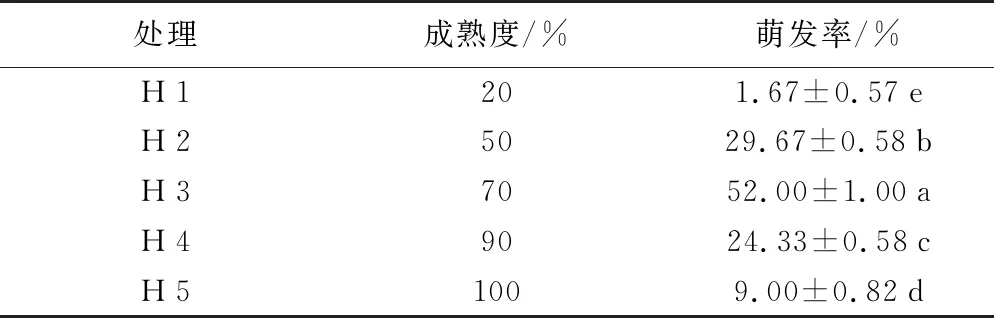
處理成熟度/%萌發率/%H120 1.67±0.57eH25029.67±0.58bH37052.00±1.00aH49024.33±0.58cH5100 9.00±0.82d
注:表中同列不同小寫字母表示差異顯著水平。下同。
2.2 不同濃度NAA、BA對芽誘導的影響
以MS為基本培養基,將不同濃度的NAA、BA分組加入,在溫度(23±2)℃下暗培養10 d。10 d后移到光照強度為0~500 lx條件下培養,光照時間為每天10 h。30 d后統計萌發率,由表2可知:在不加NAA的W 2到W 5中,隨著BA濃度的遞增,芽誘導萌發率呈先增后減的趨勢;當BA濃度為0.5 mg·L-1時,萌發率最高,為61.33%,效果最明顯;隨著BA濃度從0.5 mg·L-1到1.5 mg·L-1增加,萌發率呈遞減趨勢;當BA濃度為1.5 mg·L-1時,抽出的芽有死亡的預兆。在不加BA的W 6和W 11中,隨著NAA濃度的增加,誘導萌發率較低,與空白對照的W 1無顯著性差異;在W 7到W 10中,當NAA濃度為0.1 mg·L-1時,隨著BA濃度的增加,誘導萌發率呈遞減趨勢,BA濃度為0.5 mg·L-1時,效果最明顯;W 12到W 15呈現出與W 6到W 11一致的現象。在W 2、W 7、W 12中,BA濃度為0.5 mg·L-1不變,隨著NAA濃度從0 mg·L-1到0.3 mg·L-1遞增,誘導萌發率呈遞減趨勢,且BA濃度為0.5 mg·L-1、NAA濃度為0 mg·L-1時,效果最明顯。綜上:多花黃精種子芽誘導培養最適宜的培養基為MS+BA 0.5 mg·L-1+瓊脂7.0 g·L-1+蔗糖 20 g·L-1+活性炭 0.5 g·L-1。

圖4 A為增殖誘導,B為移栽
表2 不同質量濃度NAA、BA對芽誘導的影響
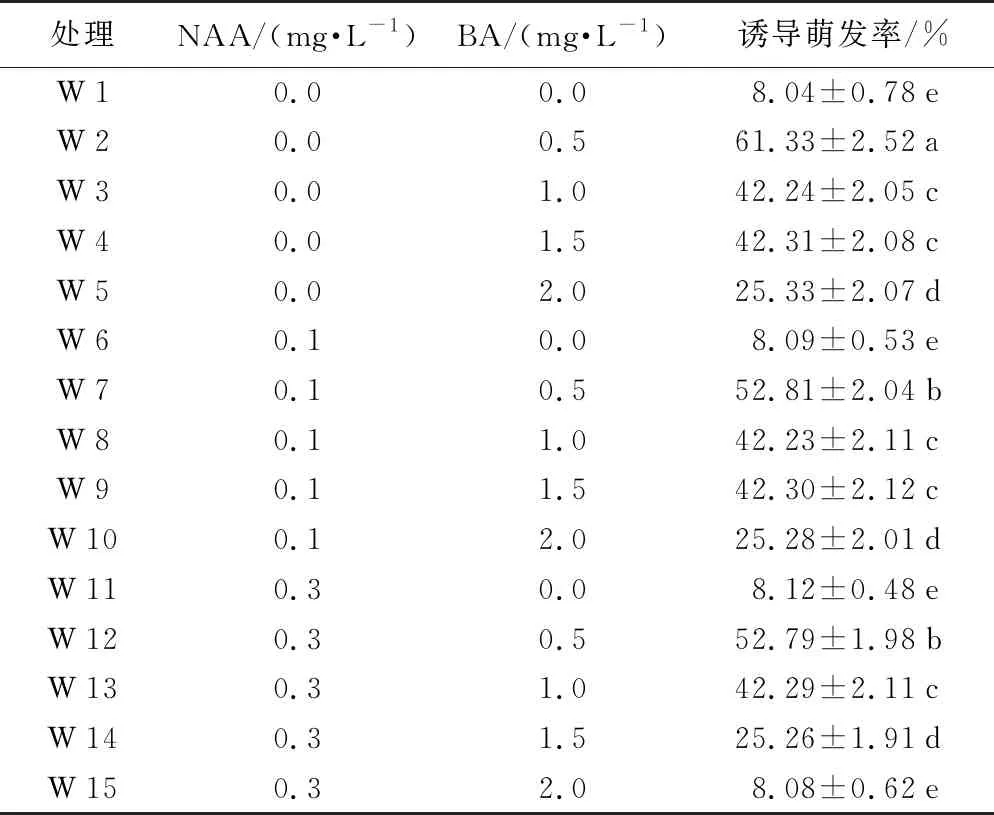
處理NAA/(mg·L-1)BA/(mg·L-1)誘導萌發率/%W10.00.0 8.04±0.78eW20.00.5 61.33±2.52aW30.01.0 42.24±2.05cW40.01.5 42.31±2.08cW50.02.0 25.33±2.07dW60.1 0.0 8.09±0.53eW70.1 0.5 52.81±2.04bW80.1 1.0 42.23±2.11cW90.1 1.5 42.30±2.12cW100.1 2.0 25.28±2.01dW110.3 0.0 8.12±0.48eW120.3 0.5 52.79±1.98bW130.3 1.0 42.29±2.11cW140.3 1.5 25.26±1.91dW150.3 2.0 8.08±0.62e
2.3 不同濃度激素配比對誘導芽增殖的影響
由表3可知,不同濃度激素配比對多花黃精誘導芽增殖具有不同的影響;經增殖培養,30 d后統計發現,在M 1、M 4、M 7中,KT為0.5 mg·L-1,隨著BA濃度的遞增,誘導芽數和增殖率都呈遞增趨勢,當BA濃度為1.5 mg·L-1,叢生芽較多,有效芽少,可知高濃度BA有利于增殖倍數的增加,抑制有效芽產生;在M 4到M 6中,BA為1.0 mg·L-1,隨著KT濃度的遞增,NAA濃度的遞減,誘導芽數和增殖率M 5>M 6>M 4,表明在KT濃度為1.0 mg·L-1時,出芽情況最佳;在M 2、M 4、M 7、M 8處理中,誘導芽數和增殖率沒有顯著性差異,但NAA濃度為0.5 mg·L-1的M 2和M 4較NAA濃度為0.3 mg·L-1和 0.1 mg·L-1的M 7和M 8長勢差,M 7和M 8中芽苗長勢好,葉色綠;NAA為0.3 mg·L-1時,接種的材料有毛細根生成,且生長較快。芽苗長勢最好且有效芽最多的是處理M 5,效果最明顯;綜上:多花黃精誘導芽增殖培養的適宜培養基為MS + NAA 0.3 mg·L-1+ BA 1.0 mg·L-1+ KT 1.0 mg·L-1+ 蔗糖 20 g·L-1+ 瓊脂 7.0 g·L-1+ 活性炭 0.5 g·L-1,誘導芽數為3.42個,芽增殖率為76.74%,且長勢好,生根快。
2.4 不同濃度激素配比對誘導生根的影響
由表4可知,不同濃度激素配比對誘導生根具有不同的影響,經生根培養,40 d后統計發現,在只加入IAA的P 2到P 4中,隨著IAA濃度遞增,生根率和平均生根數呈遞增趨勢;在只加入IBA的P 5到P 7中,隨著IBA濃度的遞增,生根率和平均生根數呈遞增趨勢;從表4可看出,在相同濃度下,只加入IBA培養基各方面指標明顯優于只加入IAA的培養基;故生根培養誘導能力IBA>IAA。在加入不同濃度、不同配比的P 8到P 10中,IAA為0.5 mg·L-1,IBA從0.5 mg·L-1到1.5 mg·L-1遞增,生根率和平均生根數呈遞減趨勢;P 11到P 13和P 14到P 16與P 8到P 10結果一致;即IBA為0.5 mg·L-1最有利于瓶苗生根。在加入IBA 0.5 mg·L-1和IAA 1.0 mg·L-1的P 11中,生根率為81.71%,平均生根數為6.11個,效果最明顯;綜上:多花黃精瓶苗生根培養適宜培養基為1/2 MS+IAA 1.0 mg·L-1+IBA 0.5 mg·L-1+蔗糖20 g·L-1+瓊脂7.0 g·L-1+活性炭0.5 g·L-1。
2.5 移栽基質的選擇
經移栽培養,30 d后統計發現,在V(腐殖質)∶V(落葉)=2∶1、V(腐殖質)∶V(沙子)=1∶1及V(泥炭土)∶V(腐殖質)∶V(珍珠巖)=6∶3∶1三種混合基質中都能成活,移栽成活率分別為72%、65%、85%,因此移栽的適宜基質為V(泥炭土)∶V(腐殖質)∶V(珍珠巖)=6∶3∶1的混合基質。
表3 不同濃度激素配比對誘導芽增殖的影響
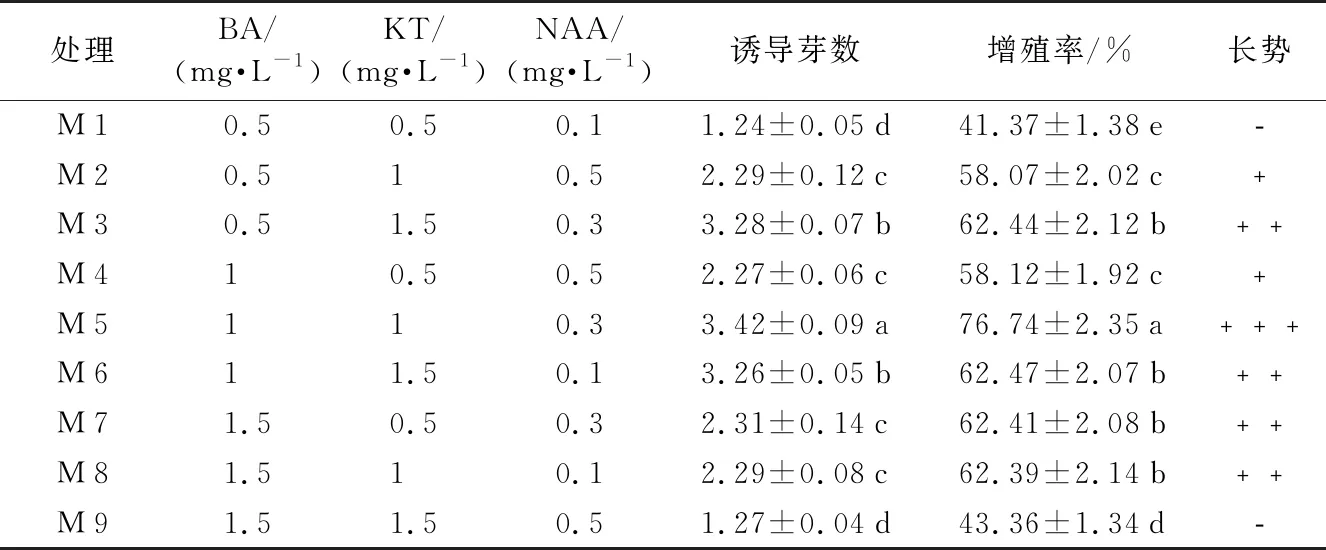
處理BA/(mg·L-1)KT/(mg·L-1)NAA/(mg·L-1)誘導芽數增殖率/%長勢M10.50.50.11.24±0.05d41.37±1.38e﹣M20.510.52.29±0.12c58.07±2.02c﹢M30.51.50.33.28±0.07b62.44±2.12b﹢﹢M410.50.52.27±0.06c58.12±1.92c﹢M5110.33.42±0.09a76.74±2.35a﹢﹢﹢M611.50.13.26±0.05b62.47±2.07b﹢﹢M71.50.50.32.31±0.14c62.41±2.08b﹢﹢M81.510.12.29±0.08c62.39±2.14b﹢﹢M91.51.50.51.27±0.04d43.36±1.34d﹣
注:“﹢﹢﹢”表示長勢好,“﹢﹢”表示長勢較好,“﹢”表示長勢一般,“﹣”表示長勢差。下同。
表4 不同濃度的激素配比對誘導生根的影響
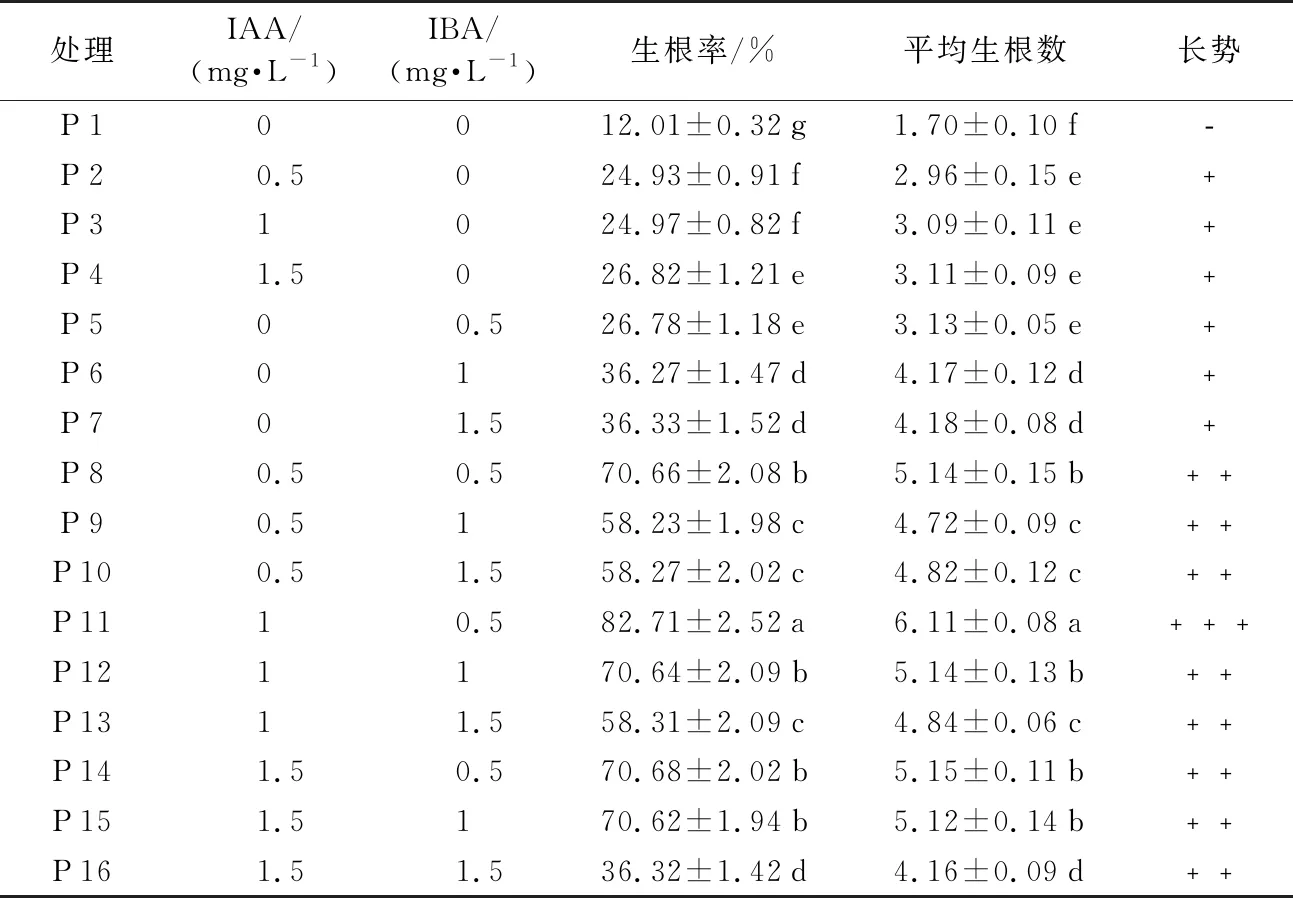
處理IAA/(mg·L-1)IBA/(mg·L-1)生根率/%平均生根數長勢P10012.01±0.32g1.70±0.10f﹣P20.5024.93±0.91f2.96±0.15e﹢P31024.97±0.82f3.09±0.11e﹢P41.5026.82±1.21e3.11±0.09e﹢P500.526.78±1.18e3.13±0.05e﹢P60136.27±1.47d4.17±0.12d﹢P701.536.33±1.52d4.18±0.08d﹢P80.50.570.66±2.08b5.14±0.15b﹢﹢P90.5158.23±1.98c4.72±0.09c﹢﹢P100.51.558.27±2.02c4.82±0.12c﹢﹢P1110.582.71±2.52a6.11±0.08a﹢﹢﹢P121170.64±2.09b5.14±0.13b﹢﹢P1311.558.31±2.09c4.84±0.06c﹢﹢P141.50.570.68±2.02b5.15±0.11b﹢﹢P151.5170.62±1.94b5.12±0.14b﹢﹢P161.51.536.32±1.42d4.16±0.09d﹢﹢
3 討 論
3.1 外植體的選擇
本研究以成熟度為70%的野生多花黃精母株上的莢果為外植體,在繁育過程中發現,取完全成熟的果子比70%成熟度莢果為外植體的萌發時間要遲30~35 d,成熟度為20%~50%的種子萌發時間較成熟度70%種子萌發率低,萌發生長不一致甚至出現死亡發黑現象。內源激素ABA會抑制胚的萌發,誘導種子休眠;而多花黃精種子在成熟過程中,前期ABA含量較高,中期ABA含量最低,完熟期ABA變高[20]。這與本研究結果一致,因此,選擇莢果成熟度為70%的野生多花黃精為外植體,更有利于解除種子休眠,促進離體培養時種子的萌發。
3.2 芽誘導培養中存在的問題
在芽誘導培養中,在W 2到W 5中,隨著BA濃度遞增,種子萌發率呈先增后減的趨勢;當BA濃度為0.5 mg·L-1時,萌發率最高,為61.33%;隨著BA濃度(0.5~1.5 mg·L-1)的增加,萌發率呈降低趨勢;當BA濃度為1.5 mg·L-1時,抽出的芽有死亡的預兆;在W 2、W 7、W 12中,BA濃度為0.5 mg·L-1不變,隨著NAA濃度從0~0.3 mg·L-1遞增,誘導萌發率呈遞減趨勢,表明NAA在多花黃精芽誘導培養中沒有明顯作用。由于黃精種子在打破休眠,生長期長、難以取材等方面有一定的難度,所以有關使用未成熟黃精莢果進行芽萌發誘導的研究少有報道。在繁育培養中,多花黃精種子易于消毒,較根莖容易建立無菌體系[21]。本研究61.33%的芽誘導率不太理想,希望能為多花黃精種子芽誘導萌發培養提供材料。
3.3 芽增殖培養中存在的問題
在誘導芽增殖培養中,若要提高增殖倍數需增加BA和KT的用量,但得到的芽苗細弱,相反若想讓芽苗長得完整、健壯,則增殖倍數就會降低[22],這與本研究結果一致,當BA濃度為1.5 mg·L-1時,增殖倍數增加,有效芽少;因此,在既保證有效健壯芽的增加又能提高增殖倍數的情況下,選擇出多花黃精種子誘導芽增殖最適宜的培養基是MS+BA 1.0 mg·L-1+KT 1.0 mg·L-1+NAA 0.3 mg·L-1+蔗糖20 g·L-1+瓊脂7.0 g·L-1+活性炭0.5 g·L-1;誘導芽數為3.42個,芽增殖率為76.74%。
表5 不同基質配方對瓶苗移栽成活的影響

處理基質成活率/%V1V(泥炭土)∶V(腐殖質)∶V(珍珠巖)=6∶3∶185V2V(腐殖質)∶V(沙子)=1∶165V3V(腐殖質)∶V(粉碎落葉)=2∶172
3.4 生根培養中存在的問題
本研究結果表明:生根培養時以1/2 MS為基本培養基,加入IBA 0.5 mg·L-1和IAA 1.0 mg·L-1后,效果最佳,生根率為81.71%,這與劉紅美等[23]的研究結果不同,這可能與試驗中使用的藥品來源、碳源種類、光照時間、光照強度、培養時間或黃精的種源等不同有關;本研究還得出不同質量濃度的生長素對生根培養的誘導能力IBA>IAA,這與周新華等[24]的研究結論相同。然而,由于試驗規模和時間的限制,加之生根培養受多種因素的影響[25],本研究僅從IBA和IAA的不同配比、溫度、光照時間及光照強度等幾方面入手探討其對黃精誘導生根的影響;未能從不同添加劑、不同激素種類及其濃度與配比、不同基本培養基等對誘導生根的影響問題進行探討,有不足之處還需要作進一步的試驗研究。
3.5 不同光照強度對多花黃精種子離體培養的影響
通過觀察,誘導芽增殖培養時,將瓶苗從500 lx移到1 000 lx下,培養幾天后,發現在突然增加光照強度時,瓶苗出現黃化,長勢不良的狀況;誘導生根時,從1 000 lx移到2 000 lx則不會出現這樣的現象;綜上,多花黃精種子誘導芽增殖培養時對光照強度較敏感,需要一定的適應階段,在繁育過程中可根據不同的生長階段供給不同區間的光照強度,光照強度從0~2 000 lx遞增培養,光照時間為每天10 h,幫助植物盡快適應外部環境;多花黃精誘導生根培養時對光照強度適應性強,這與周新華等[24]的研究結論相同。
4 結 論
本試驗以成熟度為70%的優質多花黃精種子為外植體,進行了種子萌發、芽增殖、瓶苗生根和移栽的研究,建立多花黃精植株再生體系。芽誘導適宜培養基為MS+BA 0.5 mg·L-1+KT 0.5 mg·L-1瓊脂7.0 g·L-1+蔗糖20 g·L-1+活性炭0.5 g·L-1;芽增殖適宜培養基為MS+BA 1.0 mg·L-1+KT 1.0 mg·L-1+NAA 0.3 mg·L-1+蔗糖20 g·L-1+瓊脂7.0 g·L-1+活性炭0.5 g·L-1;生根適宜培養基為1/2 MS+IBA 0.5 mg·L-1+IAA 1.0 mg·L-1+蔗糖20 g·L-1+瓊脂7.0 g·L-1+活性炭0.5 g·L-1;瓶苗移栽適宜基質為V(泥炭土)∶V(腐殖質)∶V(珍珠巖)=6∶3∶1的混合基質。
試驗結果表明:采用成熟度為70%的優質多花黃精莢果為外植體,進行繁育培養。通過該技術建立的再生體系可獲得61.33%以上的正常萌芽;芽增殖培養時,誘導芽數為3.42個,芽增殖率為76.74%;經瓶苗生根培養,生根率為81.71%,平均生根數為6.11個;經煉苗移栽,成活率達85%。

