銅耐受定向馴化強化嗜酸喜溫硫桿菌浸出貧黃銅礦
崔亞銓 馮守帥 黃興 陳金才 楊海麟
(1. 江南大學生物工程學院 江南大學教育部工業微生物技術重點實驗室,無錫 214122;2. 無錫市城市環境科技有限公司,無錫 214026;3. 中糧貿易內蒙古有限公司農業產業化部,呼和浩特 010000)
隨著全球工業化發展,金屬需求量居高不下,全球高品位、易處理礦產儲量不斷下降,利用生物浸出對低品位礦產資源進行提煉受到重視[1-2]。傳統高溫冶煉主要針對高品位精礦且成本高、耗能高,而生物浸出具備成本低廉、綠色無污染、操作簡便等特點,可有效提煉貧尾礦及廢棄物中的金屬離子[1-4]。
貧黃銅礦是一類含硫低品位礦石,約占世界銅礦產總儲量的70%,在生物浸出中的應用受到越來越多的重視,但由于其面心四面體結構浸出難度大,在酸浸或細菌浸出中效果均不理想。在貧黃銅礦浸出體系中,質子作用礦物促使其溶解釋放出金屬離子和還原性硫化物等[1]。硫桿菌利用礦物表面硫化物獲取能量,同時生成質子進一步作用于礦石促進銅離子溶出[5]。在浸出前期銅離子濃度低,對微生物生長影響較小,隨著礦物不斷溶出,高濃度銅離子對浸出微生物產生毒害,影響其生物活性進而影響浸出效果[6-8]。因此該類浸礦微生物的銅耐受性能在浸出體系中非常關鍵。
喜溫硫桿菌(Acidithiobacillus caldus)是一類革蘭氏陰性化能自養菌,能適應浸出過程中的高溫環境,并利用礦物中還原性硫化物作為能量來源[9-10]。王玉光等[11]發現A. caldus在浸出初期通過對硫化物的氧化促進礦物中Fe2+的釋放,幫助其他能夠利用Fe2+作為能源物質的浸出菌株進行生長,是硫化銅礦浸出中的優勢菌株之一。Watkin等[12]在廢硫化銅堆中選擇性富集分離出A. caldusDSM 8584T菌株。
本研究對實驗室保藏的A. caldus進行適應性銅耐受定向馴化,獲得具備銅抗性菌株,比較馴化菌株與出發菌株在銅脅迫下的生長參數差異性,并在銅脅迫體系中初步應用馴化菌株浸出,研究出發菌株與馴化菌株浸出差異及浸出體系中參數變化,旨在為未來類似的生物浸出工業應用提供參考。
1 材料與方法
1.1 材料
實驗菌株為A. caldus,馴化后菌株保藏于中國典型培養物保藏中心,保藏編號為CCTCC M 2018727。 改 良 Starkey液 體 培 養 基(g/L):(NH4)2SO40.3、KH2PO43.0、K2HPO40.3、MgSO40.24、KCl 0.1、Ca(NO3)20.01、升化硫 5.0,1 mL 微量元素(g/L,Na2SO425,FeCl33.3,H3BO31,MnSO41,ZnSO40.4,Na2MoO40.34,CoCl20.21,CuSO40.25),調節pH至1.8。硫粉經過常壓間歇式滅菌,微量元素經過濾滅菌,兩者于接種前加入培養基。
浸出礦樣為安徽銅陵冬瓜山銅礦采集的貧黃銅礦,由黃銅礦、磁黃鐵礦、黃鐵礦和磁鐵礦組成,礦石粉碎后過300目篩,控制礦物顆粒直徑小于48 μm。超純水輕柔洗滌礦樣表面灰塵,置于玻璃干燥器自然干燥備用。
pH計,梅特勒-托利多儀器有限公司;離子色譜儀,美國賽默飛世爾科技公司;Quanta-200型掃描電鏡,荷蘭FEI公司;傅里葉變換紅外光譜儀,美國尼高力儀器公司;X射線衍射儀D8型,德國布魯克AXS公司;原子吸收光譜儀Z-8000,日本日立公司。
1.2 方法
1.2.1 菌株銅耐受性定向馴化 將生長至對數中期出發菌株轉接到含0.5 g/L Cu2+改良Starkey培養基中培養,將適應性菌株不斷轉接至含更高銅濃度的Starkey復合培養基進行馴化,每次轉接Cu2+濃度提高0.5 g/L。直至菌株不能在更高銅濃度下生長,選取當前菌株為馴化菌株。將經過6個多月馴化獲得的適應性銅耐受馴化菌株與出發菌株在0、1及3 g/L Cu2+條件下培養,每天測定其菌體量變化。
1.2.2 適應性菌株銅脅迫下浸出貧黃銅礦 將生長至對數生長中期的出發菌株及馴化菌株以10%的接種量轉接至200 mL改良Starkey培養基中,添加20 g/L貧黃銅礦,添加Cu2+濃度分別為0、1及3 g/L,在40℃、轉速170 r/min條件下進行浸出實驗。浸出過程中每2 d調節pH為2.0,保持酸浸環境。定期檢測體系中pH及硫酸根濃度。
1.2.3 分析方法
1.2.3.1 菌體濃度及生長曲線測定 核酸法測定菌體濃度,培養液離心(367×g,2 min)除去單質硫成分,取0.5 mL稀釋至合適濃度的菌液于1.5 mL離心管中,加入1.5 mL的5%三氯乙酸,于80℃水浴25 min,冰水冷卻后以5%三氯乙酸為對照,在260 nm下測定吸光度。根據吸光度與顯微鏡計數建立的標準曲線計算菌體濃度,每隔1 d測定菌體濃度繪制生長曲線。
1.2.3.2 浸出體系中游離菌體濃度及礦渣吸附菌體濃度測定 取浸出液離心(367×g,2 min)除去礦渣顆粒,核酸法測定游離菌體濃度。收集1 mL浸出混合液于離心管中,離心收集礦渣,加1 mL無菌水后在旋渦振蕩器上振蕩2 min,3次,將附著于礦渣表面的菌振蕩到體系中,離心去除礦渣后測定上清液中菌體濃度來推算礦渣吸附菌體濃度。
1.2.3.3 浸出過程中pH測定 通過pH計測浸出液中的pH值變化。浸出過程中每2 d測定1次pH變化。
1.2.3.4 浸出過程中硫酸根濃度測定 將浸出液稀釋至合適濃度,經過0.45 μm濾膜過濾后通過離子色譜法測定硫酸根濃度。色譜條件:色譜柱為Dionex Inopac AS11-HC陰離子分析柱(250 mm×4 mm),檢測器為電導檢測器,淋洗液為20 mmol/L KOH溶液,淋洗液流量1 mL/min,進樣體積10 μL,出峰時間在4.87 min。
1.2.3.5 礦渣SEM觀察 離心(365×g,2 min)收集浸出結束后礦渣,烘干后取少量制樣于電鍍膜并在銅板上固定,在掃描電子顯微鏡下觀察礦渣形貌。
1.2.3.6 礦渣FITR分析 將礦渣樣品與KBr按l∶100的比例在瑪瑙研缽反復研磨混勻,保持環境干燥,通過油壓器壓片后,用傅里葉變換紅外光譜儀測定紅外吸附光譜。
1.2.3.7 礦渣XRD分析 取適量礦渣研磨后填平于檢測盤中心凹陷處,將檢測盤放置于檢測夾上,用X射線衍射儀在2-Theta(°)下進行掃描。檢測圖譜通過軟件MDI Jade 5.0結合PDF卡片庫進行分析。
1.2.3.8 礦渣硝化處理及銅離子含量測定 取0.1 g礦渣置于250 mL燒杯中,用少量超純水潤濕,加入15 mL濃HCL加熱3 min。隨后加入5 mL濃HNO3,加熱至大部分水分蒸干,冷卻后用超純水吹洗杯壁,再次加熱至蒸干。最后加入4 mL 6 mol/L HCL和25 mL超純水,加熱溶解可溶性鹽類后過濾定容到100 mL容量瓶中。將硝化液稀釋至合適濃度,在原子吸收光譜儀上測定銅離子濃度并換算礦渣中含銅量。
2 結果
2.1 菌株銅耐受性定向馴化及馴化菌株生長性能分析
以A. caldus為出發菌株,經過6個多月的適應性銅耐受定向馴化,初步獲得了具有較強耐受銅脅迫壓力的馴化菌株A. caldusCCTCC M 2018727。在0、1及3 g/L Cu2+下出發菌株與馴化菌株生長情況,如圖1所示,在1 g/L Cu2+脅迫下,出發菌株最高菌體量由對照體系1.68×108cells/mL急劇下降到0.79×108cells/mL,比對照組推遲4 d在第10天達到μmax。在3 g/L Cu2+脅迫下出發菌株菌體量進一步下降,生長更加緩慢。而馴化后菌株在1 g/L Cu2+脅迫下生長受到輕微抑制,菌體量保持在1.85×108cells/mL水平,在第6天達到μmax。在3 g/L Cu2+脅迫下馴化菌株生長受到較大抑制,菌體量降低到1.34×108cells/mL并在第10天達到μmax。

圖1 不同銅脅迫培養下主要生化參數
2.2 銅脅迫浸出體系中pH及硫代謝變化規律探究
貧黃銅礦生物浸出體系中pH及SO42-濃度變化如圖2所示。浸出前2 d各體系pH水平急劇上升,在3 g/L Cu2+浸出體系下馴化菌株pH值由2.0提高到2.96,出發菌株pH值由2.0上升到2.42。隨著浸出進行,在浸出中后期各體系pH均下降到2.0左右。浸出過程中SO42-濃度變化如圖2-B所示,在相同脅迫條件下,馴化菌株體系中SO42-濃度均高于出發菌株。由于不同脅迫條件下加入CuSO4含量不同,SO2-初始濃度存在差異。隨浸出進行,體系中SO2-44濃度不斷上升,表明礦物內還原性硫化物不斷被利用。在相同脅迫條件下浸出過程中,馴化菌株浸出體系SO42-濃度高于出發菌株。在3 g/L Cu2+浸出體系中,馴化菌株浸出體系中SO42-濃度比浸出開始時提高了4.88 g/L,而出發菌株僅提高了3.21 g/L,說明馴化菌株在浸出環境中對還原性硫化物利用能力更強。

圖2 不同浸出體系中主要參數變化
2.3 銅脅迫浸出體系中不同組分生物量變化
分析浸出體系中游離在體系中菌體濃度及吸附在礦物表面菌體濃度變化,如圖3所示。各體系中菌體量變化趨勢基本相同,馴化菌株游離菌體濃度高于出發菌株。在0、1及3 g/L Cu2+脅迫體系中,馴化菌株最終游離菌體濃度分別比出發菌株提高18.56%、23.91%及100.01%。隨著浸出體系脅迫濃度增高,馴化菌株與出發菌株浸出差異增大,高脅迫濃度下馴化菌株生長更具優勢。在3 g/L Cu2+脅迫體系中馴化菌株最高吸附菌體濃度達到2.11×107cells/mL,比出發菌株提高94.66%。

圖3 不同浸出體系中生物量變化
2.4 銅脅迫下不同抗性菌株作用礦渣形貌差異
SEM觀察礦渣表面形貌如圖4所示,對照組中礦渣表面腐蝕痕跡明顯,較多細微溝壑出現,同時大量硫顆粒及衍生物暴露在表面。馴化菌株作用下礦渣腐蝕程度更高,有更多的硫顆粒暴露。在1-2 g/L Cu2+脅迫體系中菌體生長受到脅迫抑制,礦物表面腐蝕痕跡相對減少,生成黃鉀鐵礬較多。相比之下,馴化菌株作用痕跡比出發菌株更加明顯。在3 g/L Cu2+脅迫體系中,出發菌株體系中礦物表面較為光滑,馴化菌株腐蝕痕跡強于出發菌株,但與此同時礦物表面也有較多黃鉀鐵礬生成。

圖4 不同浸出體系中礦渣SEM分析
2.5 FTIR分析礦渣關鍵官能團差異
FTIR分析礦渣表面官能團如圖5所示。礦渣表面吸收峰主要在 750 cm-1、1 000 cm-1、1 100 cm-1、1 650 cm-1、3 400 cm-1處出現。其中在1 650 cm-1和3 400 cm-1處的吸收峰與N-H伸縮振動和彎曲振動相關,在1 100 cm-1處的吸收峰與S=O的伸縮振動相關,在750 cm-1、1 000 cm-1處的吸收峰與SO2-4相關。對照組浸出體系中,馴化菌株作用下礦渣表面特征吸收峰比出發菌株體系變得更加尖銳,隨著脅迫作用增強,吸收峰強度變弱。在3 g/L Cu2+脅迫條件下,出發菌株體系中1 100 cm-1處的吸收峰消失,而馴化菌株體系中該峰仍保留。
2.6 XRD分析礦渣成分差異

圖5 不同浸出體系礦渣FTIR分析
利用XRD技術分析不同體系礦渣成分差異性。如圖6所示,礦渣表面主要成分包括:FeS2、KFe(SO4)2(OH)6、CuFeS2、Fe3O4、CuO、FeS、CaSO4、Cu2O、FeCO3、(NH4)3Fe(SO4)3、Cu8S5和CaCO3。礦物成分主要為硫、鐵和銅化合物,隨脅迫濃度增強礦渣中FeS2和CuFeS2兩種物質吸收峰增多。各浸出體系礦渣中均含有黃鉀鐵礬成分,且隨脅迫作用增強該物質吸收峰增多。馴化菌株浸出體系中隨脅迫濃度提高有(NH4)3Fe(SO4)3生成,該物質也會在礦物表面造成鈍化效果不利于浸出。在各體系中還形成了一些中間產物,如Fe3O4、FeS、Cu8S5、CuO和Cu2O等。
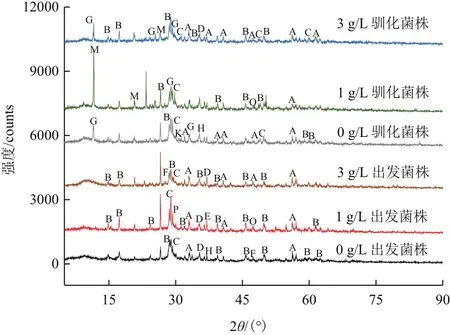
圖6 不同浸出體系礦渣XRD分析
2.7 銅浸出率比較
各體系銅離子浸出率如圖7所示。在0、1及3 g/L Cu2+浸出體系中馴化菌株最終浸出率分別達到43.03%、27.28%及17.99%。在對照體系中,菌體生長未受到脅迫,浸出效果較好,出發菌株浸出率達到37.63%,馴化菌株浸出率達到43.03%,提升幅度不大。在1 g/L Cu2+脅迫體系中,出發菌株浸出率急劇下降到15.96%;馴化菌株浸出率為27.28%,下降幅度較小。在3 g/L Cu2+脅迫體系中,高銅濃度下菌體生長受到抑制,出發菌株銅耐受力弱,因此浸出率極低。而馴化菌株對銅耐受力增強,在3 g/L Cu2+脅迫體系中仍可保留較強生物活性,菌體作用于礦物從中獲取能源物質同時促進礦物溶解,浸出率仍可達到17.99%。隨脅迫作用增強,馴化菌株浸出率較出發菌株提升更加明顯,說明了馴化菌株在惡劣環境中浸出優勢更強。

圖7 不同浸出體系銅浸出率
3 討論
微量銅可作為體內各種酶的輔助因子,對于生物體必不可少,但過量的銅離子會使得細胞中產生大量活性氧自由基與細胞內大分子相互作用,導致細胞損傷從而影響細胞活力[6,13]。銅離子對于浸出菌株影響較大,浸出菌株的銅抗性性能尤為重要[14]。對A. caldus進行6個多月的適應性銅耐受定向馴化,獲得馴化菌株A. caldusCCTCC M 2018727。在0、1及3 g/L Cu2+純培養體系中比較出發與馴化菌株生長差異,隨脅迫濃度提高兩菌株生物量均下降,出發菌株下降急劇而馴化菌株下降幅度較小體現了更穩定的生長性能。馴化菌株μmax提高且出現時間提前,暗示延滯期縮短,展示了良好的銅耐受性能因此被選用于后續的生物浸出實驗。
貧黃銅礦生物浸出體系中涉及的主要反應如下所示:

反應(1)與(2)表明,體系中的H+與Fe3+可攻擊礦石促使礦石溶解釋放出銅離子,同時將單質硫釋放出來。A. caldus利用礦物中的單質硫獲取能量進行生長,同時產生的H+可氧化攻擊銅礦使Cu2+釋放出來[5,15-16]。浸出初期菌體濃度低,菌體對礦物中硫化物利用不充分且產酸較少,同時礦物中的較多堿性成分在浸出初期釋放出來,因此pH水平急劇上升。高脅迫體系中出發菌株代謝活性低,離子作用不活躍,馴化菌株pH上升水平相對較高。在浸出中后期,各體系pH均下降到2.0左右,此時菌體與離子、礦物之間的作用趨于平衡,礦物中的硫化物漸漸大量釋放出來,被菌體利用并產生H+導致pH維持在低水平。
反應(4)與(5)表明菌體利用硫化物獲取自身代謝能量并生成H+及硫酸根離子,根據硫酸根濃度的變化可以推測菌體對硫化物的利用效率[17]。在同一脅迫條件下,馴化菌株體系中硫酸根生成濃度均高于出發菌株。在0、1及3 g/L Cu2+浸出體系中,馴化菌株浸出過程中硫酸根生成量比出發菌株分別提高22.02%、37.73%及52.25%。隨脅迫增強菌體硫氧化水平變弱,馴化菌株具備更強環境適應力,能更好地利用硫化物促進礦物溶解。
浸出體系中游離菌體與吸附菌體共同發揮作用,吸附菌體在礦物表面進行硫代謝通過質子作用加速礦物溶解,促進礦物中硫化物釋放到環境中,為游離菌體提供能源物質,幫助介導體系中直接浸出機制,游離菌體利用硫化物更好的維持酸浸環境。吸附菌體濃度在浸出前期很低,是由于初期暴露在礦渣表面單質硫顆粒較少,隨著浸出進行貧黃銅礦不斷溶出,吸附菌體越來越多。在各體系中,馴化菌株最終游離菌體濃度分別提高18.56%、23.91%及100.01%。在3 g/L Cu2+體系中馴化菌株最高吸附菌體濃度比出發菌株提高94.66%。馴化菌株在脅迫體系適應性增強,同時與礦物作用更活躍,生物量水平相應提高。
SEM觀察礦渣表面形貌,在對照體系中菌株生長未受到脅迫對礦物作用活躍,礦渣表面出現較多細微溝壑,同時大量硫顆粒及衍生物暴露,暗示較強的生物吸附作用[18]。在1 g/L Cu2+脅迫體系中,礦物表面腐蝕痕跡相對減少,生成黃鉀鐵礬較多,該物質在礦物表面會形成鈍化膜不利于菌體吸附作用[19]。相比之下,馴化菌株作用痕跡比出發菌株更加明顯。在3 g/L Cu2+脅迫體系中,出發菌株體系中礦物表面較為光滑,說明受到菌體作用少,難以引發有效的“接觸”浸出機制[19],馴化菌株作用痕跡強于出發菌株,但礦物表面也有較多黃鉀鐵礬生成。
研究表明,浸出過程中細胞分泌胞外聚合物(Extracellular polymeric substances,EPS)包裹在礦物表面,促進礦物與菌體間的結合,EPS中主要含有多糖、脂類、蛋白質等[20]。礦渣表面N-H吸收峰的出現與礦物表面附著的EPS相關,暗示菌體在礦物表面聚集吸附,同時分泌EPS幫助更好地吸收環境中營養物質。A. caldus可利用礦物中還原態硫進行代謝獲取能量,S=O、SO42-吸收峰的出現與礦物表面硫代謝相關[17-18]。馴化菌株浸出體系中礦物表面更多菌體附著且作用活躍,各吸收峰變得尖銳,隨脅迫作用增強吸收峰強度變弱。在3 g/L Cu2+脅迫下,出發菌株體系中S=O吸收峰消失,暗示菌株硫氧化性能受到抑制,不能形成活躍的生化反應。
硫桿菌利用貧黃銅礦中硫化物進行自身代謝,浸出體系中質子相互作用會在礦渣表面形成多種衍生物,利用XRD技術分析礦渣成分差異性。礦物成分主要為硫、鐵、銅化合物,其中FeS2、CuFeS2分別是黃鐵礦及黃銅礦的主要成分,隨脅迫濃度增強吸收峰增多。各浸出體系礦渣成分中均有黃鉀鐵礬成分,該物質會在礦物表面形成鈍化膜難以除去,不利于菌體吸附作用于礦物從而影響浸出效率[19]。銅脅迫下菌體代謝活性降低,還原性硫化物利用率低從而難以在礦物表面進行有效的離子循環。馴化菌株在浸出體系中適應性增強、硫代謝更加活躍,有效促進了離子循環使得礦物中有更多衍生物生成,但隨脅迫濃度提高有(NH4)3Fe(SO4)3生成,該物質也會在礦物表面造成鈍化效果不利于浸出。在各體系中一些中間產物如Fe3O4、FeS、Cu8S5、CuO和Cu2O的形成,暗示菌體在礦物表面進行復雜的鐵硫代謝促進銅浸出。
在對照體系中,馴化菌株浸出率提升幅度不大。在1 g/L Cu2+脅迫體系中,馴化菌株浸出率比出發菌株提高70.93%,出發菌株受到脅迫影響浸出率下降明顯。在3 g/L Cu2+脅迫體系中,出發菌株生長受到嚴重抑制,嚴重影響到浸出效果因此浸出率極低,馴化菌株在該條件下浸出率提高306.09%,體現出較強浸出優勢。
綜上,通過適應性銅抗性定向馴化使得A.caldus銅抗性增強,在高銅脅迫環境中體現出更強適應力,浸出優勢顯著,有望為類似的工業浸出研究提供參考。在后續研究中,可對菌株銅耐受機制進行分析,幫助提高菌株銅抗性從而提高浸出效率。
4 結論
經6個月Cu2+適應性馴化,獲得了具有較強抵御銅脅迫抗性的A. caldusCCTCC M 2018727。從μmax、浸出礦渣形貌差異、關鍵官能團變化及礦渣組成成分等方面系統揭示其提升浸出效能的機制。相對于出發菌株在3 g/L Cu2+下μmax僅為0.21 d-1,馴化菌株可維持在0.54 d-1水平,μmax出現時間由10 d提前至13 d。SEM觀察浸出結束后礦渣表面形貌,馴化菌株體系中更多單質硫暴露在礦物表面,腐蝕痕跡更明顯,表面菌體對礦物表面更強的作用。FTIR分析表明馴化菌株體系中N-H、S=O及SO42-吸收峰更加尖銳,說明礦物表面存在更多A. caldus附著細胞發揮其“直接接觸”浸出機制,利用礦物表面的顆粒硫。XRD結果顯示伴隨脅迫增強時更多黃鉀鐵礬生成,附著在礦石表面,阻礙浸出,而馴化菌株體系中黃鉀鐵礬量明顯較少。馴化后A. caldus在0、1及3 g/L Cu2+脅迫水平下的浸出率分別為43.03%、27.28%及17.99%,比出發菌株分別提高了14.35%、70.93%及306.09%,體現了顯著的銅耐受能力和浸出效能優勢。

