Ensifer meliloti 1021煙酰胺酶的酶學特性及3-氰基吡啶調控機理的研究
郭靜靜 郭磊磊 趙云岫 戴亦軍
(1. 南京師范大學中北學院,南京 210023;2. 南京師范大學生命科學學院 江蘇省微生物與功能基因組學重點實驗室 江蘇省微生物資源產業化工程技術研究中心,南京 210023)
微生物催化的腈類轉化有兩條途徑:一條是在腈水解酶(Nitrilase,EC3.5.5.1)的催化下由腈類直接產生羧酸,例如Vaughan等[1]報道的Nocardia rhodochrousLL100-21可直接將3-氰基吡啶(3-CP)代謝為煙酸,但是在這一過程中腈水解酶的活性需要誘導。另一條代謝途徑是由腈水合酶(NHase,EC4.2.1.84)和酰胺酶(Amidase,EC3.5.1.4)聯合作用,將腈類先轉化為酰胺,然后再由酰胺酶催化產生羧酸。目前,已報道的微生物中含腈水合酶和酰胺酶的菌株很多,例如Rhodococcus rhodococcusJ1、Bacillussp. BR449、Brevibacterium imperialis、R.eythropolis等[2-4],但在固氮菌中同時具有腈水合酶和酰胺酶的卻很少見[5]。
腈水合酶和酰胺酶在生物體內是普遍存在的一類酶類,屬于腈水解酶超家族中的一員[6],其中酰胺酶在化學品、生理藥物、農藥等的合成及污染廢水的處理等方面均有廣泛的應用。根據催化活性和底物特異性的不同,酰胺酶可分為很多類,有脂肪族酰胺酶、芳香族酰胺酶、α-氨基酸酰胺酶等,煙酰胺酶(NAMase)屬于芳香族酰胺酶。酰胺酶的催化反應一般分為2類:水解反應和酰基轉移反應,煙酰胺轉化成煙酸就是典型的水解反應,產物煙酸對維持微生物細胞中煙酰胺腺嘌呤二核苷酸(NAD)和煙酰胺腺嘌呤二核苷酸磷酸(NADP)內環境穩態發揮著重要作用[7]。在原核生物體內,煙酰胺在NAMase的催化下產生的煙酸可直接進入NAD的生理代謝途徑[8],由于哺乳動物體內缺乏NAMase,使NAD的生物合成途徑較原核生物復雜[9-10]。NAMase除了能夠調控NAD的生物合成之外,對于延長酵母,黑腹果蠅的壽命也具有一定的作用[11-13]。
草木樨劍菌Ensifer meliloti1021是一類固氮菌,且全基因組序列已公布,基于E. meliloti1021靜息細胞的轉化,探索了3-CP的代謝途徑并對這一途徑中酰胺酶進行了詳細研究,測定了NAMase相應的酶學參數,同時NAMase轉化吡嗪酰胺的功能為結核病的治療提供了新的菌株選擇。3-CP對煙酸產量的抑制為進一步研究微生物細胞內酶的調控提供了參考價值。
1 材料與方法
1.1 材料
E. meliloti1021,表達質粒pET-28a(+)和菌株E.coliRosetta(DE3)由本實驗室保存。DNA提取試劑盒、RNA提取試劑盒、反轉錄試劑盒(上海生工),Ni-NTA Fast Start Kit試劑盒(Sigma公司)。3-CP、煙酰胺、煙酸、苯乙酰胺、吡嗪酰胺、吡嗪酸、丙烯酰胺和乙酰胺(Sigma公司,試劑純度在98%以上);色譜級乙腈(美國Tedia公司);其他試劑為進口或國產分析純。
1.2 方法
1.2.1E. meliloti1021靜息轉化3-CP和煙酰胺 挑取-80℃低溫冰箱中保藏的E. meliloti1021,在LB固體平板上劃線,30℃倒置培養至長出單菌落。挑取單菌落接種到含3 mL液體LB培養基(含0.1 mmol/L CoCl2)的試管中,30℃,200 r/min培養24 h。按1%的接種量接種到含有200 mL LB培養基(含CoCl2)的三角瓶中,30℃,200 r/min培養18 h。將培養好的菌液(以OD600=5.0為標準)收集到50 mL離心管中,4℃,8 000 r/min離心5 min,棄去上清,用PBS清洗菌體二次,分別加入5 mL 200 mg/L和1 g/L的3-CP及煙酰胺底物,渦旋振蕩混勻,取1 mL做為初始樣,每種底物濃度做3個平行,設置底物對照(底物+轉化液)和菌體對照(菌體+轉化液),分別在1 h、3 h、5 h、7 h取樣,每次取樣前需補足轉化過程中蒸發掉的水分。取出的樣13 200 r/min離心10 min,上清液用乙腈(終止反應)稀釋。樣品用0.22 μm的濾膜過濾后進行HPLC分析。流動相為乙腈溶液(V(乙腈)∶V(水)=30∶70),流速為1 mL/min,紫外線檢測波長為230 nm。
1.2.2nam克隆及其蛋白的表達與純化 從NCBI數據庫中搜索“E. meliloti1021 nicotinamidase”蛋白,下載編碼NAMase的基因序列,利用Primer Premier 5軟件設計引物并由上海生工生物有限公司合成,上游引物5'-ACAGCAAATGGGTCGCGGATCCGAATT CATGGCCGATGCGGCTCGGC-3',下游引物5'-ATCTC AGTGGTGGTGGTGGTGGTGCTCGAGCTAGATCAGCC GAACGCCG-3'(下劃線處堿基為酶切位點序列,酶切位點前序列為pET-28a載體同源序列),PCR擴增程序 95℃ 5 min,95℃ 5 s,60℃ 40 s,72℃ 1 min,30個循環。克隆的目的基因片段用EcoRI、XhoI雙酶切后,用Clone ExpressⅡ重組克隆試劑盒將目的片段導入pET-28a質粒。根據本實驗報道的方法化學轉化至E. coliRosetta(DE3)感受態中[14]。菌落PCR驗證陽性克隆,然后送南京思普金生物有限公司測序。
挑取測序正確的陽性克隆接種到3 mL含Kan和Chl的LB液體培養基中,37℃,200 r/min培養24 h。按2%的接種量接種到含Kan和Chl抗性的100 mL LB 培養基中,37℃,200 r/min,培養至 OD600= 0.6-0.7,加入終濃度為0.2 mmol/L的IPTG溶液,30℃誘導6 h。4℃,8 000 r/min離心5 min,收集菌體,用PBS洗去殘留的培養基。Ni-NTA Fast Start Kit試劑盒純化蛋白,對純化過程中收集到的流出液進行SDSPAGE分析。純化的蛋白用Bradford試劑測定其濃度。
1.2.3 酶學活性分析E. meliloti1021 NAMase活力通過HPLC分析,以煙酰胺為底物測定生成的煙酸的含量。定義在37℃條件下,1 min內轉化1 μmol底物所需的酶量為1個NAMase活力單位,用U表示。
1.2.3.1 pH對NAMase活性的影響 配制pH分別為4、5、6、7、8、9、10的200 mg/L煙酰胺轉化液,然后測定在不同pH轉化液中NAMase的活性,定義pH=7時的相對酶活為100%。反應體系998 μL轉化液加入2 μL純化的NAMase,于37℃恒溫孵育器上800 r/min孵育5 min,加入10%的三氯乙酸終止反應。
1.2.3.2 NAMase的pH穩定性 在PCR管中加入8 μL 純化的 NAMase和 92 μL pH 分別為 4、5、6、7、8、9、10緩沖液,于4℃放置12 h,定義pH=7條件下放置的酶的相對酶活為100%。反應體系975 μL轉化液,加入25 μL不同pH條件下處理的酶液。
1.2.3.3 反應溫度對NAMase活性的影響 轉化液底物為pH=7的200 mg/L 煙酰胺,反應體系998 μL轉化液加入2 μL純化的NAMase,分別在20,30,40,50,60,70℃反應5 min,定義30℃反應時的相對酶活為100%。
1.2.3.4 NAMase的熱穩定性 在PCR管中加入30 μL純化的NAMase,分別置于20,30,40,50,60,70,80℃的水浴鍋中孵育3 h,定義30℃條件下孵育的相對酶活為100%。998 μL的反應液加入上述不同溫度條件下孵育的酶液2 μL進行反應。
1.2.3.5 金屬離子對NAMase活性的影響 反應體系為988 μL的轉化液加入2 μL NAMase,再分別加入不同金屬離子溶液,至金屬離子溶液的終濃度為2 mmol/L,37℃恒溫孵育器上800 r/min反應5 min,以不加金屬離子的相對酶活為100%。
1.2.3.6 有機溶劑對NAMase活性的影響 反應體系為978 μL的轉化液加入2 μL NAMase,再分別加入不同有機溶液,至有機溶液的終濃度為2%(質量體積比),37℃恒溫孵育器上800 r/min反應5 min,定義不加有機溶劑的相對酶活為100%。
1.2.3.7 底物特異性及催化動力學分析 分別配制不同的酰胺類底物包括煙酰胺、吡嗪酰胺、苯甲酰胺、丙烯酰胺、苯乙酰胺和甲酰胺,PBS溶解,濃度為200 mg/L。反應體系為998 μL不同的酰胺底物加入2 μL NAMase,37℃恒溫孵育器上800 r/min反應5 min。在煙酰胺濃度為0.2-4 g/L下測定NAMase動力學,Vmax及Km根據米氏方程推斷。
1.2.4 野生菌株及過表達菌株的生物轉化E.meliloti1021野生菌株在含1 g/L 3-CP LB液體培養基中擴大培養,以OD600=5收集菌體;構建的含NAMase的E.coli在加入誘導劑的同時,加入終濃度為1 g/L 3-CP,誘導6 h后以OD600=3.5收集菌體;分別以1 g/L 煙酰胺為底物。以誘導時不加3-CP的菌體為對照組。實驗組和對照組各作3個平行。另外,做一組純化的NAMase轉化1 g/L煙酰胺,同時在轉化液中加入終濃度1 g/L 3-CP。
1.2.5 3-CP對NAMase的調控機制研究 將E.meliloti1021單菌落接種到20 mL液體LB培養基中,30℃,200 r/min培養24 h,按1%的接種量分別轉接到含終濃度為1 g/L 3-CP的LB(實驗組)和普通LB(對照組)中,培養18 h。收集菌液,提取總RNA,反轉錄為cDNA,以16S rRNA基因做內參基因,反應程序為兩步法擴增,第一步:預變性,循環數為1,95℃ 30 s。第二步:PCR反應,循環數40,95℃ 5 s,60℃ 30 s。溶解階段:循環數 1,95℃ 15 s,60℃ 1 min,95℃ 15 s。
1.2.6 NAMase固定化研究 稱取海藻酸鈉0.2 g于50 mL燒杯中,加入20 mL無菌水,用微波爐緩慢加熱溶解,靜止冷卻。將清洗好的E.coliRosetta過表達菌株與海藻酸鈉溶液按照1∶2的體積混勻,用注射器制備顆粒于提前配制的2% CaCl2溶液中固定1 h。用放有尼龍膜的漏斗過濾除去CaCl2溶液,無菌水清洗顆粒兩次,制備的包埋菌體可放于4℃冰箱儲存。純化后的NAMase按上述條件進行固定化。
2 結果
2.1 E. meliloti 1021靜息轉化3-CP和煙酰胺
圖1-A1顯示以200 mg/L 3-CP為底物時終產物是煙酸,在3 h時煙酸的產量為0.29 mmol/L,轉化率為94.2%;以1 g/L 3-CP為底物時只能產生煙酰胺,到12 h時還無煙酸保留峰的出現(圖1-A2)。E.meliloti1021靜息細胞分別以200 mg/L和1 g/L煙酰胺為底物時,均出現了煙酸的保留峰,其中以200 mg/L煙酰胺為底物時3 h煙酸的產量為0.47 mmol/L,轉化率為47.5%(圖1-B1);以1 g/L煙酰胺為底物時3 h煙酸的產量為0.36 mmol/L,轉化率為14%,高濃度的煙酰胺也會對酰胺酶產生一定的抑制作用。
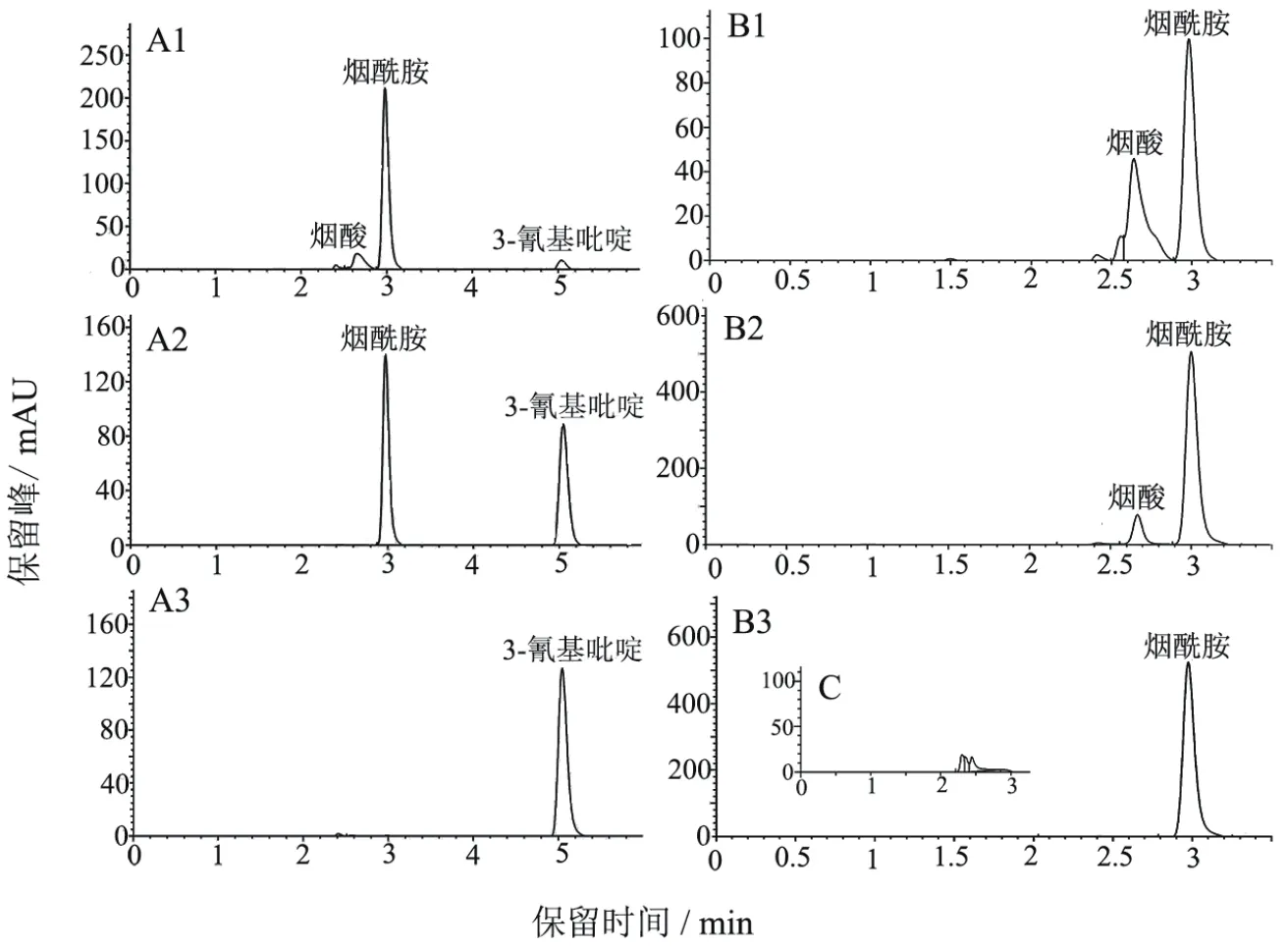
圖1 E. meliloti 1021靜息轉化3-CP和煙酰胺
2.2 nam克隆及其蛋白的表達與純化
以E. meliloti1021基因組DNA為模板,根據設計的引物擴增獲得nam序列,瓊脂糖凝膠電泳顯示目的片段長約636 bp(圖2),導入EcoRI、XhoI雙酶切的pET-28a載體,然后轉入E.coliRosetta(DE3)感受態細胞,陽性克隆片段大小符合預期。

圖2 PCR擴增nam基因的電泳結果

圖3 NAMase的SDS-PAGE圖
由nam編 碼 的NAMase在30℃,0.2 mmol/L IPTG的條件下,在E.coliRosetta-pET28a中表達情況良好,從圖3中可以看出E.coliRosetta- pET28a空載中沒有目的條帶,說明pET-28a在E.coliRosetta沒有目的蛋白表達。SDS-PAGE顯示NAMase蛋白分子量約22.6 kD,Bradford法測定蛋白濃度為1.13 mg/mL。
2.3 NAMase酶學特性
pH和溫度對NAMase的影響:圖4-A顯示在pH7-8時,酶的穩定性最好;該酶的最適pH是7,在pH小于6和大于8的條件下,酶的活性會迅速下降(圖4-B)。在30-70℃之間NAMase對底物煙酰胺的活性最高,該酶在30-50℃之間孵育2 h后的轉化活性仍在97.1%以上(圖4-D)。
金屬離子和有機溶劑對NAMase的影響:從圖4-E可知Fe對NAMase活性有抑制,其中Fe3+抑制率為5.2%,作用不明顯,Fe2+抑制率為13.1%;Ag2+對NAMase抑制作用更明顯,高達72.2%,而Mg2+(98.3%)、Zn2+(97.5%)和 Co2+(102.2%)對該酶活性影響不大。圖4-F顯示異戊醇對NAMase活性的抑制率最大,達到98.4%,三氯甲烷抑制作用為38.1%,丙酮(119.5%)、二氯甲烷(125.1%)及乙酸乙酯(120.5%)對NAMase的活性有促進作用。

圖4 NAMase酶學性質分析
底物特異性及動力學參數:E. meliloti1021 NAMase能將煙酰胺和吡嗪酰胺分別轉化為煙酸和吡嗪酸,對上文提到的其他幾種酰胺底物均無代謝活性(表1)。對純化后的NAMase測定相關的動力學參數,Kcat / Km為0.42 mmol/L/s,Km為2.28 mmol/L,Vmax為 142.86 U/mg。

表1 NAMase底物特異性
2.4 野生菌株及過表達菌株的轉化
E. meliloti1021在加入3-CP的LB中培養時,靜息轉化產生的煙酸0.15 mg/L(圖5-A1),用普通LB中培養的E. meliloti1021靜息轉化,煙酸產量為0.45 mg/L(圖5-A2),3-CP對NAMase活性抑制率達到了66.7%。圖5-B1顯示E.coliRosetta-NAMase過表達菌株誘導時加入3-CP,收集菌體進行轉化,其煙酸的產量為0.14 mg/L,而誘導時不加3-CP,E.coliRosetta-NAMase過表達菌株轉化1 g/L煙酰胺產生1.35 mg/L煙酸(圖5-B2),3-CP對E.coliRosetta中過表達的NAMase活性抑制率達到了89.6%。純化的NAMase在轉化煙酰胺的過程中,3-CP不影響煙酸的產量。從圖6 SDS-PAGE的泳道2和6可知誘導時3-CP對NAMase可溶性蛋白表達影響不大。

圖5 不同條件轉化1g/L煙酰胺
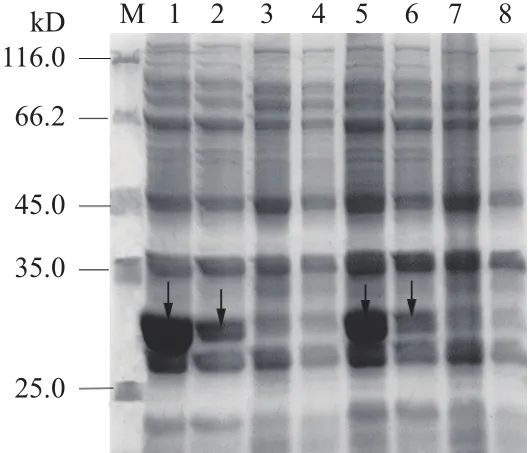
圖6 不同條件下的 NAMase的SDS-PAGE分析
2.5 3-CP對NAMase轉錄水平的調控
提取的實驗組菌體中的RNA濃度為81.3 ng/μL,OD260/ OD280=2.04;對照組菌體中的RNA濃度為103.2 ng/μL,OD260/OD280=2.07;從轉錄水平分析 3-CP對NAMase表達量的影響結果如下:把細菌培養時未加3-CP對照組NAMase的表達量定義為1,培養時加入3-CP的實驗組NAMase表達量為1.18。
2.6 NAMase固定化對酶活的影響
用最適包埋條件(2%海藻酸鈉和2% CaCl2)對過表達菌株及純化后的蛋白分別進行包埋,結果發現包埋的純化后的酶活只有純酶酶活的1/3,但是固定化的在E.coliRosetta中過表達的NAMase(轉化率為94%)與自由細胞(轉化率為95.1%)相比活性并未下降。
3 討論
E. meliloti1021靜息細胞轉化200 mg/L 3-CP終產物是羧酸,以煙酰胺為底物時也能產生煙酸。在這一代謝過程中可能存在腈水解酶或腈水合酶和酰胺酶,進一步查找E.meliloti1021的全基因組(NC_003047.1)發現沒有編碼腈水解酶的基因。E.meliloti1021催化1 g/L 3-CP產生煙酰胺,沒有煙酸產生,在這一過程推測3-CP會抑制NAMase的活性,不同濃度的煙酰胺底物其轉化率不同,煙酰胺對煙酸的產生也具有抑制作用。有研究稱3-CP作為底物時在轉化的過程中會出現底物抑制現象,酰胺水解酶也會被大量的煙酰胺類似物抑制,其中3-CP的抑制常數為2.2 μmol/L[15]。野生菌株和過表達菌株在培養及誘導時加3-CP的對比結果顯示3-CP會抑制煙酸的產量,在轉錄水平及純化的NAMase在轉化煙酰胺時不受3-CP的干擾,推測3-CP在轉化的過程中并非是底物抑制效應。
克隆并異源表達了E. meliloti1021 NAMase的基因,誘導后分離純化NAMase 研究其酶學性質,實驗發現在pH=7時活性最高。該酶在30-70℃之間酶活均維持在很高的活性,與Oceanobacillus iheyensisHTE831 酰胺酶(55℃以上,酶活大幅度下降)及一些最適溫度在30-40℃的酰胺酶相比在高溫下更具有優勢[16-18]。NAMase是一類金屬離子依賴性的酶,大部分這類酶的活性中心含有Zn2+[7,10],有研究表明Fe2+可增加NAMase的活性[19],本實驗Fe2+會輕微抑制E. meliloti1021 NAMase的活性,抑制率為13%。底物特異性與Mycobacterium tuberculosis中NAMase相似[20],這與酶本身的活性位點殘基有關[16]。目前報道的吡嗪酰胺酶大都來自于M.tuberculosis[22-24],E. meliloti1021 NAMase 轉化吡嗪酰胺的活性比Zhang等[20]研究中吡嗪酰胺酶的活性(81.9 U/mg)高1.8倍,為結核病治療提供了新的目標菌株選擇。固定化的E.coli過表達菌株對煙酰胺具有很高的活性,實現了酶反復利用的可能。
4 結論
從E. meliloti1021中克隆了長636 bp的NAMase基因,編碼的蛋白分子量為22.6 kD,PI為5.5。利用親和層析柱純化異源表達的NAMase然后測定酶活,該酶的最適pH為7,30-70℃之間NAMase對底物煙酰胺的活性最高,在30-50℃之間孵育2 h后NAMase活性仍保持在97.1%以上,Ag2+和異戊醇會抑制NAMase的活性。NAMase不僅能轉化煙酰胺,對吡嗪酰胺也具有很高的活性。高濃度3-CP和煙酰胺對E. meliloti1021野生菌株代謝酰胺有抑制作用,固定化的E.coliNAMase過表達菌株對煙酰胺轉化率達到94%。

