核磁共振、增強CT及超聲造影對肝癌介入治療療效評估的對比研究
樊建朝 趙香田
南陽醫專第二附屬醫院放射科 (河南 南陽, 473000)
肝細胞癌(HCC)是臨床常見惡性腫瘤,我國HCC發病率高,其高危因素包括化學致癌物質、黃曲霉毒素、病毒性肝炎、肝硬化等,我國以乙型肝炎引發的HCC占多數[1]。HCC臨床常用治療手段包括放射治療、化療、手術治療,其中手術治療效果最佳,但對時機、年齡、腫瘤位置等均有明確要求。非手術治療方法中放射介入治療(放射性粒子植入、經肝動脈灌注栓塞術)應用最多,尤其是經肝動脈灌注栓塞術取得的臨床效果相對較好,已經成為近年來無法手術的HCC患者常用治療方式,但介入治療為姑息性治療,難以徹底清除病灶,通常需要多次重復治療,并且多次評估療效。目前用于介入治療療效評估的手段包括灰階超聲、血管造影、磁共振成像(MRI)、增強CT掃描、超聲造影(CEUS)等[2]。近年來CEUS因為操作簡單、無輻射、經濟實惠等特點在肝癌介入治療效果評價中受到重視。但目前關于其與MRI、增強CT的對比研究較少,筆者回顧性分析2016年2月-2018年2月期間96例HCC患者作為研究對象,以DSA為金標準,對比分析MRI、增強CT、CEUS在HCC介入治療1個月的療效評估中的應用意義,現報道如下。
1 資料與方法
1.1 一般資料 將2016年2月-2018年2月南陽醫專第二附屬醫院接受介入栓塞治療的HCC患者96例納入研究。入選患者納入及排除標準見參考文獻[3,4]。96例患者中,男52例,女44例;年齡39~70歲,平均(55.62±9.12)歲;肝癌A級54例,B級42例。
1.2 檢查方法
1.2.1 CEUS方法 ①造影劑:注射用六氟化硫微泡(意大利Bracco公司提供SonoVue),將25 mg SonoVue凍干粉加入到5ml生理鹽水中,振搖形成微泡混懸液;每毫升微泡懸浮液中含有8 ul六氟化硫。將2.4 ml微泡混懸液注入肘前淺靜脈,再用5 ml生理鹽水沖注。②儀器:型號SSD-500為的彩色多普勒超聲儀(日本ALOKA公司),探頭型號UST9126,頻率2.0~5.0 MHZ,使用純諧波造影成像技術,機械指數(MI)<0.09。③造影:行肝臟常規超聲掃查,記錄病灶信息(大小、位置、形態、數目、血流、回聲),完成初步診斷。選擇觀察目標并置于顯示屏正中,打開諧波造影監控功能,MI<0.09,信號增益調到無噪聲,屏幕上僅見大血管結構及某些解剖標識。單一聚焦焦點調至病灶深部以下,盡可能弱化超聲波對微氣泡的破壞。注射六氟化硫微泡,啟動內置計時裝置,觀察灌注、回聲情況;小幅度移動探頭完成病灶扇形掃查,完整記錄各個時相記信息,最后快速掃查整個肝臟觀察有無新病灶。在動脈期(0~30 s)、門脈期(31~120 s)和延遲期(120~360 s)掃描,在延遲期行全肝掃描。
1.2.2 增強CT掃描 儀器為256層飛利浦Brilliance iCT,使用碘海醇做造影劑,層厚1~2 mm,重建5 mm,增強掃描0.27 s/r,平掃后經肘靜脈注射90~120 ml造影劑(30 ml/s),在動脈期(40 s)、門脈期(70 s)、平衡期(120 s)時掃描。
1.2.3 MRI檢查 Signa EXCITEⅢ1.5T HD磁共振成像系統(美國GE公司)及配套造影劑(莫迪司),八通道體部線圈;掃描方式包括常規掃描、彌散掃描、肝臟快速溶劑成像和增強掃描,增強掃描時以2 ml/s速度完成0.2 ml/kg肘靜脈造影劑注射,在動脈期(30 s)、門脈期(70 s)和延遲期(6 min)、1 h時掃描。
1.2.4 介入治療效果評價 CEUS評價[5]:①治療后無論是彩色多普勒超聲還是CEUS均未出現明顯變化,可判定為完全失活;或常規超聲發現腫瘤完全回聲,彩色多普勒下未見血流信號,且CEUS下治療區完全無灌注,可判定為完全失活。②常規超聲提示腫瘤呈完全或部分回聲增強,彩色多普勒可見星點樣血流信號,且無完整的樹枝樣血流信號,CEUS下治療區有灌注,可判斷為部分失活。增強CT評價[6]:①治療后增強CT下無變化,無強化,為完全滅活。②增強CT發現原病灶部分造影劑快進快出,部分異常,判定為部分失活。MRI評價[7]:①治療前后無變化,病區無強化,為完全失活。②治療后原病灶周圍組織部分強化,為部分失活。②治療后病灶無任何強化為完全失活。以上完全滅活為陰性,即無殘留病灶;部分滅活為陽性,即有殘留病灶。
1.3 觀察指標 觀察治療前CEUS檢查結果,包括病灶個數、造影劑進出特點、病灶增強情況等;隨訪至治療后1個月,均行CEUS、MRI、增強CT檢查,對比3種檢查結果(陽性病灶、陰性病灶、未定性病灶的個數及表現);以DSA為金標準,計算3種檢查方法檢測HCC介入治療后參與病灶靈敏度。
1.4 統計學方法 使用SPSS 18.0 統計學軟件分析數據,計數資料以%表示,組間比較采用x2檢驗;用Kappa檢驗兩種檢查方法的一致性,以P<0.05表示差異有統計學意義。
2 結果
2.1 治療前CEUS檢查結果 共檢出病灶124個,造影劑快進快出,門脈期造影劑快速廓清,動脈有球狀包裹,主要表現為輕度的彌漫性增強;其中98個病灶呈動脈期均勻增強,其余病灶動脈期不均勻增強。
2.2 治療1個月后3種檢查方法在參與病灶上的判斷結果對比 CEUS檢查:124個病灶中77個病灶為陽性(殘余病灶),42個為陰性(完全滅活),其余5例未定性(未確定陰性或陽性)。在陽性病灶中表現為等增強或高增強強化,包括結節型增強和周圍環形增強,45個病灶出現延遲相和門脈相回聲地增強信號,動脈相高增強信號;22個病灶表現為延遲相、門脈相回聲低增強信號,動脈相等增強信號;10個病灶表現為延遲相、門脈相等增強信號,動脈相高增強信號。在陰性病灶無造影劑填充。未定性病灶圖像模糊難以判斷有無殘留腫瘤組織。增強CT檢查:增強CT掃描下124個病灶中63個為陽性,46個為陰性,其余15個難以定性。所有陽性均表現為動脈期明顯強化,所有陰性均為動脈期無明顯強化,未定性者病灶影像模糊無法判斷。MRI檢查:124個病灶發現67例為陽性,47例為陰性,其余10例未定性。陽性病灶有動脈明顯強化,有殘留腫瘤細胞,陰性病灶無動脈期強化,未定性者圖像模糊無法辨認。DSA檢查確定陽性病灶(殘余灶)共79個。CEUS與CT結果比較見表1,CEUS與MRI結果比較見表2,CEUS與DSA結果比較見表3。
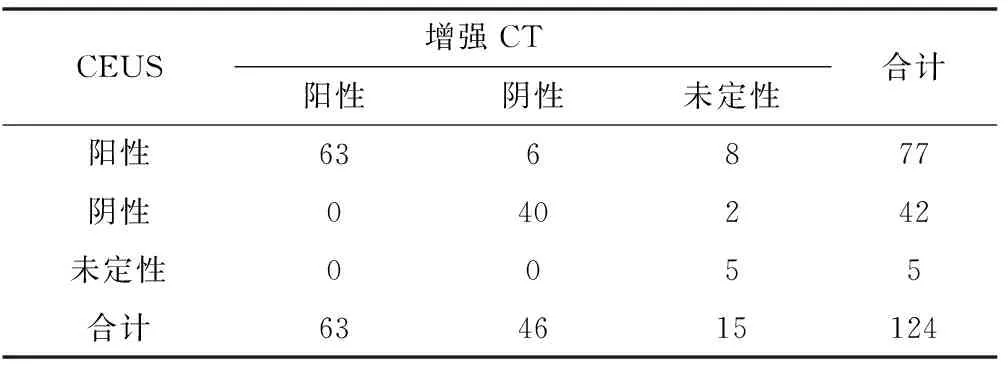
表1 介入治療1個月后CEUS與增強CT結果比較 (n)
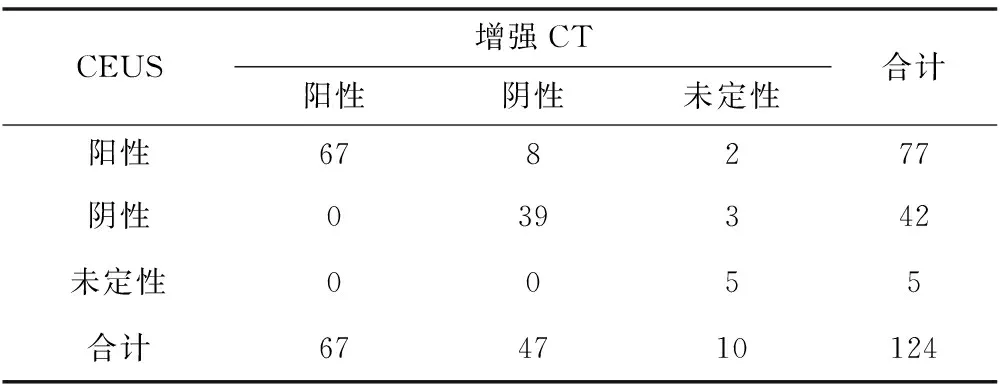
表2 介入治療1個月后CEUS與MRI結果比較 (n)
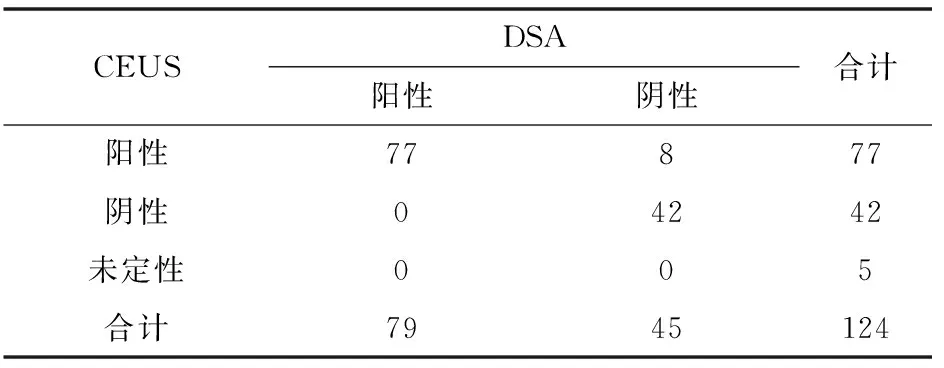
表3 介入治療1個月后CEUS與金標準DSA結果比較 (n)
2.3 以DSA為標準3種檢查方法的靈敏性及一致性分析 MRI、CEUS、增強CT檢測HCC介入治療后殘余病灶靈敏度對比,CEUS、增強CT、MRI靈敏度分別為97.47%、79.75%、84.81%,x2=131.78(P=0.0000)。3種檢查方法與DSA一致性評估結果為:CEUS與DSA一致性好,Kappa≥0.75;增強CT與DSA一致性檢驗,Kappa<0.40;MRI與DSA一致性檢驗發現Kappa<0.42。
3 討論
HCC尚無特效治療方法,早期首選手術治療,但一些即便診斷較早的病例也不宜行手術治療,例如多發灶、肝功能衰竭、年齡過大的患者等。此外肝內病灶小但有轉移發生的肝癌患者會因為原病灶尚未被有效控制,故也不能給予手術治療。因此微創介入治療成為延長HCC患者生存時間,改善生活質量的重要手段。近年來超聲、CT引導的多種介入治療已經成為HCC治療重要手段。經動脈導管化栓塞術介入治療是目前我國中晚期肝癌臨床治療首選方式,但長時間臨床實踐發現治療后難以一次性完全滅活腫瘤細胞,容易有殘留,往往需要多次治療,因此在治療中準確評估是否還存在殘余病灶十分重要[8,9]。目前在該領域應用最多的檢查方法包括CEUS、MRI、增強CT等影像學技術。但哪種影像學技術更具優勢還無定論,而早期研究證實DSA是肝臟病變組織診斷和療效評估金標準,故本研究以DSA為金標準,對比分析了MRI、增強CT和CEUS在HCC介入治療殘余病灶評估中的價值。
HCC為供血豐富的腫瘤,主要由肝動脈供血,健康肝臟75%的供血由門靜脈完成,因此HCC患者在CEUS中表現為動脈期高回聲、門靜脈期低回聲或等回聲、延遲期為低回聲。治療后腫瘤細胞完全滅活的病灶為黑洞征,未見造影劑填充,與周圍組織有明顯區別;在治療不徹底的病灶中表現為動脈期或整體顯著強化,因為肝動脈供血雖然已經被阻斷,但門靜脈供血還在,繼續為病灶提供氧和營養,這類病灶往往表現呈動脈期等回聲、門脈期及延遲期相對低回聲[10]。根據以上特點,使用CEUS評估HCC介入治療后是否完全滅活病灶癌細胞是可行、有效的。本次研究發現CEUS與DSA一致性好,Kappa≥0.75;增強CT與DSA一致性檢驗,Kappa<0.40;MRI與DSA一致性檢驗發現Kappa<0.42。以DSA為標準,MRI、CEUS、增強CT檢測HCC介入治療后殘余病灶靈敏度對比CEUS、增強CT、MRI靈敏度分別為97.47%、79.75%、84.81%(P=0.0000)。提示3種檢查方法中以CEUS表現最好。3種方法相比:病灶中沉積碘油對增強CT掃描有影響,故需要短期反復掃描,多次掃描則對患者造成較大輻射傷害,且增強CT掃描價格貴[11]。MRI檢查容易受呼吸移動、掃描層厚影響,產生較多偽影,導致病灶判斷困難。CEUS技術能直接反應腫瘤血流動力學變化、人體器官病變血流動力學變化[12];研究報道在肝癌治療效果評估中應用判斷優劣主要取決于準確判斷腫瘤組織血供阻斷程度,CEUS技術通過靶器官中對比劑實時了解血流動力學變化,甚至能反應器官功能[13];CEUS使用的對比劑為惰性氣體,無輻射、無毒、不經肝腎排除,因此安全性更高,更適合多次反復檢查,用于介入治療效果評估中具有較大優勢[14,15]。此外,目前關于CEUS評估HCC介入治療的研究均未報道假陽性,本研究也未出現假陽性,提示CEUS用于HCC介入治療殘余病灶判斷上特異性高;因為超聲穿透力及聲衰減等因素影響,CEUS對病灶深度、位置要求高,故目前關于CEUS評估HCC介入治療效果的研究對其敏感性報道不一致[16]。本研究對病灶深度選擇為≤7 cm,因此檢測出的敏感性較高。
綜上所述,3種方法相比,CEUS在HCC介入治療后殘余病灶評估上最具優勢,可最為HCC介入治療期間反復評估療效的方法。

