抗柯薩奇病毒A16型單克隆抗體的制備和應用
劉 楊,趙向絨,余鵬博2,郭春艷,李 研,趙彭花,胡 軍
柯薩奇病毒A 16(Coxsackievirus A16)屬于小核糖核酸病毒科(Picornaradae),無包膜單股正鏈RNA病毒,基因組約7.4 kb,病毒顆粒呈20面體立體對稱球形結構。CA16和EV71是引起手足口病的主要病原體, 5歲以下兒童普遍易感,臨床表現為手、足、口部皰疹和皰疹性咽峽炎等癥狀,少數患者可出現無菌性腦膜炎、腦炎等并發癥,大多研究認為CA16主要引起輕癥感染,但是也有報道CA16患者中可出現嚴重的神經系統損傷[1-2]。因此,CA16早期快速檢測和診斷尤為重要,目前用于CA16檢測技術主要包括病毒分離、血清學檢測和分子生物學檢測。此次研究主要是通過CA16病毒大量培養,利用氯化銫密度梯度離心技術純化病毒顆粒,以純化的病毒抗原作為免疫抗原制備特異性抗CA16單克隆抗體,在單抗基礎上建立CA16膠體金免疫層析快速檢測方法,為臨床快速診斷和流行病學監測提供技術支持。
1 材料與方法
1.1病毒培養 用DMEM/F12 1∶1(含10%胎牛血清,購于Hyclone)培養基培養RD細胞,待長至單層后,PBS洗細胞3次,加入DMEM/F12 1∶1培養基(含1%胎牛血清),接種CA16病毒液(CA16病毒株為本中心實驗室分離株),置于37 ℃、5%CO2細胞培養箱中培養,每日觀察細胞病變情況(CPE),待細胞病變達到75%時收獲病毒培養上清,-70 ℃冰箱保存備用。
1.2病毒顆粒純化 收獲的病毒培養上清反復凍融3次(-70 ℃~37 ℃),3 000 r/min離心20 min,收集上清后用0.45 μm濾膜過濾,收集濾液20 000 r/min 7 ℃離心4 h(HITACHI),PBS重懸并溶解病毒沉淀。依次加入重氯化銫梯度液(密度=1.45 g/mL)、輕氯化銫(密度=1.19 g/mL,含結晶紫染料)、病毒重懸液。20 000 r/min 7 ℃離心4 h。收取藍色病毒分離層,4 ℃條件下用透析袋對純化產物進行透析。純化產物-70 ℃保存備用。
1.3透射電鏡觀察病毒顆粒 取福爾馬林滅活的病毒樣品滴加到銅網上,10 min后取銅網置于2%磷鎢酸溶液中負染10 min,銅網在燈上烤干后進行透射電鏡觀察(HITACHI,H-600)。
1.4單克隆抗體的制備 CA16病毒純化產物用福爾馬林滅活(1/4 000),腹腔免疫BALB/c小鼠(雌性,8周齡,體重18~20 g,購自第四軍醫大學實驗動物中心)。間隔2周加強免疫,融合前3 d,腹腔追加免疫。無菌取免疫小鼠脾臟研磨并與Sp2/0細胞混合,用 50% PEG4000溶液進行細胞融合,將融合細胞加入已鋪有飼養細胞的96孔培養板中,用HAT培養基選擇培養,用間接ELISA方法檢測雜交瘤細胞培養上清液,篩選的陽性孔按有限稀釋法亞克隆,建立mAb細胞株。1640培養基(含10%胎牛血清)培養陽性雜交瘤細胞,雜交瘤細胞一部分凍存作為細胞種子,一部分腹腔內注射BALB/c小鼠(腹腔內注射0.2 mL石蠟油后10 d的小鼠),注射量為 0.2 mL(1.25×104個細胞),10 d左右收集腹水。
1.5單克隆抗體反應特性鑒定 抗體類和亞類的鑒定,按照Southern biotech公司mAb亞型鑒定試劑盒說明書進行。抗體效價的測定,用建立的ELISA方法檢測,對單抗腹水依次做倍比稀釋,進行ELISA試驗,同時用Sp2/0細胞腹水作陰性對照。單克隆抗體的特異性和交叉反應性鑒定,分別將CA16抗原、EV71抗原、柯薩奇病毒B3型(CB3)、ECHO11抗原(本實驗室分離病毒株)、胎牛血清、RD細胞碎片等不同抗原包被ELISA板,分別加入單克隆抗體,檢測與抗原是否有交叉反應性。
1.6免疫熒光試驗 預先在12孔培養板中無菌放入載玻片,以1×105個細胞/孔 滴加RD細胞懸液,待細胞貼壁后接種CA16病毒,設立正常細胞對照孔,待接種CA16病毒的細胞病變效應達到50%時棄去上清,加入4%多聚甲醛室溫固定1 h,PBST洗3次,加入抗CA16單克隆抗體,37 ℃孵育1 h,PBST洗6次,加入FITC標記的山羊抗小鼠IgG二抗(購于Thermo Scientific), 37 ℃避光孵育1 h,PBST洗6次,加入Hoechst 33342(Invirogen)室溫避光染細胞核20 min,PBST洗6次,置熒光顯微鏡下觀察。
1.7細胞免疫化學試驗 預先在12孔培養板中無菌放入載玻片,以1×105個細胞/孔 滴加RD細胞懸液,待細胞貼壁后分別接種CA16、EV71病毒,設立正常細胞對照孔,待接種病毒的細胞病變效應達50%~75%時棄去上清,用10%甲醛室溫固定1 h,PBST洗3次,加入3% 過氧化氫溶液室溫孵育20 min,5% 牛血清白蛋白37 ℃孵育1 h,加入抗CA16單克隆抗體,37 ℃孵育1 h,PBST洗6次,加入HRP標記的山羊抗小鼠IgG二抗(購于Thermo Scientific), 37 ℃孵育1 h,PBST洗6次,DAB顯色5 min,PBST洗6次,加入蘇木素室溫染色10 min,分化、返藍后置顯微鏡下觀察。
1.8細胞ELISA 以1×104個細胞/孔 滴加RD細胞懸液至96孔細胞板中,待細胞貼壁后分別接種0.1、1、10、100和1000 TCID50的CA16,置于37 ℃、5% CO2細胞培養箱中培養24 h,棄去上清,加入甲醇與丙酮等量混合的固定液室溫固定細胞 30 min,加入過氧化氫尿素溶液 室溫靜置20 min,5% 牛血清白蛋白37 ℃孵育1 h,加入抗CA16單克隆抗體,37 ℃孵育1 h,PBST洗6次,加入HRP標記的山羊抗小鼠IgG二抗(購于Thermo Scientific),PBST洗6次,加入TMB顯色液,37 ℃孵育10 min,加入2 mol/L H2SO4終止液,測定酶標板孔吸光度450 nm值(OD450)。
1.9金標抗體液的制備 向膠體金顆粒溶液中加入30%的雙氧水,磁力攪拌10 min,加0.2 mol/L的碳酸鉀,攪拌10 min,加入純化的單克隆抗體0.2 mg,攪拌60 min,加入牛血清白蛋白0.1 g;攪拌10 min,加入聚乙二醇0.01 g;攪拌30 min。8 000 r/min離心10 min濃縮金標抗體。用膠體金稀釋液溶解(膠體金稀釋液組成:牛血清白蛋白1%,蔗糖2.5%;吐溫-20 0.05%;磷酸緩沖液0.01 mol/L,pH7.4;疊氮鈉0.1%)。
1.10膠體金試紙條組裝 用噴金儀在金標墊上均勻鋪上金標抗體,烘干。用點膜儀將純化的單抗以2.5 mg/mL的濃度噴入反應膜上(檢測線),將山羊抗小鼠IgG(購于Thermo Scientific)以1 mg/mL的濃度噴入膜上(對照線),室溫晾干,即制備出反應膜。將樣品墊、金墊、反應膜、吸收墊、背襯等部分組裝成膠體金免疫層析試紙條。
1.11膠體金免疫層析試紙條的特異性和敏感性分析 用組裝的膠體金試紙條分別對CA16培養上清、EV71培養上清和柯薩奇病毒B3進行檢測試驗。用PBS對108.25TCID50/0.1 mL的CA16病毒株進行倍比系列稀釋,分別用膠體金試紙條對每個稀釋度的CA16病毒樣品進行檢測,觀察并收集結果。
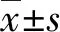
2 結 果
2.1病毒培養和純化 收獲病毒培養產物,經超離濃縮和氯化銫密度梯度超速離心純化后,CA16病毒顆粒處于輕氯化銫梯度液與重氯化銫梯度液之間,同時,結晶紫將病毒顆粒染成藍色,可見藍色病毒層(圖1)。

圖1 氯化銫密度梯度離心純化CA16病毒顆粒Fig.1 Purification of the CA16 virus by cesium chloride density gradient ultracentrifugation
2.2透射電鏡觀察 福爾馬林滅活的CA16病毒顆粒經透射電鏡觀察顯示,病毒顆粒呈二十面體立體對稱球形結構,直徑大約20~30 nm之間,大小均勻,同時,有空心病毒顆粒(圖2)。
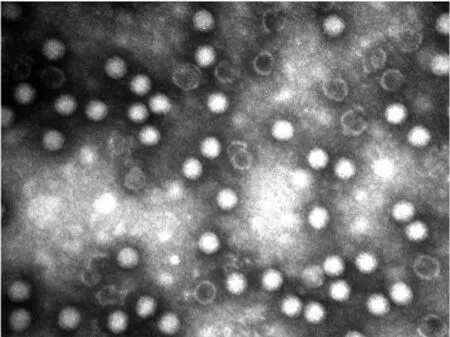
圖2 透射電鏡觀察純化的CA16病毒顆粒(250 000×)Fig.2 Photographs of CA16 viral particles as analyzed by transmission electron microscopy(250 000 ×)
2.3單克隆抗體制備和特性分析 CA16病毒純化產物滅活后免疫Balb/c小鼠,取小鼠脾臟研磨與SP2/0細胞融合,篩選出1株分泌抗CA16單克隆抗體的雜交瘤細胞株,命名mAb CA16-19。免疫熒光試驗顯示(圖3),該株單抗特異性與CA16病毒反應。用間接ELISA法檢測抗體效價10-5。抗體亞型ELISA檢測結果顯示,單抗為IgG2a亞型。單抗交叉反應性結果顯示,單抗與EV71、CB3和ECHO11病毒均不產生交叉反應。

圖3 mAb CA16-19細胞免疫熒光試驗(400×)Fig.3 Immunofluorescent assay of mAb CA16-19(400 ×)
2.4細胞免疫化學染色 細胞免疫化學染色顯示,mAb CA16-19 與CA16感染RD細胞結合,細胞內有棕色著色,mAb CA16-19 不與EV71感染RD細胞組和正常RD細胞組結合,免疫化學染色只有藍色細胞核著色(圖4)。

A:CA16感染RD細胞組;B:EV71感染細胞組;C:正常RD細胞對照組。圖4 mAb CA16-19 細胞免疫化學染色(400×)Fig.4 Cell immunochemical staining of mAb CA16-19(400×)
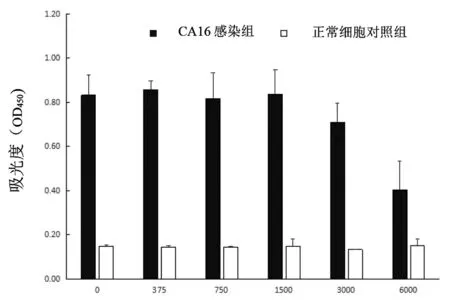
2.5細胞ELISA 細胞ELISA中,推測細胞內源性過氧化物酶影響ELISA特異性檢測,因此,用不同濃度過氧化氫尿素處理細胞板。正常RD細胞組ELISA檢測顯示,不同濃度過氧化氫尿素處理組間吸光度值差異無統計學意義(F=0.581,P>0.05)。CA16感染RD細胞組ELISA檢測顯示,CA16感染RD細胞后,不同濃度過氧化氫尿素處理組間吸光度值差異有統計學意義(F=9.153,P<0.01),6 000 mg/L組與0 mg/L 組間有統計學意義(t=-0.429,P<0.01),其他組與0 mg/L 組間比較均無統計學差異(P>0.05)。細胞ELISA表明,細胞內源性過氧化物酶對細胞ELISA吸光度值影響較小,但當過氧化氫尿素濃度為6 000 mg/L時,可降低吸光度值,而當過氧化氫尿素濃度在0~1 500 mg/L間時,對ELISA吸光度值無影響(圖5)。細胞ELISA中可不用進行內源性過氧化物酶處理。不同病毒滴度的CA16感染RD細胞24 h后,隨著病毒滴度增加,吸光度值也顯著增加。此次細胞ELISA的臨界值或Cut off=2.1×N,當病毒滴度為0(正常細胞對照)時對應的吸光度值為N,Cut off=2.1×N=2.1×0.12=0.252,利用mAb CA16-19建立的細胞ELISA最低檢測線為10 TCID50(圖6)。
過氧化氫尿素濃度(mg/L)圖5 不同濃度過氧化氫尿素溶液控制細胞ELISA細胞內源性過氧化物酶比較Fig.5 Comparison of different concentrations of urea peroxide to inhibit endogenous peroxidases in cell-based ELISA
病毒滴度(TCID50)圖6 不同病毒滴度感染RD細胞后利用mAb CA16-19 通過ELISA檢測分析Fig.6 Analysis of RD cells infected with different virus titers were detected by ELISA utilizing mAb CA16-19
2.6膠體金免疫層析試紙條的特異性和敏感性分析 利用前期制備的mAb CA16-10[3]標記膠體金,將mAb CA16-19單抗用點膜機噴入反應膜上作為檢測線,組裝膠體金免疫層析試紙條,用組裝的膠體金試紙條對CA16、EV71和柯薩奇病毒B3進行特異性檢測試驗,僅CA16病毒培養上清可在檢測線和質控線上出現紅色條帶,EV71和柯薩奇病毒B3培養上清只在質控線上出現紅色條帶(圖7)。用試紙條分別對不同稀釋度的CA16樣品進行檢測,在3.125×106.25TCID50/0.1 mL稀釋度的檢測線上出現較弱紅色條帶,質控線清晰可見,而在6.25×106.25TCID50/0.1mL稀釋度的檢測線和質控線均有明顯紅色條帶,因此,該膠體金試紙條的檢測限為6.25×106.25TCID50/0.1 mL(圖8)。

A:EV71培養上清;B:柯薩奇病毒B3培養上清。圖7 膠體金免疫層析試紙條的特異性分析Fig.7 Specificity analysis of colloidal gold immunochromatographic assay
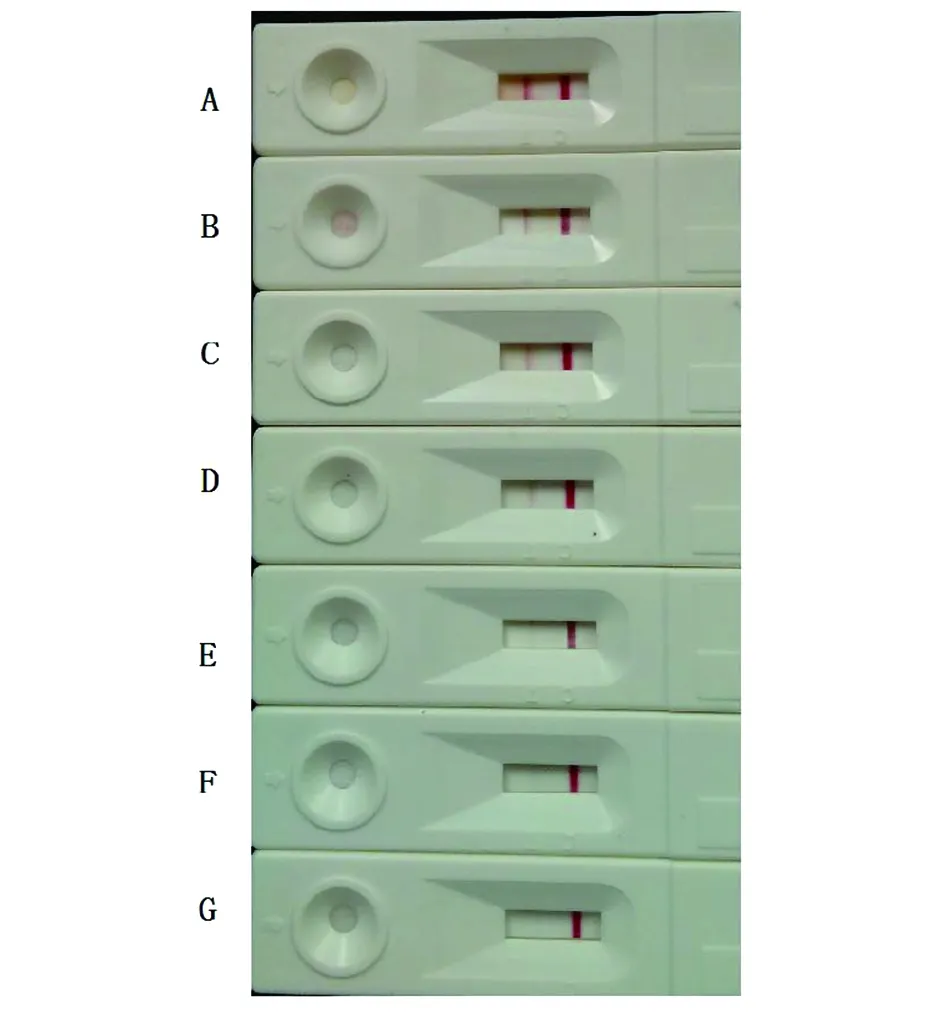
A:2.5×107.25TCID50/0.1 mL;B:1.25×107.25TCID50/0.1 mL;C:6.25×106.25TCID50/0.1 mL;D:3.125×106.25TCID50/0.1 mL;E:1.56×106.25TCID50/0.1 mL;F:7.8×105.25TCID50/0.1 mL;G:3.9×105.25TCID50/0.1 mL。圖8 膠體金免疫層析試紙條的靈敏性分析Fig.8 Sensitivity analysis of colloidal gold immunochromatographic strips
3 討 論
CA16和EV71引起的手足口病已成為我國較為嚴重的公共衛生問題,對疑似患者進行早期檢測,及早給予治療措施顯得非常重要。而在人群中及時發現感染患者并采取防控措施,可大大降低疾病流行和暴發風險。因此,建立CA16的早期快速檢測方法非常重要。目前CA16的檢測和實驗室診斷主要包括病毒分離培養、血清學檢測和分子生物學檢測,其中病毒分離培養是實驗室診斷的金標準,但是病毒分離周期長,操作需要二級生物安全實驗室和專業培訓等因素,限制了該方法的廣泛應用。血清學檢測中,常用中和試驗和酶聯免疫吸附試驗,主要檢測血清中特異性IgM和IgG,中和試驗需要采集急性期和恢復期血清樣本,不能進行早期診斷,多用于血清流行病學研究。傳統微量中和試驗周期長,需要特定的實驗室,而Hou W[4]等在此基礎上建立了酶聯免疫斑點中和試驗,縮短試驗周期,可用于抗CA16中和抗體測定。ELISA檢測血清特異性IgM的方法操作簡單,對檢測條件要求不高,檢測成本相對廉價[5],可作為有效的檢測手段。近幾年已被用于臨床診斷中,Gao C等[6]人通過基因工程技術分別重組表達了各腸道病毒VP1蛋白,建立ELISA方法并對人群不同腸道病毒感染血清抗體進行檢測與分析,描述人群血清流行病學情況。ELISA檢測IgM時,由于EV71與CA16以及其他腸道病毒存在抗體交叉反應,而影響檢測特異性,在結果分析時需注意[7]。隨著分子生物學技術的發展,病毒分子診斷技術應運而生,其中基于CA16病毒VP1基因序列設計的引物和探針已建立了實時熒光定量PCR(Real Time PCR)和RT-PCR,靈敏性和特異性均較高,可檢測到數個拷貝的病毒,以及多重聯合擴增方法可同時檢測CA16 和其他腸道病毒[8]。基因芯片技術(Microchip Assay)對多重病原體聯合檢測,適用于大樣本分析[9],有力的提高了病毒感染檢測的效率,但該技術從核酸提取到結果分析步驟較多,并容易出現交叉污染。本研究利用密度梯度離心法純化病毒顆粒,免疫小鼠制備抗CA16特異性單抗,并評價單抗在細胞ELISA和免疫化學染色試驗中的作用,同時,以單抗為材料建立膠體金免疫層析檢測試紙條。
氯化銫密度梯度離心純化技術純化CA16病毒顆粒時,由于密度梯度離心后病毒層為白色條帶,不易完全回收。因此,在密度梯度離心前將結晶紫加入輕密度梯度液中,在離心力的作用下,病毒顆粒由上層低密度區域向下層高密度區域移動過程中,低密度梯度液中的結晶紫會將病毒顆粒染成藍色,當病毒到達等密度區域后逐漸形成藍色病毒區帶,這樣便于回收病毒層。病毒顆粒電鏡下呈現二十面體立體對稱球形結構,并可觀察到空心病毒顆粒與完整病毒顆粒。另外,蔗糖密度梯度離心技術也可用于CA16的純化,并可將空心病毒顆粒與完整病毒顆粒分離開[10],CA16與EV71一樣,均可用蔗糖密度梯度離心分離成2種不同浮密度的顆粒[11],但是蔗糖的粘度系數較氯化銫高,離心時間較長。由于本研究主要為了獲得病毒抗原,無需將空心病毒顆粒和完整病毒顆粒分開,所以采用氯化銫梯度離心純化方法。Kattur Venkatachalam AR等[12]通過弱離子交換層析獲得高純度EV71病毒顆粒,除此之外,目前用于腸道病毒純化的方法還有凝膠過濾與離子交換結合及親和層析等技術[13-14],純化的病毒蛋白純度高,但回收效率稍低于密度梯度離心。也可先用液相層析系統純化病毒,然后用蔗糖密度梯度離心純化,這樣將層析技術與密度梯度離心技術相結合,獲得病毒顆粒更純,并可經蔗糖密度梯度離心將空心病毒顆粒與完整病毒顆粒分離,兩種方法的結合可顯著提高病毒純度,但病毒回收率與單獨層析法相比下降20%[15],所以,應根據具體要求選擇合適的純化方法。
此次純化病毒顆粒滅活后免疫小鼠篩選出1株分泌抗CA16特異性單抗的雜交瘤細胞株,mAb CA16-19為IgG2a亞型,效價為10-5。此次制備的mAb CA16-19可用于細胞免疫熒光試驗、細胞免疫化學染色試驗,可用于CA16病毒感染機制或抗原表位的研究。同時也通過mAb CA16-19 建立了細胞ELISA方法,可在病毒感染RD細胞后24 h進行檢測,由于ELISA吸光度值較直接觀察細胞病變效應更客觀,因此,細胞ELISA可用于快速中和試驗。與此同時,利用前期制備的mAb CA16-10標記膠體金,將mAb CA16-19單抗用點膜機噴入反應膜上作為檢測線,組裝膠體金免疫層析試紙條,并對其敏感性和特異性分析,試紙條可與CA16培養上清特異反應,與EV71和柯薩奇病毒B3不發生交叉反應,最低檢測限為6.25×106.25TCID50/0.1mL。因此,該方法較病毒分離、血清學檢測和分子生物學檢測方法操作簡單、快速、準確,無需其他設備進行檢測,10 min內肉眼可判定結果,可用于臨床快速檢測和流行病學現場快速篩查。Zhang J等[16]也用膠體金免疫層析法分別檢測抗EV71和CA16的IgM抗體,與PCR和ELISA比較均顯示有較高的靈敏度,可用于現場快速檢測,但由于病原體較血清抗體出現早,病原體檢測對早期篩檢略勝一籌。
綜上,本研究通過密度梯度離心法純化出CA16病毒顆粒,成功制備出抗CA16特異性單克隆抗體,該抗體可用于細胞免疫熒光試驗、細胞免疫化學試驗及細胞ELISA中,并初步建立了膠體金免疫層析檢測法,為CA16病原學研究及快速檢測提供幫助。由于本中心實驗室腸道病毒株種類有限,未能全面進行試紙條交叉反應性分析。下一步還將采集CA16感染患兒咽拭子和糞便樣本進行臨床樣本檢測分析,繼續優化膠體金試紙條,提高檢測靈敏度和特異度,為臨床早期診斷和治療提供重要依據。

