冠心病患者PCI術后冠狀動脈藥物支架內再狹窄的危險因素分析
閻志,邢小衛,劉玉勝,王欣,李文元
(1山東大學第二醫院,濟南250033;2莘縣人民醫院)
流行病學調查顯示,我國心血管系統疾病呈逐年上升趨勢,致死人數在我國居民死亡總數中的占比超過40%,已成為我國重要的公共衛生問題之一[1]。經皮冠狀動脈介入治療(PCI)是治療冠心病患者的主要手段之一,PCI術后發生的支架內再狹窄(ISR)逐漸引起臨床關注。ISR是指PCI術后于支架邊緣外5 mm范圍內新出現的斑塊且狹窄程度大于50%的一類血管增生性病變[2]。普通金屬裸支架的ISR發生率為15%~30%,藥物洗脫支架可降低ISR的發生率,但仍有近10%的患者出現ISR[3]。隨著介入技術的發展,藥物洗脫支架與抗增生藥物如紫杉醇、雷帕霉素、佐他莫司、依維莫司、他克莫司等綜合應用,提高了介入治療的成功率[4],但仍未徹底解決ISR問題。因此探討ISR相關危險因素并加以預防顯得十分迫切。本研究回顧性分析125例冠心病患者行PCI術后發生ISR的影響因素,旨在為預防和減少ISR提供參考。
1 資料與方法
1.1 臨床資料 選取2013年1月~2015年12月在山東大學第二醫院行PCI術后1年復查冠狀動脈造影的患者125例,男94例、女31例,年齡43~78(62.76±9.25)歲。患者均因冠狀動脈狹窄程度>75%而行PCI,共植入255枚藥物涂層支架,涂層藥物包括雷帕霉素、紫杉醇。排除標準:非首次植入支架患者或既往有冠狀動脈搭橋術患者;既往有因支架內狹窄于支架內植入支架患者;因冠狀動脈慢性完全閉塞植入支架患者;新發非支架部位狹窄程度≥50%者;合并惡性腫瘤、自身免疫性疾病、嚴重肝腎功能不全患者;心肌病、先天性心臟病、瓣膜病患者。本研究經山東大學倫理委員會審核批準,所有患者簽署知情同意書。
1.2 ISR診斷方法 術后1年復查冠狀動脈造影。取左前斜、右前斜及頭腳軸狀位投影觀察冠狀動脈病變,分別對左主干、左前降支、右冠狀動脈和左回旋支病變狹窄程度予以準確評價。對于冠狀動脈造影記錄,安排2名介入醫師以獨立的方式完成相應診斷,如果診斷存在差異,則安排第3名醫生進行相關分析,采用盲法對研究對象的其他數據進行分析處理。ISR定義為靶血管管腔直徑狹窄≥50%,包括支架內、距支架邊緣≤5 mm的支架兩端的冠狀動脈。
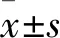
2 結果
2.1 PCI術后ISR發生情況 冠狀動脈造影結果顯示,發生ISR 43例,未發生ISR 82例。
2.2 ISR與非ISR患者的臨床資料比較 與非ISR患者比較,ISR患者年齡、有高血壓及糖尿病史比例、不規律口服抗血小板藥物比例、TC、LDL-C、冠狀動脈多支病變比例增加(P均<0.01),因不穩定型心絞痛行PCI比例、前降支植入支架比例、支架直徑<3 mm比例、支架長度>20 mm比例增加(P均<0.05)。見表1、2。
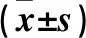
表1 ISR與非ISR患者的臨床資料(計量資料)比較
2.3 PCI術后發生ISR的影響因素分析結果 將2.2中有統計學意義的指標納入Logistic回歸模型,以是否發生ISR為應變量,以糖尿病史、高血壓史、LDL-C、冠狀動脈病變支數、支架植入原因、支架位置、支架長度、支架直徑、是否規律服用抗血小板藥物為自變量,相關賦值見表3。結果顯示,糖尿病史、高血壓史、LDL-C、多支病變、不穩定型心絞痛、前降支支架、支架長度>20 mm、支架直徑<3 mm、未規律服用抗血小板藥物是發生ISR的危險因素(P均<0.05),見表4。

表2 ISR與非ISR患者的臨床資料(計數資料)比較[例(%)]

表3 Logistic多因素回歸分析模型賦值表

表4 PCI術后發生ISR的多因素分析結果
3 討論
PCI術是目前治療冠心病的主要有效的治療手段,尤其是藥物涂層支架極大程度地改善了冠心病患者的療效和預后。盡管藥物涂層支架能顯著降低ISR風險,但支架內再狹窄引起的進行性心絞痛或急性心肌梗死等急性心臟病事件風險仍然存在,嚴重影響PCI術后的療效[5]。ISR是由生物、機械、技術及與患者自身相關的復雜因素介導形成的內膜增生,會導致靶血管的丟失,增加心臟病事件,因此早期識別及預防ISR尤為重要。關于ISR的發生機制目前尚未完全闡明,通常認為與冠狀動脈炎癥反應、內皮損傷以及miRNA高表達等因素有關[5]。本研究結果顯示,糖尿病史、高血壓史、LDL-C、多支病變、不穩定型心絞痛、前降支支架、支架長度>20 mm、支架直徑<3 mm、未規律服用抗血小板藥物是發生ISR的危險因素。
糖尿病、高血壓患者均存在血管病變相對復雜和內皮功能不穩定等問題,因此在PCI術治療期間,發生冠狀動脈內膜撕裂或夾層的可能性更大,促使血小板黏附、凝聚及平滑肌細胞向內膜遷移、增殖,葡萄糖也能直接損害冠狀動脈內皮細胞[6],這些因素均增加ISR發生率。糖代謝失衡激活血管內皮炎癥反應,是冠狀動脈粥樣斑塊形成的危險因素,患者支架術后持續血糖控制不佳,將加劇蛋白質糖基化及氧化過程,損傷血管內皮并啟動動脈粥樣斑塊形成,最終導致ISR的發生[7]。高血壓是冠心病的危險因素,血壓波動或持續高壓狀態時,血液加速產生對管壁的剪切力,損傷血管內皮細胞,增加ISR發生率,因此高血壓患者術后需嚴格控制血壓[8]。有糖尿病或高血壓病史的患者,在嚴格控制血壓、血糖的同時,可聯合他汀類藥物進行調脂、抗炎,以降低ISR風險。
高LDL-C血癥是冠心病的重要危險因素,高水平LDL-C激發炎癥反應,損傷血管內皮細胞,促進膽固醇在血管壁內的沉積,支架植入術后LDL-C持續升高誘發的炎癥狀態是造成ISR重要的危險因素[9]。研究發現,在規律服用他汀類藥物期間,增加膽固醇攝入與PCI術后ISR風險存在相關性,在藥物治療的同時控制膽固醇攝入可以減少心臟病事件的發生[10]。因此,PCI術后規范用藥非常重要。PCI術后強化他汀治療降低LDL-C水平可以減少新生內膜增生[11]。徐凱等[12]報道了接受PCI術治療3~6個月之后按規定復查CAG的948例患者,結果顯示患者的LDL-C水平與ISR程度顯著相關。本研究結果也發現,術后LDL-C水平與ISR相關,提示術后需長期口服調脂藥物,嚴格控制LDL-C至1.8 mmol/L以下。
陳韻岱等[13]認為,前降支開口病變發生ISR的概率顯著升高。多項回顧性研究顯示,左前降支發生ISR的概率明顯高于左回旋支和右冠狀動脈。原血管管徑較細、冠狀動脈病變程度較重者更容易發生ISR[14]。相比單支病變,多支病變可能會增加ISR的發生率,Mercado等[15]研究認為,冠狀動脈多支病變是ISR的相關因素之一。本研究結果顯示,ISR患者中前降支病變、多支病變比例較非ISR患者增高,提示針對前降支病變或復雜病變,需嚴格掌握PCI手術指征,采用血管內超聲或OCT等血管影像學技術,優化手術方案。
藥物涂層支架表面的藥物會抑制血管內膜增生,造成冠狀動脈內皮修復減慢,因此在PCI術后需要至少口服1年阿司匹林和氯吡格雷或替格瑞洛。我國2012年PCI指南[16]中提及,由于并發出血、行其他外科手術、患者(家屬)不知情等各類原因而導致的未按醫囑用藥的患者,ISR比例明顯升高。因此抗血小板藥物仍然是治療冠心病的基石,適當延長雙聯抗血小板治療時間可以使因ISR再次支架術后患者獲益[17]。本研究結果顯示,ISR患者PCI術后不規律口服兩聯抗血小板藥物治療比例增高,提示PCI術后需規律口服藥物,針對高出血風險或藥物耐受性差的患者,盡可能避免支架植入。
術者的熟練程度及經驗也是影響ISR的因素之一。ISR主要是因為內膜受損,誘發內膜增生,造成管腔隨著時間推移而有所丟失。在行PCI術治療的過程中,無論是球囊擴張給內膜帶來的損傷,還是支架產生的機械刺激,均可能給炎癥因子施加一種激活效應,誘發局部炎癥,進而使平滑肌細胞受到刺激而發生增殖反應,同時也會導致細胞外基質發生一定的沉積,從而造成內膜增厚以及ISR[18]。有研究指出,無論是血管直徑還是支架長度,均與ISR有一定的相關性[19,20]。直徑較小的動脈適應新生內膜向腔內增殖的能力相對偏弱,較細的血管植入支架后血流速度更慢,接受PCI術后更容易發生ISR[21]。因彌漫性病變需植入多枚支架,支架金屬材料與血管壁接觸的總面積大,刺激血管內皮增生及斑塊形成,增加ISR的風險[22]。本研究發現,支架直徑<3 mm、支架長度>20 mm是ISR的危險因素,提示優化PCI的重要性,針對小血管病變或彌漫性病變,應用血管內超聲、OCT、FFR能準確識別血管內結構,精準化指導支架置入術,減少支架植入數量,降低ISR的發生率。
綜上所述,有高血壓史、糖尿病史、LDL-C≥1.8 mmol/L、不穩定型心絞痛、不規律服用抗血小板藥物、多支病變、支架位于左前降支、支架直徑<3 mm、支架長度>20 mm的冠心病患者行PCI術后易發生ISR。由于本研究為回顧性研究,樣本量偏小,且隨訪時間短,具有一定的局限性,需增加樣本量進一步探討。

