胃癌細胞中乳酸脫氫酶A表達變化及其對EMT的影響
陳妍,陳加華,李小琴
(1江蘇大學附屬醫院,江蘇鎮江212031;2徐州醫科大學附屬淮安醫院;3沭陽仁慈醫院)
胃癌是起源于胃黏膜上皮的惡性腫瘤[1]。資料顯示,2015年我國胃癌發病67.91萬例,死亡49.8萬例,發病率與病死率均居世界首位[2]。腫瘤侵襲與轉移是影響患者治療后復發的關鍵,因此尋找胃癌特異性生物學指標對治療胃癌及探究胃癌的侵襲與轉移機制具有重要意義。研究顯示,上皮間質轉化(EMT)在胃癌的侵襲與轉移中起核心作用[3]。乳酸脫氫酶A(LDH-A)是糖酵解途徑中的關鍵酶,其高表達與惡性腫瘤的發生、發展及侵襲、轉移密切相關[4]。蔡志煅等[5]報道,上調LDH-A表達能夠增強前列腺癌細胞的糖酵解途徑,促進前列腺癌細胞增殖。LDH-A是否參與了胃癌細胞的EMT過程,目前鮮有報道。2018年2~9月,我們觀察了胃癌細胞中LDH-A的表達變化,并采用siRNA技術沉默LDH-A表達,觀察其對胃癌細胞EMT的影響,旨在探討LDH-A在胃癌進展中的作用。
1 材料與方法
1.1 主要材料 人胃癌細胞株OCUM-1購自南京科佰生物科技有限公司,人正常胃黏膜上皮細胞株RGM-1購自上海基免生物科技有限公司。Lipfoctamine2000轉染試劑購自賽默飛世爾科技有限公司,siRNA無義對照序列、LDH-A siRNA由上海中洪博元生物技術公司設計并構建,RNA提取試劑盒、反轉錄試劑盒、SYBR Green PCR Kit購自普洛麥格(北京)生物技術有限公司。
1.2 細胞培養 將OCUM-1細胞和RGM-1細胞復蘇后,加入含10%胎牛血清的DMEM培養基,置于37 ℃、5% CO2培養箱中培養。當細胞融合度接近90%時,進行消化傳代。
1.3 細胞分組與干預 將OCUM-1細胞隨機分為空白對照組、轉染對照組和LDH-A siRNA組。空白對照組只加入培養基,轉染對照組轉染siRNA無義對照序列,LDH-A siRNA組轉染LDH-A siRNA序列。培養細胞至融合度約50%時進行siRNA轉染,轉染方法參照Lipfoctamine2000脂質體轉染試劑說明書。轉染48 h后,收集各組細胞。
1.4 細胞中LDH-A mRNA檢測 采用qRT-PCR法。取對數生長期細胞,采用RNA提取試劑盒提取細胞總RNA,采用反轉錄試劑盒反轉錄RNA得到cDNA。采用SYBR Green PCR Kit對LDH-A進行相對定量,反應體系20 μL,反應條件:90 ℃ 30 s,57 ℃ 30 s,72 ℃ 30 s,共45個循環。所有樣品均重復測定3次。引物序列:LDH-A上游5′-GTCAGCAAGAGGGAGAAAGC-3′,下游5′-ATTCCACTCCATACAGGCACA-3′;內參GAPDH上游5′-GGTGAAGGTCGGAGTCAACG-3′,下游5′-CAAAGCTCATGGATGACC-3′。采用2-ΔΔCt法對LDH-A水平進行定量分析。
1.5 細胞中LDH-A蛋白檢測 采用Western blotting法。收集對數生長期細胞,PBS清洗,于冰上裂解離心后,吸取上清用于蛋白含量分析。采用Bio-Rad方法測定蛋白質濃度,然后進行10% SDS-PAGE電泳,轉膜,一抗4 ℃孵育過夜,TBST漂洗3次,二抗室溫孵育1.5 h,TBST漂洗3次,每次分別漂洗10 min,ECL化學發光法顯色。GIS凝膠成像分析系統拍照,以GAPDH作為內參照,分析各蛋白相對表達量。重復測定3次。
1.6 細胞形態學觀察 收集各組細胞,置于倒置顯微鏡下觀察細胞形態學變化,拍照并保存。
1.7 EMT相關蛋白表達檢測 采用Western blotting法檢測上皮型鈣黏蛋白(E-cadherin)、細胞角蛋白(Cytokeratin)、神經型鈣黏蛋白(N-cadherin)、鋅指轉錄因子(Snail)、β連環蛋白(β-catenin)、波形蛋白(Vimentin),檢測步驟同“1.5”。
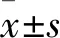
2 結果
2.1 OCUM-1細胞與RGM-1細胞中LDH-A mRNA及蛋白表達比較 OCUM-1細胞中LDH-A mRNA及蛋白表達水平均高于RGM-1細胞(P均<0.05)。見表1。
2.2 各組OCUM-1細胞LDH-A mRNA及蛋白表達比較 LDH-A siRNA組LDH-A mRNA及蛋白表達均低于空白對照組、轉染對照組(P均<0.05)。見表2。
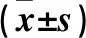
表1 胃癌與正常胃黏膜細胞中LDH-A mRNA及蛋白表達比較
注:與RGM-1細胞比較,*P<0.05。
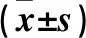
表2 各組OCUM-1細胞LDH-A mRNA及蛋白表達比較
注:與空白對照組比較,*P<0.05;與轉染對照組比較,#P<0.05。
2.3 各組OCUM-1細胞形態學表現 空白對照組、轉染對照組細胞排列松散,擴散細胞數量多,細胞間黏附明顯被破壞,部分細胞呈明顯梭形,表現為間質細胞特性;LDH-A siRNA組細胞排列緊密,細胞黏附性增加,逐漸表現為上皮細胞特性。見圖1。

注:圖中箭頭所指細胞呈明顯梭形。
圖1 各組OCUM-1細胞形態學比較
2.4 各組OCUM-1細胞EMT相關蛋白表達比較 LDH-A siRNA組E-cadherin、Cytokeratin蛋白表達高于空白對照組、轉染對照組,N-cadherin、Snail、β-catenin、Vimentin蛋白表達低于空白對照組、轉染對照組(P均<0.05)。見表3。
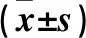
表3 各組OCUM-1細胞EMT相關蛋白表達比較
注:與空白對照組比較,*P<0.05;與轉染對照組比較,#P<0.05。
3 討論
胃癌的發病率與病死率均較高,雖然近年來隨著醫療技術的進步,胃癌的治療效果得到提升,但總體治療效果仍不盡人意。導致胃癌迅速進展的主要原因是腫瘤細胞的浸潤與轉移[6],因此尋找能夠抑制腫瘤細胞浸潤和轉移的特異性腫瘤標志分子,對于胃癌的靶向治療具有重要意義。
LDH-A屬于乳酸脫氫酶家族同工酶,其主要功能是催化丙酮酸轉化為乳酸,是影響糖酵解的關鍵酶之一[7]。與正常細胞相比,腫瘤細胞的代謝特點是即使在有氧的條件下也能夠進行糖酵解。研究表明,LDH-A在淋巴瘤等多種腫瘤組織中均表達上調,且其表達水平與腫瘤分化程度關系密切[8]。Zhai等[9]報道,抑制LDH-A表達能夠抑制鼻咽癌細胞增殖,誘導G2/M細胞周期停滯,促進細胞凋亡。本研究結果顯示,胃癌OCUM-1細胞LDH-A mRNA及蛋白表達均高于正常胃黏膜上皮細胞,提示LDH-A在胃癌細胞中表達上調,可能作為促癌因子發揮作用。
EMT是指上皮樣細胞在病理與生理條件下向間質樣細胞轉化的現象,上皮細胞由原先長方形、扁圓形或立方形等規則的上皮細胞,變為紡錘形、梭形、星形等不規則的間質細胞;細胞骨架發生改變,進一步使上皮細胞失去極性,細胞之間的連接性和黏附性降低,獲得較高的浸潤與轉移、抑制凋亡等能力[10]。本研究通過siRNA技術沉默胃癌細胞中的LDH-A表達,觀察細胞形態的變化,結果顯示空白對照組、轉染對照組胃癌細胞排列松散,擴散細胞數量多,細胞間黏附明顯被破壞,部分細胞呈明顯梭形,表現為間質細胞特性;LDH-A siRNA組胃癌細胞排列緊密,細胞黏附性增加,逐漸表現為上皮細胞特性。提示LDH-A表達下調可促使胃癌細胞維持上皮樣細胞特性,抑制腫瘤細胞浸潤、轉移,但其具體機制還不清楚。
EMT參與了腫瘤的發生發展過程。腫瘤細胞發生EMT后,除黏附性降低等形態特征改變外,還伴隨著上皮細胞特征蛋白E-cadherin、Cytokeratin和間質細胞特征蛋白N-cadherin、Snail、β-catenin、Vimentin表達的改變[11]。E-cadherin蛋白參與同型細胞間的黏附連接,在維持細胞形態及極性中具有重要作用,是一種經典的上皮細胞標志物。Cytokeratin是構成細胞骨架的一類中間絲狀物,是另一種上皮細胞特征標志物[12]。N-cadherin蛋白表達可促進腫瘤的浸潤與轉移[13]。Snail是EMT相關標志物,具有下調E-cadherin蛋白表達的作用。β-catenin是鈣黏蛋白復合體的亞基,主要介導細胞間黏附和參與基因表達[14]。Vimentin是細胞骨架蛋白中的一種,廣泛分布于各種內皮細胞、成纖維細胞等間質細胞中,在維持間質細胞形態、調節細胞黏附分子和細胞骨架蛋白等蛋白間相互作用中發揮重要作用[15]。Scarpa等[16]研究結果表明,EMT伴隨E-cadherin蛋白向N-cadherin蛋白的轉化,鈣黏蛋白轉換通過由細胞復極化產生更強的作用力,使細胞間連接分解。蘇醒等[17]研究發現,Snail蛋白高表達和E-cadherin蛋白低表達與膽管癌的發生、浸潤與轉移(膽管結石上皮細胞惡性轉化)有關。袁明等[18]研究表明,結腸癌細胞EMT過程中伴隨著β-catenin與N-cadherin蛋白表達上調和E-cadherin蛋白表達下調。張燦燦等[19]報道,E-cadherin蛋白表達在上皮性卵巢癌細胞中表達下調,Vimentin及Snail蛋白表達上調,E-cadherin、Vimentin與Snail蛋白的表達調控與EMT過程有關。本研究結果顯示,轉染LDH-A siRNA后,胃癌OCUM-1細胞中E-cadherin、Cytokeratin蛋白表達顯著升高,N-cadherin、Snail、β-catenin、Vimentin蛋白表達顯著降低,表明LDH-A siRNA可使E-cadherin等上皮細胞特征蛋白表達上調,N-cadherin等間質細胞特征蛋白表達下調,提示LDH-A siRNA可能抑制胃癌細胞EMT過程。
綜上所述,胃癌細胞中LDH-A表達升高;沉默LDH-A表達可上調胃癌細胞上皮細胞特征蛋白表達、下調間質細胞特征蛋白表達,從而抑制胃癌細胞的EMT進程。本研究僅探究了LDH-A在胃癌細胞中的表達情況及其對胃癌細胞EMT相關蛋白的影響,具體調控機制仍需進一步深入研究。

